- 105.00 KB
- 2021-06-21 发布
- 1、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 2、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报QQ:3215808601
2014年中考化学复习卷:实验方案的设计和评价
一、单项选择题:
1.对下列实验中出现的异常现象分析合理的是( )
A.
制取CO2气体时,始终收集不到CO2──收集CO2的集气瓶没盖严
B.
点燃氢气时,发生爆炸──点燃前可能没有检查氢气的纯度
C.
细铁丝在氧气中燃烧时,集气瓶底炸裂──由于引燃的火柴过长
D.
验证空气中氧气含量时,进入集气瓶中的水少于──红磷过量
2.下列实验方案中,设计合理的是( )
A.
用过滤的方法软化硬水
B.
用燃烧木炭的方法制备纯净的二氧化碳气体
C.
用浓硫酸除去氢气中的水蒸气
D.
用紫色石蕊溶液鉴别澄清石灰水和氢氧化钠溶液
3.解决下列问题所设计的实验方案中,合理可行的是( )
A.
可根据气体燃烧的火焰来鉴别H2、CH4、CO三种气体
B.
在空气中利用加热的方法除去氧化铜中的少量炭粉
C.
区别氢氧化钠和碳酸钠溶液最简单的方法是滴加石蕊试剂手观察溶液颜色的变化
D.
滴加氯化钡有白色沉淀生成,证明某溶液中一定含有CO32﹣或SO42﹣
4.下列小实验不能成功的是( )
A.
用食醋制无壳鸡蛋
B.
用紫卷心菜自制酸碱指示剂
C.
用活性炭将硬水软化
D.
用灼烧闻气味的方法区分棉纤维和羊毛纤维
二、实验探究题:
5.某化学探究小组的同学从实验废液中回收铜,得到的铜样品中含有少量的铁粉.为测定样品中铜的质量分数,同学们按下述两种方案分别进行实验.
方案一:加入过量稀硫酸充分反应,将铜样品过滤,将得到的固体洗涤、干燥、称量.
方案二:加入过量硫酸铜溶液充分反应,将铜样品过滤,将得到的固体洗涤、干燥、称量.
(1)请写出两个方案中发生反应的化学方程式 _________ , _________ .
(2)方案一反应进行完毕时的现象是 _________ .
(3)用上述方案进行实验都 _________ (填“能”或“不能”)测得样品铜的质量分数,理由是 _________ .
6.有一包白色固体粉未,可能是CaCO3、K2SO4、CuSO4、KNO3和BaCl2中的一种或几种组成,小明同学做了如下实验:
(1)取适量该白色固体粉末加入到足量水中,得白色沉淀,上层清液无色;
(2)向白色沉淀中加入足量稀硝酸,沉淀只有部分溶解.由此可判断出:原白色粉末中一定含有的是
_________ ,一定不含的是 _________ .
7.碳酸钙是一种白色固体,可溶于稀盐酸并产生无色气体.某同学想知道稀盐酸中的哪种粒子(H2O、H+、Cl﹣)能使碳酸钙溶解并产生无色气体.请你和他一起通过图①、②、③三个实验完成这次探究活动.
(1)你提出的假设是 _________ .
(2)通过实验①可以证明 _________ .
(3)要证明另外两种粒子能否溶解碳酸钙并产生无色气体,还需要进行实验②和③,在③中应加入 _________ .
(4)探究结果为 _________ .你认为除实验②和③所用的试剂外,还能够溶解碳酸钙并产生无色气体的一种常见物质是 _________ .
(5)查阅资料与交流表达:某同学查阅资料得知硫酸钙微溶于水.你认为在实验室里制取二氧化碳气体时能否用稀硫酸代替稀盐酸与块状石灰石(主要成分为碳酸钙)反应制取二氧化碳气体? _________ (填“能”或“不能”),原因是 _________ .
8.学校实验室的废液缸中收集了学生在实验室制取CO2后残留的废液.小红同学想探究废液中溶质的成分,请你一同参与探究并回答下列问题:
【提出问题】废液中的溶质是什么物质?
【做出猜想】小红认为废液中报溶质只有CaCl2.你认为还可能含有的溶质是 _________ (填化学式).
【查阅资料】CaCl2溶液呈中性.
【实验与结论】
①小红取少量CaCl2溶液分别加入到2支试管中,并向其中分别滴入无色酚酞试液作对比实验,结果两试管中溶液均无色,于是小红认为自己的猜想是正确的.
②你认为小红的实验 _________ (填“能”或“不能”)证明他的猜想,理由是 _________ .
③如果要证明你的猜想是正确的,你选择的试剂是 _________ ,实验中可以看到的现象是 _________ .
【拓展与应用】
①若实验证明你的猜想是正确的,想要处理废液只得到CaCl2溶液,应向废液中加入过量的 _________ ,反应完成后过滤.
②通过以上探究,你认为实验室的废液未经处理直接倒人下水道,可能造成的危害是 _________ (写一条).
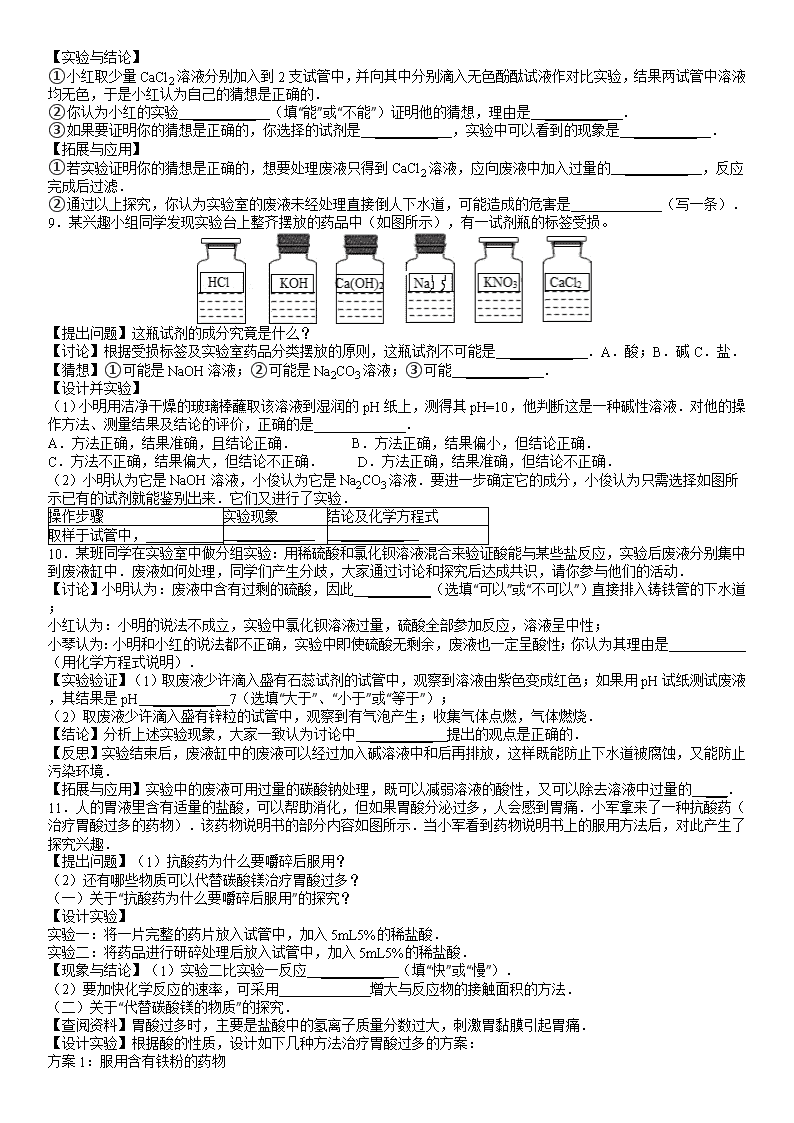
9.某兴趣小组同学发现实验台上整齐摆放的药品中(如图所示),有一试剂瓶的标签受损。
【提出问题】这瓶试剂的成分究竟是什么?
【讨论】根据受损标签及实验室药品分类摆放的原则,这瓶试剂不可能是 _________ .A.酸;B.碱C.盐.
【猜想】①可能是NaOH溶液;②可能是Na2CO3溶液;③可能 _________ .
【设计并实验】
(1)小明用洁净干燥的玻璃棒蘸取该溶液到湿润的pH纸上,测得其pH=10,他判断这是一种碱性溶液.对他的操作方法、测量结果及结论的评价,正确的是 _________ .
A.方法正确,结果准确,且结论正确. B.方法正确,结果偏小,但结论正确.
C.方法不正确,结果偏大,但结论不正确. D.方法正确,结果准确,但结论不正确.
(2)小明认为它是NaOH溶液,小俊认为它是Na2CO3溶液.要进一步确定它的成分,小俊认为只需选择如图所示已有的试剂就能鉴别出来.它们又进行了实验.
操作步骤
实验现象
结论及化学方程式
取样于试管中, _________
_________
_________
10.某班同学在实验室中做分组实验:用稀硫酸和氯化钡溶液混合来验证酸能与某些盐反应,实验后废液分别集中到废液缸中.废液如何处理,同学们产生分歧,大家通过讨论和探究后达成共识,请你参与他们的活动.
【讨论】小明认为:废液中含有过剩的硫酸,因此 _________(选填“可以”或“不可以”)直接排入铸铁管的下水道;
小红认为:小明的说法不成立,实验中氯化钡溶液过量,硫酸全部参加反应,溶液呈中性;
小琴认为:小明和小红的说法都不正确,实验中即使硫酸无剩余,废液也一定呈酸性;你认为其理由是 _________ (用化学方程式说明).
【实验验证】(1)取废液少许滴入盛有石蕊试剂的试管中,观察到溶液由紫色变成红色;如果用pH试纸测试废液,其结果是pH _________ 7(选填“大于”、“小于”或“等于”);
(2)取废液少许滴入盛有锌粒的试管中,观察到有气泡产生;收集气体点燃,气体燃烧.
【结论】分析上述实验现象,大家一致认为讨论中 _________ 提出的观点是正确的.
【反思】实验结束后,废液缸中的废液可以经过加入碱溶液中和后再排放,这样既能防止下水道被腐蚀,又能防止污染环境.
【拓展与应用】实验中的废液可用过量的碳酸钠处理,既可以减弱溶液的酸性,又可以除去溶液中过量的 ___.
11.人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物).该药物说明书的部分内容如图所示.当小军看到药物说明书上的服用方法后,对此产生了探究兴趣.
【提出问题】(1)抗酸药为什么要嚼碎后服用?
(2)还有哪些物质可以代替碳酸镁治疗胃酸过多?
(一)关于“抗酸药为什么要嚼碎后服用”的探究?
【设计实验】
实验一:将一片完整的药片放入试管中,加入5mL5%的稀盐酸.
实验二:将药品进行研碎处理后放入试管中,加入5mL5%的稀盐酸.
【现象与结论】(1)实验二比实验一反应 _________ (填“快”或“慢”).
(2)要加快化学反应的速率,可采用 _________ 增大与反应物的接触面积的方法.
(二)关于“代替碳酸镁的物质”的探究.
【查阅资料】胃酸过多时,主要是盐酸中的氢离子质量分数过大,刺激胃黏膜引起胃痛.
【设计实验】根据酸的性质,设计如下几种方法治疗胃酸过多的方案:
方案1:服用含有铁粉的药物
方案2:服用含有氧化钙的药物
方案3:服用含有氢氧化铝的药物
方案4:服用含有纯碱或小苏打的药物
【讨论与交流】
(1)方案3中发生的反应的化学方程式为 _________ .铁属于人体需要的微量元素,缺铁容易患 _________ ,但是如果摄入量超标对人体反而有害,因此在药物中的用量需要严格控制.
(2)其余三个方案中,不合理的是方案 _________ ,理由是 _________ .
【拓展与迁移】
氢氧化镁、碳酸钙等也常用于作抗酸药.请你综合分析总结这些抗酸物质必须具备的两个条件:一是能与胃酸作用;二是 _________ .
12.实验室有一包含有少量MgCl2和CaCl2的粗盐,某小组同学要得到纯净的氯化钠固体,进行了如下实验.请回答相关问题:
(1)第一步将粗盐加水溶解,向其中加入过量的氢氧化钠溶液并搅拌,产生白色沉淀.目的是为了除去 _________ .某同学提出:“如果把氢氧化钠溶液换成氢氧化钾溶液,行不行?”小组同学经讨论,一致认为不可行.理由是 _________ .
(2)第二步向上述液体中再加入过量的碳酸钠溶液并搅拌,产生白色沉淀.发生反应的化学方程式为 _________ .
(3)第三步过滤.过滤得到的固体沉淀物是 _________ (填化学式)
(4)第四步向滤液中加入过量的试剂A的目的是: _________ .
(5)第五步将溶液蒸发结晶得到氯化钠固体.
(6)若不考虑操作过程中物质的损耗,最终获得氯化钠质量比原粗盐中的氯化钠增多还是减少了?为什么? _________ .
13.小伟和小杨两位同学在帮助化学老师整理实验室时,发现了半瓶久置的氢氧化钙粉末,他俩决定对这瓶氢氧化钙粉末的组成进行实验探究.
【提出问题】这瓶氢氧化钙是否已经生成碳酸钙而变质?
【进行猜想】①氢氧化钙全部变成碳酸钙
②氢氧化钙部分变成碳酸钙
③氢氧化钙没有变质
【实验及结论】通过实验证明猜想2是正确的,请你同小伟、小杨一起完成实验报告:
实验步骤
实验现象
实验结论
取样品粉末,加入适量的水,充分搅拌,过滤.
①取少量滤液于试管中,滴入酚酞试液.
②取少量滤渣(或氢氧化钙样品)于试管中,加入盐酸
① _________
② _________
① _________
② _________
【联想与启示】
(1)氢氧化钙变质是由于氢氧化钙与空气中的 _________ 发生化学反应的缘故,因此氢氧化钙应 _________ 保存.
(2)氢氧化钙水溶液的pH _________ 7(选填“大于”、“小于”或“等于”).农业上一般可用氢氧化钙改良 _________ 性土壤.
14.归纳是化学学习的重要方法之一,小明在归纳整理化学知识是发现:①CO2与NaOH溶液;②稀HCl与NaOH溶液;③CO2与H2O发生反应时,均无明显现象.
【提出问题】如何证明上述反应确实发生了?
【设计并实验】
(1)向反应后的如图试管中加入少量 _________ ,若有气泡产生,则可证明CO2与NaOH溶液确实会发生反应.
(2)欲证明CO2与H2O反应,可向反应后的溶液中加入 _________ ,溶液变成红色,则证明CO2与H2O确实会发生反应.
(3)小明想用同样的思路和方法,用AgNO3溶液证明稀HCl与NaOH溶液发生了反应.小红提出反对意见.理由是 _________ .小红认为:将无色酚酞试液滴入盛有NaOH溶液的试管中,溶液变成 _________ 色,再滴入稀盐酸,观察溶液颜色 _________ 既可证明反应的发生.
【交流与归纳】
通过上述实验(3)的探究,小明总结出:可以通过证明变化过程中某一反应物的缺失,来证明反应的发生.
通过上述实验(1)和(2)的探究,你能总结出: _________ ,来证明反应的发生.
15.在化学实验室,某探究小组的同学发现盛NaOH溶液的试剂瓶瓶口有一些白色固体,他们认为可能是NaOH变质了,为此他们展开了探究,请你参与.
[查阅资料]NaOH溶液露置于空气中易吸收CO2而变质,但无明显现象.碳酸钠溶液的PH>7.
[提出问题]怎样检验一瓶露置于空气中一段时间的NaOH溶液是否变质.
[实验探究]从一瓶露置于空气中一段时间的NaOH溶液中,分别取等量溶液装入A、B两支试管,进行探究.
1向A试管中滴入石蕊试液,根据实验现象,有同学认为原NaOH溶液没有变质;
2向B试管中加入足量的稀盐酸,根据实验现象,有同学认为原NaOH溶液已经变质;
[实验分析]
(1)根据同学们的实验结论,应观察到的实验现象分别是:
A试管 _________
B试管 _________
(2)写出向B试管中加入足量稀盐酸时发生反应的化学方程式:
一定发生的反应 _________
可能发生的反应 _________
(3)显然,他们的实验结论是矛盾的.实验中,根据试管 _________ (填A、B)的现象作出的结论肯定是错误的,原因是 _________ .
参考答案与试题解析
一、单项选择题:
1.B 2.C 3.B 4.C
二、实验探究题:
5.某化学探究小组的同学从实验废液中回收铜,得到的铜样品中含有少量的铁粉.为测定样品中铜的质量分数,同学们按下述两种方案分别进行实验.
方案一:加入过量稀硫酸充分反应,将铜样品过滤,将得到的固体洗涤、干燥、称量.
方案二:加入过量硫酸铜溶液充分反应,将铜样品过滤,将得到的固体洗涤、干燥、称量.
(1)请写出两个方案中发生反应的化学方程式 Fe+H2SO4=FeSO4+H2↑ , Fe+CuSO4=Cu+FeSO4 .
(2)方案一反应进行完毕时的现象是 固体表面无气泡冒出 .
(3)用上述方案进行实验都 不能 (填“能”或“不能”)测得样品铜的质量分数,理由是没有对原样品进行称量 .
6.有一包白色固体粉未,可能是CaCO3、K2SO4、CuSO4、KNO3和BaCl2中的一种或几种组成,小明同学做了如下实验:
(1)取适量该白色固体粉末加入到足量水中,得白色沉淀,上层清液无色;
(2)向白色沉淀中加入足量稀硝酸,沉淀只有部分溶解.由此可判断出:原白色粉末中一定含有的是
CaCO3、K2SO4、BaCl2 ,一定不含的是 CuSO4 .
7.碳酸钙是一种白色固体,可溶于稀盐酸并产生无色气体.某同学想知道稀盐酸中的哪种粒子(H2O、H+、Cl﹣)能使碳酸钙溶解并产生无色气体.请你和他一起通过图①、②、③三个实验完成这次探究活动.
(1)你提出的假设是 H+能使碳酸钙溶解并产生无色气体 .
(2)通过实验①可以证明 水分子不能使碳酸钙溶解并产生无色气体 .
(3)要证明另外两种粒子能否溶解碳酸钙并产生无色气体,还需要进行实验②和③,在③中应加入 氯化钠溶液或硝酸 .
(4)探究结果为 H+能使碳酸钙溶解并产生无色气体 .你认为除实验②和③所用的试剂外,还能够溶解碳酸钙并产生无色气体的一种常见物质是 食醋 .
(5)查阅资料与交流表达:某同学查阅资料得知硫酸钙微溶于水.你认为在实验室里制取二氧化碳气体时能否用稀硫酸代替稀盐酸与块状石灰石(主要成分为碳酸钙)反应制取二氧化碳气体? 不能 (填“能”或“不能”),原因是 会生成微溶于水的硫酸钙,阻止反应继续进行 .
8.学校实验室的废液缸中收集了学生在实验室制取CO2后残留的废液.小红同学想探究废液中溶质的成分,请你一同参与探究并回答下列问题:
【提出问题】废液中的溶质是什么物质?
【做出猜想】小红认为废液中报溶质只有CaCl2.你认为还可能含有的溶质是 HCl (填化学式).
【查阅资料】CaCl2溶液呈中性.
【实验与结论】
①小红取少量CaCl2溶液分别加入到2支试管中,并向其中分别滴入无色酚酞试液作对比实验,结果两试管中溶液均无色,于是小红认为自己的猜想是正确的.
②你认为小红的实验 不能 (填“能”或“不能”)证明他的猜想,理由是 酚酞遇盐酸也不变色,无法确定是否含有HCl .
③如果要证明你的猜想是正确的,你选择的试剂是 紫色石蕊试液或碳酸钠溶液或较活泼的金属 ,实验中可以看到的现象是 溶液变红或主生气泡 .
【拓展与应用】
①若实验证明你的猜想是正确的,想要处理废液只得到CaCl2溶液,应向废液中加入过量的 CaCO3 ,反应完成后过滤.
②通过以上探究,你认为实验室的废液未经处理直接倒人下水道,可能造成的危害是可能腐蚀铁制管道(写一条).
9.某兴趣小组同学发现实验台上整齐摆放的药品中(如图所示),有一试剂瓶的标签受损。
【提出问题】这瓶试剂的成分究竟是什么?
【讨论】根据受损标签及实验室药品分类摆放的原则,这瓶试剂不可能是 A .A.酸;B.碱;C.盐.
【猜想】①可能是NaOH溶液;②可能是Na2CO3溶液;③可能 NaCl或Na2SO4 .
【设计并实验】
(1)小明用洁净干燥的玻璃棒蘸取该溶液到湿润的pH纸上,测得其pH=10,他判断这是一种碱性溶液.对他的操作方法、测量结果及结论的评价,正确的是 B .
A.方法正确,结果准确,且结论正确.
B.方法正确,结果偏小,但结论正确.
C.方法不正确,结果偏大,但结论不正确.
D.方法正确,结果准确,但结论不正确.
(2)小明认为它是NaOH溶液,小俊认为它是Na2CO3溶液.要进一步确定它的成分,小俊认为只需选择如图所示已有的试剂就能鉴别出来.它们又进行了实验.
操作步骤
实验现象
结论及化学方程式
取样于试管中, 滴加稀盐酸
有气泡产生
猜想②正确;反应的化学方程式为:
Na2CO3+2HCl═2NaCl+H2O+CO2↑
10.某班同学在实验室中做分组实验:用稀硫酸和氯化钡溶液混合来验证酸能与某些盐反应,实验后废液分别集中到废液缸中.废液如何处理,同学们产生分歧,大家通过讨论和探究后达成共识,请你参与他们的活动.
【讨论】小明认为:废液中含有过剩的硫酸,因此 不可以 (选填“可以”或“不可以”)直接排入铸铁管的下水道;
小红认为:小明的说法不成立,实验中氯化钡溶液过量,硫酸全部参加反应,溶液呈中性;
小琴认为:小明和小红的说法都不正确,实验中即使硫酸无剩余,废液也一定呈酸性;你认为其理由是 H2SO4+BaCl2═BaSO4↓+2HCl (用化学方程式说明).
【实验验证】(1)取废液少许滴入盛有石蕊试剂的试管中,观察到溶液由紫色变成红色;如果用pH试纸测试废液,其结果是pH 小于 7(选填“大于”、“小于”或“等于”);
(2)取废液少许滴入盛有锌粒的试管中,观察到有气泡产生;收集气体点燃,气体燃烧.
【结论】分析上述实验现象,大家一致认为讨论中 小琴 提出的观点是正确的.
【反思】实验结束后,废液缸中的废液可以经过加入碱溶液中和后再排放,这样既能防止下水道被腐蚀,又能防止污染环境.
【拓展与应用】实验中的废液可用过量的碳酸钠处理,既可以减弱溶液的酸性,又可以除去溶液中过量的 氯化钡溶液 .
11.人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物).该药物说明书的部分内容如图所示.当小军看到药物说明书上的服用方法后,对此产生了探究兴趣.
【提出问题】(1)抗酸药为什么要嚼碎后服用?
(2)还有哪些物质可以代替碳酸镁治疗胃酸过多?
(一)关于“抗酸药为什么要嚼碎后服用”的探究?
【设计实验】
实验一:将一片完整的药片放入试管中,加入5mL5%的稀盐酸.
实验二:将药品进行研碎处理后放入试管中,加入5mL5%的稀盐酸.
【现象与结论】(1)实验二比实验一反应 快 (填“快”或“慢”).
(2)要加快化学反应的速率,可采用 研磨 增大与反应物的接触面积的方法.
(二)关于“代替碳酸镁的物质”的探究.
【查阅资料】胃酸过多时,主要是盐酸中的氢离子质量分数过大,刺激胃黏膜引起胃痛.
【设计实验】根据酸的性质,设计如下几种方法治疗胃酸过多的方案:
方案1:服用含有铁粉的药物
方案2:服用含有氧化钙的药物
方案3:服用含有氢氧化铝的药物
方案4:服用含有纯碱或小苏打的药物
【讨论与交流】
(1)方案3中发生的反应的化学方程式为 3HCl+Al(OH)3═AlCl3+3H2O .铁属于人体需要的微量元素,缺铁容易患 缺铁性贫血 ,但是如果摄入量超标对人体反而有害,因此在药物中的用量需要严格控制.
(2)其余三个方案中,不合理的是方案 2 ,理由是 氧化钙与水反应生成氢氧化钙,氢氧化钙有腐蚀性 .
【拓展与迁移】
氢氧化镁、碳酸钙等也常用于作抗酸药.请你综合分析总结这些抗酸物质必须具备的两个条件:一是能与胃酸作用;二是 无毒无害 .
12.实验室有一包含有少量MgCl2和CaCl2的粗盐,某小组同学要得到纯净的氯化钠固体,进行了如下实验.请回答相关问题:
(1)第一步将粗盐加水溶解,向其中加入过量的氢氧化钠溶液并搅拌,产生白色沉淀.目的是为了除去 MgCl2 .某同学提出:“如果把氢氧化钠溶液换成氢氧化钾溶液,行不行?”小组同学经讨论,一致认为不可行.理由是 会有氯化钾新杂质生成 .
(2)第二步向上述液体中再加入过量的碳酸钠溶液并搅拌,产生白色沉淀.发生反应的化学方程式为 Na2CO3+CaCl2═CaCO3↓+2NaCl .
(3)第三步过滤.过滤得到的固体沉淀物是 Mg(OH)2和CaCO3 (填化学式)
(4)第四步向滤液中加入过量的试剂A的目的是: 用稀盐酸除去过量的氢氧化钠和碳酸钠溶液或把过量的氢氧根离子和碳酸根离子除去等 .
(5)第五步将溶液蒸发结晶得到氯化钠固体.
(6)若不考虑操作过程中物质的损耗,最终获得氯化钠质量比原粗盐中的氯化钠增多还是减少了?为什么? 增加,因为有额外的氯化钠生成 .
13.小伟和小杨两位同学在帮助化学老师整理实验室时,发现了半瓶久置的氢氧化钙粉末,他俩决定对这瓶氢氧化钙粉末的组成进行实验探究.
【提出问题】这瓶氢氧化钙是否已经生成碳酸钙而变质?
【进行猜想】①氢氧化钙全部变成碳酸钙
②氢氧化钙部分变成碳酸钙
③氢氧化钙没有变质
【实验及结论】通过实验证明猜想2是正确的,请你同小伟、小杨一起完成实验报告:
实验步骤
实验现象
实验结论
取样品粉末,加入适量的水,充分搅拌,过滤.
①取少量滤液于试管中,滴入酚酞试液.
②取少量滤渣(或氢氧化钙样品)于试管中,加入盐酸
① 变红色
② 有气泡生成
① 氢氧化钙还有剩余
② 说明氢氧化钙与二氧化碳反应有碳酸钙生成
【联想与启示】
(1)氢氧化钙变质是由于氢氧化钙与空气中的 二氧化碳或CO2 发生化学反应的缘故,因此氢氧化钙应 密封 保存.
(2)氢氧化钙水溶液的pH 大于 7(选填“大于”、“小于”或“等于”).农业上一般可用氢氧化钙改良 酸 性土壤.
14.归纳是化学学习的重要方法之一,小明在归纳整理化学知识是发现:①CO2与NaOH溶液;②稀HCl与NaOH溶液;③CO2与H2O发生反应时,均无明显现象.
【提出问题】如何证明上述反应确实发生了?
【设计并实验】
(1)向反应后的如图试管中加入少量 稀盐酸 ,若有气泡产生,则可证明CO2与NaOH溶液确实会发生反应.
(2)欲证明CO2与H2O反应,可向反应后的溶液中加入 紫色石蕊试液 ,溶液变成红色,则证明CO2与H2O确实会发生反应.
(3)小明想用同样的思路和方法,用AgNO3溶液证明稀HCl与NaOH溶液发生了反应.小红提出反对意见.理由是 AgNO3溶液也能与稀HCl反应,产生白色沉淀 .小红认为:将无色酚酞试液滴入盛有NaOH溶液的试管中,溶液变成 红 色,再滴入稀盐酸,观察溶液颜色 变为无色 既可证明反应的发生.
【交流与归纳】
通过上述实验(3)的探究,小明总结出:可以通过证明变化过程中某一反应物的缺失,来证明反应的发生.
通过上述实验(1)和(2)的探究,你能总结出: 通过对生成物的判定 ,来证明反应的发生.
15.在化学实验室,某探究小组的同学发现盛NaOH溶液的试剂瓶瓶口有一些白色固体,他们认为可能是NaOH变质了,为此他们展开了探究,请你参与.
[查阅资料]NaOH溶液露置于空气中易吸收CO2而变质,但无明显现象.碳酸钠溶液的PH>7.
[提出问题]怎样检验一瓶露置于空气中一段时间的NaOH溶液是否变质.
[实验探究]从一瓶露置于空气中一段时间的NaOH溶液中,分别取等量溶液装入A、B两支试管,进行探究.
1向A试管中滴入石蕊试液,根据实验现象,有同学认为原NaOH溶液没有变质;
2向B试管中加入足量的稀盐酸,根据实验现象,有同学认为原NaOH溶液已经变质;
[实验分析]
(1)根据同学们的实验结论,应观察到的实验现象分别是:
A试管 紫色石蕊试液变蓝
B试管 有气泡生成
(2)写出向B试管中加入足量稀盐酸时发生反应的化学方程式:
一定发生的反应 Na2CO3+2HCl═2NaCl+H2O+CO2↑
可能发生的反应 NaOH+HCl═NaCl+H2O
(3)显然,他们的实验结论是矛盾的.实验中,根据试管 A (填A、B)的现象作出的结论肯定是错误的,原因是 碳酸钠也显碱性,也能使紫色石蕊变蓝 .
您可能关注的文档
相关文档
- 绍兴市2016年中考数学卷2021-06-21 22:28:3324页
- 2019-2020学年黑龙江省大庆市东风2021-06-21 22:28:327页
- 2020中考英语试题解析汇编(第02期)专2021-06-21 22:28:084页
- 2020高考化学一轮复习基础练(5)(含解2021-06-21 22:27:556页
- 一年级上册语文期中考试题2021-06-21 22:27:413页
- 2018-2019学年海南省海南中学高二2021-06-21 22:27:4019页
- 2017-2018学年江西省南昌市第十中2021-06-21 22:27:167页
- 北京市延庆区2019-2020学年高二下2021-06-21 22:27:0313页
- 2020届二轮复习电解质溶液课件(75张2021-06-21 22:26:4275页
- 2017-2018学年广西南宁市第三中学2021-06-21 22:25:3812页