- 179.00 KB
- 2021-06-21 发布
- 1、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 2、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报QQ:3215808601
20192019高考化学一轮基础练(5)
李仕才
一、选择题
1、如图所示,①和②为两个体积相同的固定容器,图中“”和“”分别表示氢原子和氧原子,则下列说法正确的是( )
A.若①中的H2为1 mol,则②中所含原子总数为3.01×1023个
B.①和②中气体的质量之比为1∶8
C.H2、O2均能发生化合反应,但不能发生置换反应
D.两容器的温度和压强均相同
解析 根据图示可知,①和②中H2与O2的分子个数之比为2∶1,若H2为1 mol,则O2为0.5 mol,故O原子数目为6.02×1023个,A项错误;①和②中H2与O2的分子个数之比为2∶1,所以其物质的量之比为2∶1,质量之比为1∶8,B项正确;H2能发生置换反应,如H2与CuO反应,O2也能发生置换反应,如O2与H2S反应,C项错误;根据阿伏加德罗定律,①和②两容器体积相同,但气体分子个数不同,所以两容器的温度和压强不可能均相同,D错误。
答案 B
2、某合作学习小组讨论辨析以下说法,其中正确的是( )
①粗盐和酸雨都是混合物;②沼气和水煤气都是可再生能源;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤纯碱和熟石灰都是碱;⑥豆浆和雾都是胶体
A.①②③④ B.①②⑤⑥
C.③⑤⑥ D.①③④⑥
解析 水煤气是不可再生能源;纯碱是Na2CO3,是一种盐而不是碱。因此②⑤错误。
答案 D
3、下列实验操作正确的是( )
编号
实验
操作
A
观察钠与水反应的现象
用镊子从煤油中取出金属钠,切下绿豆粒大小的钠,小心放入装满水的烧杯中
B
检验 NaHCO3 与Na2CO3 溶液
用小试管分别取少量溶液,然后滴加澄清石灰水
6
C
证明 Na2O2 与CO2 是放热反应
Na2O2 用棉花包裹,放入充满 CO2 的集气瓶中,棉花燃烧,说明是放热反应
D
检验 Na2CO3 溶液与K2CO3溶液
用铂丝分别蘸取溶液,在酒精灯外焰上灼烧,直接观察火焰的颜色
解析 应将钠表面的煤油用滤纸吸干且烧杯中不能装满水(否则会迸溅出液体),A错误;B项都有白色沉淀产生,错误;Na2O2 与 CO2 反应生成氧气,如果棉花燃烧说明达到了着火点,能证明是放热反应,C正确;观察钾的焰色反应应该透过蓝色钴玻璃,D错误。
答案 C
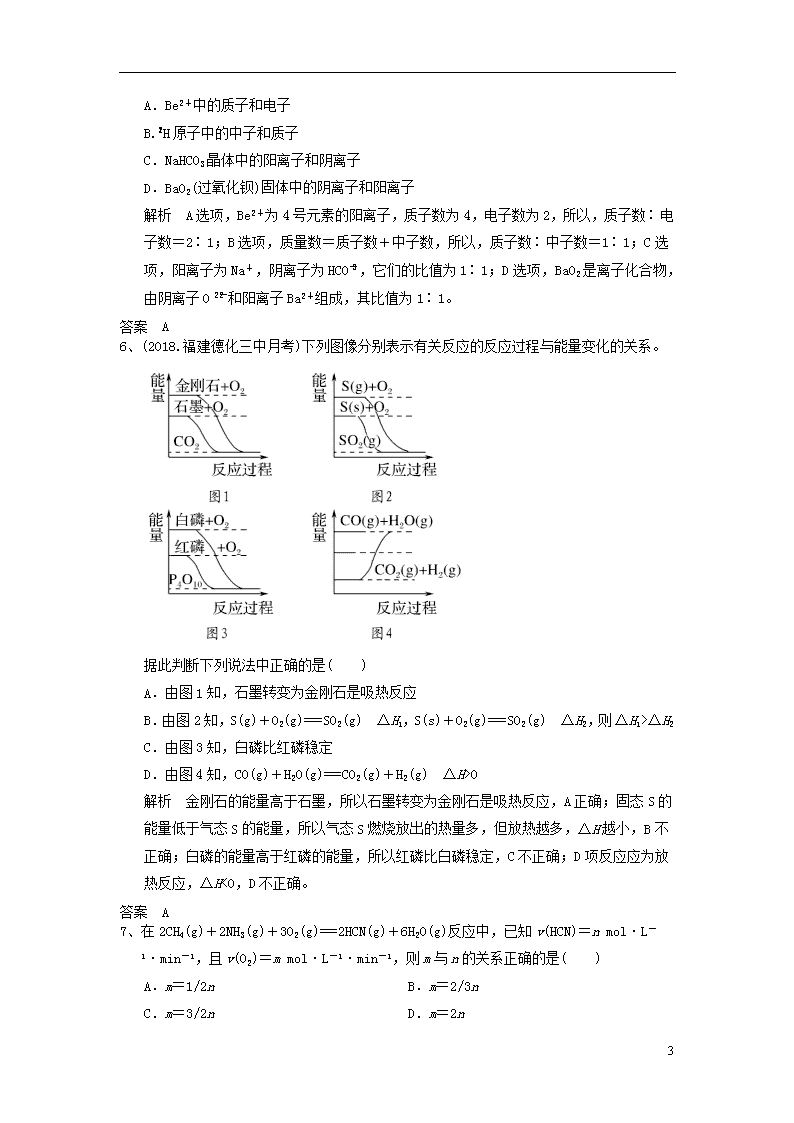
4、下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是( )
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O
解析 浓盐酸与二氧化锰反应制氯气需要加热,A项错误;除去氯气中的少量氯化氢应用饱和食盐水,且导气管应长进短出,B项错误;二氧化锰不溶于水,氯化锰溶于水,可用过滤的方法分离,C项正确;加热过程中氯化锰水解,最终得不到所要产物,D项错误。
答案 C
5、下列指定微粒的个数比为2∶1的是( )
6
A.Be2+中的质子和电子
B.H原子中的中子和质子
C.NaHCO3晶体中的阳离子和阴离子
D.BaO2(过氧化钡)固体中的阴离子和阳离子
解析 A选项,Be2+为4号元素的阳离子,质子数为4,电子数为2,所以,质子数∶电子数=2∶1;B选项,质量数=质子数+中子数,所以,质子数∶中子数=1∶1;C选项,阳离子为Na+,阴离子为HCO,它们的比值为1∶1;D选项,BaO2是离子化合物,由阴离子O和阳离子Ba2+组成,其比值为1∶1。
答案 A
6、(2018.福建德化三中月考)下列图像分别表示有关反应的反应过程与能量变化的关系。
据此判断下列说法中正确的是( )
A.由图1知,石墨转变为金刚石是吸热反应
B.由图2知,S(g)+O2(g)===SO2(g) ΔH1,S(s)+O2(g)===SO2(g) ΔH2,则ΔH1>ΔH2
C.由图3知,白磷比红磷稳定
D.由图4知,CO(g)+H2O(g)===CO2(g)+H2(g) ΔH>0
解析 金刚石的能量高于石墨,所以石墨转变为金刚石是吸热反应,A正确;固态S的能量低于气态S的能量,所以气态S燃烧放出的热量多,但放热越多,ΔH越小,B不正确;白磷的能量高于红磷的能量,所以红磷比白磷稳定,C不正确;D项反应应为放热反应,ΔH<0,D不正确。
答案 A
7、在2CH4(g)+2NH3(g)+3O2(g)===2HCN(g)+6H2O(g)反应中,已知v(HCN)=n mol·L-1·min-1,且v(O2)=m mol·L-1·min-1,则m与n的关系正确的是( )
A.m=1/2n B.m=2/3n
C.m=3/2n D.m=2n
6
解析 已知:v(HCN)=n mol·L-1·min-1,v(O2)=m mol·L-1·min-1,反应速率之比等于对应计量数之比,故n∶m=2∶3,即m=3/2n。
答案 C
8、下列说法不正确的是( )
A.明矾能水解生成Al(OH)3胶体,可用作净水剂
B.水解反应NH+H2ONH3·H2O+H+达到平衡后,升高温度平衡逆向移动
C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
D.盐类水解反应的逆反应是中和反应
解析 明矾溶液中铝离子水解生成的氢氧化铝胶体具有吸附悬浮杂质的作用,可以作净水剂,故A正确;水解反应是吸热反应,水解反应NH+H2ONH3·H2O+H+达到平衡后,升温平衡正向移动,故B错误;AlCl3、FeCl3、CuCl2溶液中金属阳离子均水解,水解产物中都有氯化氢,加热氯化氢挥发得到金属的氢氧化物沉淀,制备AlCl3、FeCl3、CuCl2均不能采用将其溶液直接蒸干的方法,故C正确;盐类水解是中和反应的逆反应,故D正确。
答案 B
9、下列说法中正确的是( )
A.分子式为C7H16的烷烃,含有3个甲基的同分异构体有2种
B.丙烯能发生取代反应、加成反应,还能使酸性KMnO4溶液褪色
C.甲苯中所有原子都处于同一平面
D.相同质量的甲烷和乙烷完全燃烧,乙烷耗氧量多
解析 分子式为C7H16的烷烃,主链为6个碳原子时,含有3个甲基的同分异构体有2种,主链为5个碳原子时,含有3个甲基的同分异构体有1种,共3种同分异构体,A项错误;丙烯中甲基上的H原子能发生取代反应,碳碳双键能发生加成反应,也能被酸性KMnO4溶液氧化,B项正确;甲苯中甲基上的3个氢原子与甲基碳原子一定不在同一个平面,C项错误;乙烷最简式为CH3,故相同质量(设为m g)的甲烷和CH3的物质的量分别为、,因此其消耗氧气的物质的量分别为×2、×,计算可知×2>×,则甲烷耗氧量多,D项错误。
答案 B
10、下列实验操作与安全事故处理错误的是( )
A.用试管夹从试管底由下往上夹住距离管口约三分之一处,手持试管夹长柄末端,进行加热
B.制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中
6
C.把玻璃管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻璃管插入端,缓慢旋进塞孔中
D.实验时不慎打破温度计水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中
解析 制备乙酸乙酯时,不能先加浓硫酸,否则会产生暴沸。
答案 B
11、下列表示氮原子结构的化学用语中,对核外电子运动状态描述正确且能据此确定电子的能级的是( )
A.
B.
C.1s22s22p3
D.
答案 C
12、下列对有机化合物的分类结果正确的是( )
A.乙烯CH2===CH2,苯、环己烷都属于脂肪烃
B.苯、环戊烷、环己烷同属于芳香烃
C.乙烯CH2===CH2、乙炔CH≡CH同属于烯烃
D.同属于环烷烃
解析 烷、烯、炔都属于脂肪烃,而苯、环己烷、环戊烷都属于环烃,而苯是环烃中的芳香烃。环戊烷、环丁烷及乙基环己烷均是环烃中的环烷烃。
答案 D
二、非选择题
1、(2018·泰安模拟)FeCl3是一种很重要的铁盐,主要用于污水处理,具有效果好、价格便宜等优点。工业上可将铁屑溶于盐酸中,先生成FeCl2,再通入Cl2氧化来制备FeCl3溶液。
(1)将标准状况下的a L氯化氢气体溶于100 g水中,得到盐酸的密度为b g·mL-1,则该盐酸的物质的量浓度是________。
(2)向100 mL的FeBr2溶液中通入标准状况下Cl2 3.36 L,反应后的溶液中Cl-和Br-
6
的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为________。
(3)FeCl3溶液可以用来净水,其净水的原理为___________________(用离子方程式表示)。用100 mL 2 mol·L-1的FeCl3溶液净水时,生成具有净水作用的微粒数________(填“大于”“等于”或“小于”)0.2NA。
解析 (1)注意盐酸的体积不是100 g水的体积,要用所得盐酸的质量和密度计算,还应注意单位换算。(2)根据氧化还原反应的规律,氯气先氧化Fe2+,反应后溶液中Cl-和Br-的物质的量浓度相等,表明溶液中无Fe2+,有FeBr3、FeCl3,n(Cl-)=×2=0.3 mol=n(Br-),根据电荷守恒及原子守恒知,n(Fe3+)=0.2 mol=n(Fe2+),则c(FeBr2)==2 mol·L-1。(3)Fe3+在水中发生水解:Fe3++3H2OFe(OH)3(胶体)+3H+,生成的Fe(OH)3胶体具有吸附作用,可吸附溶液中的杂质离子。Fe3+的水解是可逆反应,且Fe(OH)3胶体中的胶体粒子是由多个Fe(OH)3组成的集合体,所以生成的Fe(OH)3胶体粒子数目小于0.2NA。
答案 (1) mol·L-1 (2)2 mol·L-1
(3)Fe3++3H2OFe(OH)3(胶体)+3H+ 小于
6
您可能关注的文档
相关文档
- 天津市高考化学试卷解析2021-06-19 19:15:2915页
- 2017年全国统一高考化学试卷(新课标2021-06-17 12:06:3026页
- 2017年海南省高考化学试卷2021-06-04 20:45:3826页
- 2014北京高考化学试卷及答案2021-06-04 00:50:148页
- 2017年北京市高考化学试卷2021-06-02 22:38:1024页
- 2014年江苏省高考化学试卷(含答案)2021-05-31 20:51:5710页
- 高考化学试卷海南卷2021-05-26 02:07:159页
- 北京市高考化学试卷及解析2021-05-26 01:19:1424页
- 2013年海南省高考化学试卷答案与解2021-05-25 23:45:3118页
- 全国统一高考化学试卷大纲版2021-05-25 15:05:2914页