- 105.85 KB
- 2021-05-25 发布
微题型9 应用“四原则”进行离子推断
题型一 “定性型”离子检验与推断
1.(2019·山西八校联考)某溶液中可能含有Na+、NH、Ba2+、SO、I-、S2-中的几种。①用pH试纸测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是( )
A.Na+B.SOC.Ba2+D.NH
2.某溶液含有K+、Fe3+、SO、CO、I-中的几种。取样,滴加KSCN溶液后显红色。下列有关原溶液的说法不正确的是( )
A.一定存在的离子为Fe3+、SO
B.一定不存在的离子为CO、I-
C.不能确定的离子为K+、SO
D.确定是否含有K+需要经过焰色反应
3.(2019·昆明质检)某溶液仅有K+、Al3+、Mg2+、NH、Cl-、SO、HCO中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀全部溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,无沉淀产生。下列推断正确的是( )
A.肯定有Al3+、Cl-,一定没有HCO和SO
B.肯定有Al3+、Mg2+、Cl-,可能有NH、K+
C.肯定有Al3+、NH、Cl-,肯定没有HCO
D.该溶液可能显弱酸性,也可能显中性
题型二 “定量型”离子检验及推断
4.(2019·兰州联考)在Na+浓度为0.9mol·L-1的某澄清溶液中,还可能含有下表中的若干种离子:
阳离子
K+、Ag+、Mg2+、Ba2+
阴离子
NO、CO、SiO、SO
4
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
Ⅰ.向该溶液中加入足量稀HCl,产生白色沉淀并放出1.12L气体
Ⅱ.将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称得固体质量为3.6g
Ⅲ.在Ⅱ的滤液中滴加BaCl2溶液,无明显现象
下列说法错误的是( )
A.实验Ⅲ能确定一定不存在SO
B.K+一定存在,且c(K+)≤1.3mol·L-1
C.实验Ⅰ能确定一定不存在的离子是Ag+、Mg2+、Ba2+
D.实验Ⅰ中生成沉淀的离子方程式为SiO+2H+===H2SiO3↓
5.已知某溶液中可能含有NO、Cl-、SO、CO、NH、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液的成分,某学习小组做了如下实验:
①取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;
②将沉淀过滤、洗涤、灼烧,得到1.6g固体;
③向上述滤液中加入足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。
请回答下列问题:
(1)结合①和②,判断原溶液中肯定含有的离子是________________________________,
可以排除的离子是________。
(2)由③推知原溶液中一定有__________,其物质的量为________mol。
(3)综合(1)、(2)及题干信息,结合溶液中电荷守恒知识,还可以排除的离子是________。该学习小组最终得出结论:该溶液由________种阳离子(填数字,下同)和_____________________种阴离子组成。
题型三 “图文结合”型离子检验与推断
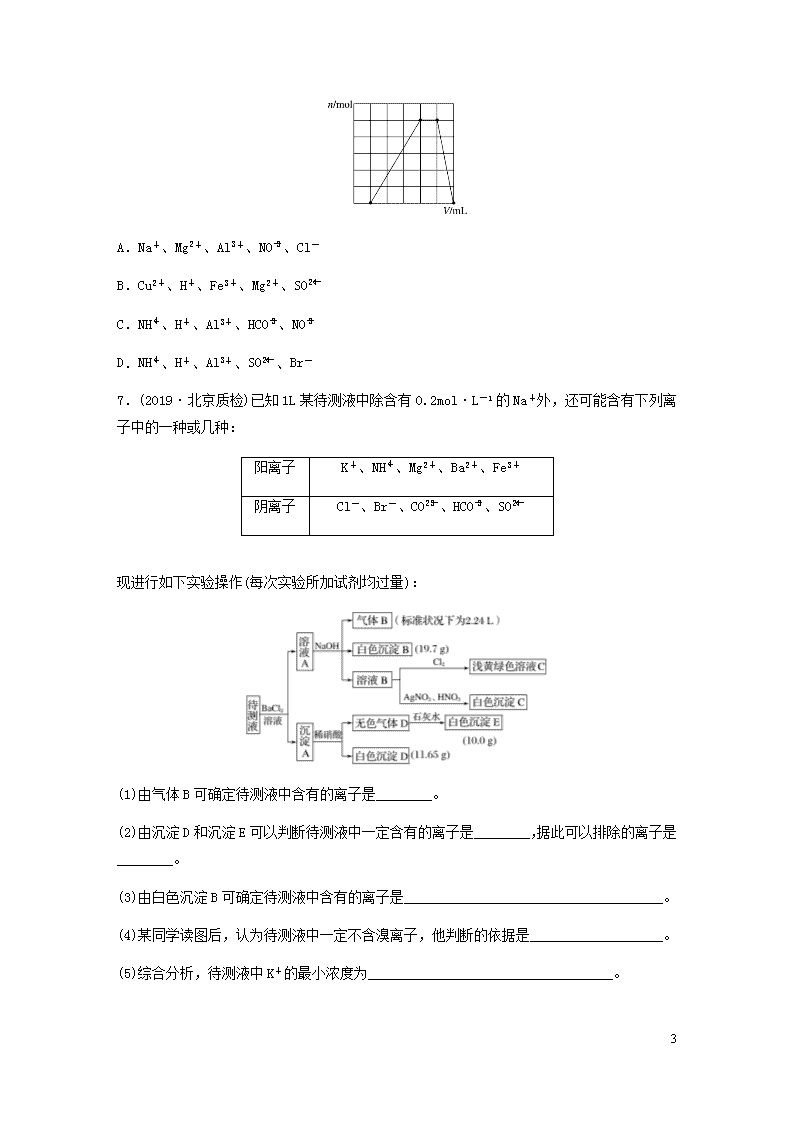
6.(2019·南宁模拟)在某溶液中滴加氢氧化钠溶液,产生沉淀的物质的量(n)与氢氧化钠溶液体积(V)的关系如图所示。该溶液中可能含有的离子组是( )
4
A.Na+、Mg2+、Al3+、NO、Cl-
B.Cu2+、H+、Fe3+、Mg2+、SO
C.NH、H+、Al3+、HCO、NO
D.NH、H+、Al3+、SO、Br-
7.(2019·北京质检)已知1L某待测液中除含有0.2mol·L-1的Na+外,还可能含有下列离子中的一种或几种:
阳离子
K+、NH、Mg2+、Ba2+、Fe3+
阴离子
Cl-、Br-、CO、HCO、SO
现进行如下实验操作(每次实验所加试剂均过量):
(1)由气体B可确定待测液中含有的离子是________。
(2)由沉淀D和沉淀E可以判断待测液中一定含有的离子是________,据此可以排除的离子是________。
(3)由白色沉淀B可确定待测液中含有的离子是_____________________________________。
(4)某同学读图后,认为待测液中一定不含溴离子,他判断的依据是___________________。
(5)综合分析,待测液中K+的最小浓度为___________________________________。
4
答案精析
1.A [由②知溶液中无I-、S2-,根据溶液电中性原则,则一定有SO,故无Ba2+;由①知溶液呈弱酸性,推知溶液中含NH,还需检验的是Na+。]
2.C 3.A 4.B
5.(1)NH、Fe3+ CO (2)SO 0.02
(3)Al3+和K+ 2 3
解析 ①取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol NH3,则100 mL溶液中含0.02 mol NH;同时产生红褐色Fe(OH)3沉淀,则原溶液中一定含有Fe3+,CO与Fe3+不能大量共存,则溶液中一定不含有CO。②将沉淀过滤、洗涤、灼烧,得到1.6 g Fe2O3固体,则原溶液中Fe3+的物质的量为0.02 mol。③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀,该沉淀为BaSO4且物质的量为0.02 mol,则原溶液中含SO 0.02 mol;溶液中所含阴离子的物质的量相等,根据电荷守恒知,溶液中还含有0.02 mol Cl-和0.02 mol NO,溶液中一定不含Al3+和K+。
6.D
7.(1)NH
(2)CO、SO Mg2+、Ba2+、Fe3+
(3)HCO
(4)向溶液B中通入氯气,溶液呈浅黄绿色(或向溶液B中滴加硝酸酸化的硝酸银溶液,出现白色沉淀)
(5)0.1mol·L-1
解析 待测液与BaCl2溶液反应生成沉淀A,沉淀A与稀硝酸反应生成白色沉淀D和无色气体D,无色气体D与石灰水反应生成白色沉淀E,则待测液中一定含有SO和CO,结合离子共存的条件可知待测液中一定不存在Mg2+、Ba2+、Fe3+;溶液A与NaOH反应生成的气体B为NH3,同时还生成了白色沉淀B,则待测液中一定含有NH、HCO;根据向溶液B中通入氯气,溶液呈浅黄绿色和向溶液B中滴加硝酸酸化的硝酸银溶液,出现白色沉淀可知,待测液中一定不存在Br-;由于实验过程中加入了BaCl2溶液,因此由白色沉淀C无法确定待测液中是否含有Cl-。结合题中数据可知待测液中n(NH)=0.1mol,n(HCO)=n(BaCO3)沉淀B==0.1mol,n(CO)=n(CaCO3)沉淀E==0.1mol,n(SO)=n(BaSO4)沉淀D=
4
=0.05mol,n(Na+)+n(NH)=0.2mol+0.1mol=0.3mol,2n(CO)+2n(SO)+n(HCO)=0.4 mol,根据电荷守恒知待测液中一定含有K+。若待测液中不含Cl-,则n(K+)=0.1 mol;若待测液中含有Cl-,则n(K+)>0.1 mol,所以c(K+)≥0.1mol·L-1。
4
相关文档
- 2019届一轮复习江苏专版化学平衡状2021-05-25 17:08:1942页
- 2021届高考化学一轮复习钠及其重要2021-05-25 17:07:438页
- 考前必背人教版中考化学重点难点考2021-05-25 17:07:138页
- 中考化学专题复习热点题型归类:第八2021-05-25 17:04:453页
- 人教版九年级化学上册《课题2 二氧2021-05-25 17:01:2933页
- 2019届高考化学一轮复习共价键类型2021-05-25 16:58:154页
- 化学人教版必修1练习:2-2-1酸、碱、2021-05-25 16:57:352页
- 人教版化学必修二1-3-1课件第一章 2021-05-25 16:57:3554页
- 2019届高考化学一轮复习烃和卤代烃2021-05-25 16:56:2716页
- 初中化学实验总结2021-05-25 16:55:4748页