- 285.83 KB
- 2021-05-24 发布
考点10 钠及其化合物
知识条目
必考要求
加试要求
1.钠的物理性质及用途
a
a
2.钠的化学性质(跟非金属、酸、某些氧化物的反应)
b
c
3.钠的生产原理
a
b
4.碳酸钠、碳酸氢钠的性质及检验方法
b
c
5.碳酸钠、碳酸氢钠的用途
a
a
6.过氧化钠的主要性质
c
一、钠的物理性质
钠是一种质软、银白色、有金属光泽的金属,具有良好的导电性、导热性,密度比水小,比煤油大,熔点较低。
二、从钠原子的原子结构认识钠的化学性质——还原性
最外层一个电子,极易失去,具有强还原性。
1.与非金属单质(如O2、Cl2)的反应
2Na+Cl22NaCl(剧烈燃烧,产生大量白烟)
4Na+O2===2Na2O(银白色金属光泽褪去)
2Na+O2Na2O2(剧烈反应,生成淡黄色固体)
2.与水反应
(1)离子方程式:2Na+2H2O===2Na++2OH-+H2↑。(与水反应的实质是金属钠与水电离产生的氢离子反应)
(2)与滴加酚酞的水反应的现象及解释
3.与盐酸反应
离子方程式:2Na+2H+===2Na++H2↑。
4.与盐溶液反应
(1)钠投入到NaCl溶液中,只有H2产生,离子反应式为2Na+2H2O===2Na++2OH-+H2↑;
(2)钠投入到饱和NaCl溶液中,有H2产生,同时有NaCl晶体析出(温度不变);
(3)钠投入到NH4Cl溶液中,有H2和NH3逸出;
(4)钠投入到CuSO4溶液中,有H2产生和蓝色沉淀生成:2Na+2H2O+CuSO4===Cu(OH)2↓+Na2SO4+H2↑。
三、钠的制取及保存
1.制取:化学方程式为2NaCl(熔融)2Na+Cl2↑。
2.保存:由于金属钠的化学性质非常活泼,易与空气中的O2和H2O等反应,所以金属钠要密封保存,通常保存在煤油或石蜡油中。
四、钠的用途
1.制取Na2O2等化合物。
2.钠、钾合金(液态)可用于原子反应堆的导热剂。
3.用作电光源,制作高压钠灯。
4.冶炼某些金属
金属钠具有强还原性,熔融状态下可以用于制取金属,如4Na+TiCl4(熔融)4NaCl+Ti。
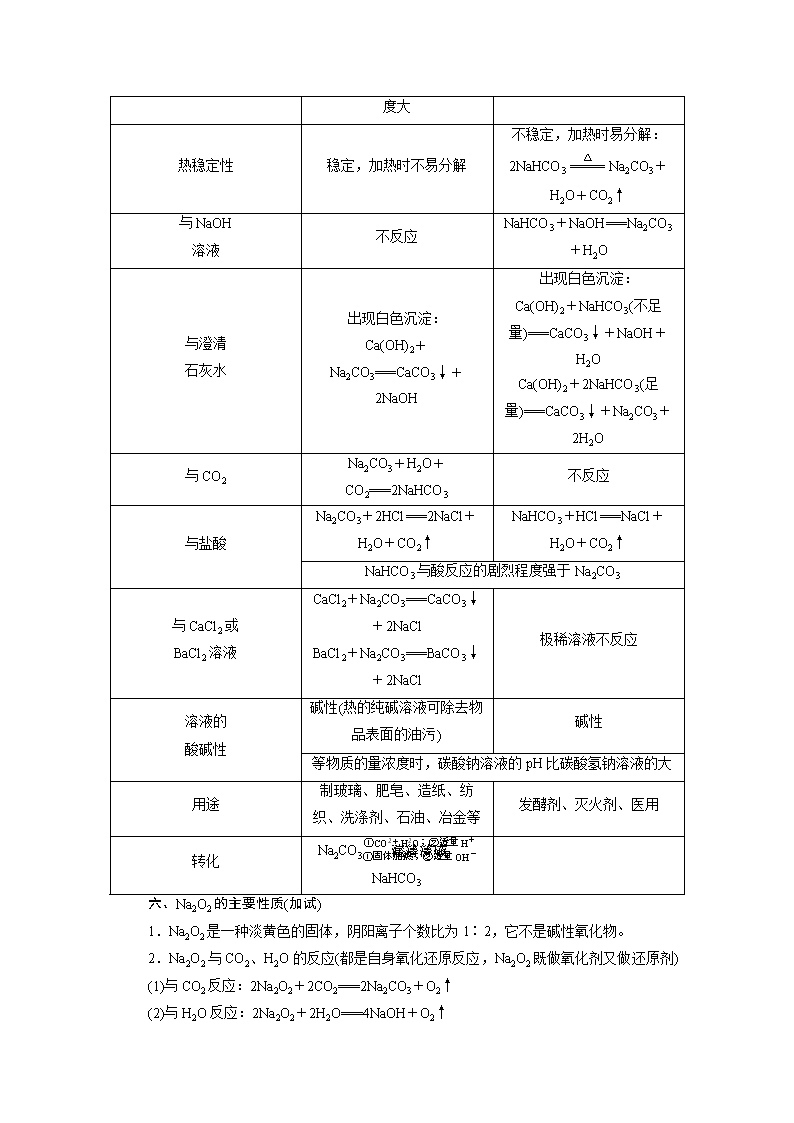
五、碳酸钠和碳酸氢钠
Na2CO3
NaHCO3
化学名称
碳酸钠
碳酸氢钠
俗名
纯碱或苏打
小苏打
状态
粉末
细小晶体
颜色
白色
白色
溶解度
易溶于水,比NaHCO3
易溶于水
溶解度大
热稳定性
稳定,加热时不易分解
不稳定,加热时易分解:
2NaHCO3Na2CO3+H2O+CO2↑
与NaOH
溶液
不反应
NaHCO3+NaOH===Na2CO3+H2O
与澄清
石灰水
出现白色沉淀:
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
出现白色沉淀:
Ca(OH)2+NaHCO3(不足量)===CaCO3↓+NaOH+H2O
Ca(OH)2+2NaHCO3(足量)===CaCO3↓+Na2CO3+2H2O
与CO2
Na2CO3+H2O+CO2===2NaHCO3
不反应
与盐酸
Na2CO3+2HCl===2NaCl+H2O+CO2↑
NaHCO3+HCl===NaCl+H2O+CO2↑
NaHCO3与酸反应的剧烈程度强于Na2CO3
与CaCl2或
BaCl2溶液
CaCl2+Na2CO3===CaCO3↓+2NaCl
BaCl2+Na2CO3===BaCO3↓+2NaCl
极稀溶液不反应
溶液的
酸碱性
碱性(热的纯碱溶液可除去物品表面的油污)
碱性
等物质的量浓度时,碳酸钠溶液的pH比碳酸氢钠溶液的大
用途
制玻璃、肥皂、造纸、纺织、洗涤剂、石油、冶金等
发酵剂、灭火剂、医用
转化
Na2CO3NaHCO3
六、Na2O2的主要性质(加试)
1.Na2O2是一种淡黄色的固体,阴阳离子个数比为1∶2,它不是碱性氧化物。
2.Na2O2与CO2、H2O的反应(都是自身氧化还原反应,Na2O2既做氧化剂又做还原剂)
(1)与CO2反应:2Na2O2+2CO2===2Na2CO3+O2↑
(2)与H2O反应:2Na2O2+2H2O===4NaOH+O2↑
3.Na2O2强氧化性的五个表现
4.Na2O2的主要用途:漂白剂、清洁剂、供氧剂。
【例1】 下列有关钠及其化合物的说法不正确的是( )
A.电解饱和食盐水可制取金属钠 B.钠与氧气反应的产物与反应条件有关
C.氧化钠与水反应生成氢氧化钠 D.钠可以从四氯化钛中置换出钛
【解析】 电解饱和食盐水得NaOH、H2、Cl2,A项错误;钠与氧气常温下反应生成Na2O,加热条件下反应生成Na2O2,B项正确;氧化钠是碱性氧化物,与水反应生成氢氧化钠,C项正确;钠具有强还原性,可从四氯化钛中置换出钛,D项正确。
【答案】 A
【提炼】 电解熔融氯化钠和电解氯化钠溶液,两者产物不同,前者用于制取金属钠,后者用于制取氢氧化钠、氯气和氢气。
【例2】 下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
选项
陈述Ⅰ
陈述Ⅱ
判断
A
碳酸钠、碳酸氢钠能用澄清石灰水鉴别
Na2CO3能与澄清石灰水反应生成白色沉淀,而NaHCO3不能
Ⅰ对,Ⅱ对,有
B
向Na2O2的水溶液中滴入酚酞变红色
Na2O2与水反应生成氢氧化钠
Ⅰ对,Ⅱ错,无
C
金属钠具有强还原性
高压钠灯发出透雾性强的黄光
Ⅰ对,Ⅱ对,有
D
酚酞溶液在碳酸钠溶液中的颜色比在等浓度碳酸氢钠溶液中深
CO的水解程度大于HCO
Ⅰ对,Ⅱ对,有
【解析】 碳酸氢钠也能与澄清石灰水反应变浑浊,故不能鉴别,A错误;Na2O2和水反应生成氢氧化钠和氧气,氢氧化钠溶液呈碱性,酚酞遇碱变红色,Na2O2具有漂白性,红色溶液最终褪色,故B
错误;金属钠具有强还原性,高压钠灯发出透雾性强的黄光,陈述正确,但不存在因果关系,故C错误;CO的水解程度大于HCO,故碳酸钠碱性更强,酚酞滴入后颜色更深。
【答案】 D
【提炼】 1.Na2CO3、NaHCO3的鉴别
2.Na2O2投入品红溶液中,因其有强氧化性,可使品红溶液褪色。Na2O2投入无色酚酞溶液中,酚酞溶液先变红后褪色。
【例3】 取a g某物质在氧气中燃烧,产物与过量的过氧化钠固体完全反应,测得反应后固体增重a g,则该物质不可能是( )
A.H2 B.CO C.CH3COOH D.C2H5OH
【解析】 2H2O+2Na2O2===4NaOH+O2↑,Δm=2H2,2CO2+2Na2O2===2Na2CO3+O2,Δm=2CO,由上述化学方程式可得规律,CO、H2或两者混合气以及符合(CO)n(H2)m的物质,完全燃烧后产物通过足量Na2O2,增重的质量等于原物质的质量。A、B、C项均符合上式规律,D项不符合。
【答案】 D
【提炼】 对于有机物CxHyOz,若能写成(CO)m(H2)n的形式,则燃烧产物通过过量Na2O2后,增重的量等于原有机物的质量。
【例4】 为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下:
请回答:
(1)仪器a的名称是________。
(2)装置B中冰水的作用是________________________________________________________________________。
(3)该同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能使碳酸钠的质量分数偏高的是________。
A.样品分解不完全
B.装置B、C之间缺少CO2的干燥装置
C.产生CO2气体的速率太快,没有被碱石灰完全吸收
D.反应完全后停止加热,通入过量的空气
【解析】 按照图示连接好装置后,利用气体X(氮气)赶净装置中的空气,避免空气中二氧化碳影响测定结果,固体受热分解生成的二氧化碳和水蒸气进入装置B,利用冰水混合物冷却生成的水蒸气,装置C中的碱石灰吸收生成的二氧化碳,最后干燥管中为碱石灰,是防止空气中的二氧化碳、水蒸气进入装置C影响测定结果。
(1)依据仪器形状和用途分析,仪器a名称为干燥管;
(2)装置B利用冰水混合物冷却生成的水蒸气,防止水蒸气进入装置C导致测定结果不准确;
(3)A.样品分解不完全,测定二氧化碳质量减小,碳酸氢钠质量减小,则碳酸钠质量增大,导致碳酸钠的质量分数偏高,故A正确;
B.装置B、C之间缺少CO2的干燥装置,水蒸气进入装置C导致测定二氧化碳质量增大,碳酸氢钠质量增大,碳酸钠质量减小,导致碳酸钠的质量分数偏低,故B错误;
C.产生CO2气体的速率太快,没有被碱石灰完全吸收,测定二氧化碳质量减小,碳酸氢钠质量减小,碳酸钠质量增大,导致碳酸钠的质量分数偏高,故C正确;
D.反应完全后停止加热,通入过量的空气,会导致空气中二氧化碳也被装置C吸收,测定碳酸氢钠质量增大,碳酸钠质量减小,导致碳酸钠的质量分数偏低,故D错误。
【答案】 (1)干燥管 (2)冷凝反应生成的水蒸气 (3)AC
【提炼】 测定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数的实验方案有以下几种:
(1)取a g混合物充分加热,减重b g;
(2)取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体;
(3)取a g混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b g固体;
(4)取a g混合物充分加热,测定生成水或二氧化碳的质量为b g。
【例5】 为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸30.0 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:
实验序号
Ⅰ
Ⅱ
Ⅲ
Ⅳ
盐酸体积(mL)
30.0
30.0
30.0
30.0
样品质量(g)
2.96
3.70
5.18
6.66
CO2体积(mL)
672
840
896
672
(1)样品中物质的量之比n(Na2CO3)∶n(NaHCO3)=________。
(2)盐酸的物质的量浓度c(HCl)=__________________。
【解析】 Ⅰ→Ⅱ→Ⅲ,随着样品质量的增加,CO2体积逐渐增大,说明Ⅰ、Ⅱ组盐酸过量,利用Ⅰ组数据计算。Ⅰ中样品完全反应,根据碳元素守恒知:n(Na2CO3)+n(NaHCO3)=n(CO2)=0.03 mol,又m(Na2CO3)+m(NaHCO3)=2.96 g,计算知n(Na2CO3)=0.02 mol,n(NaHCO3)=0.01 mol,样品中n(Na2CO3)∶n(NaHCO3)=2∶1。Ⅳ组固体质量增加,CO2体积减小,盐酸不足量。根据样品中物质的量之比n(Na2CO3)∶n(NaHCO3)=2∶1,计算6.66 g样品中n(Na2CO3)=0.045 mol,n(NaHCO3)=0.022 5 mol。因盐酸逐滴加入,故先发生反应Na2CO3+HCl===NaCl+NaHCO3,再发生反应NaHCO3+HCl===NaCl+CO2↑+H2O,故n(HCl)=n(Na2CO3)+n(CO2)=0.045 mol+0.03 mol=0.075 mol,c(HCl)=2.50 mol·L-1。
【答案】 (1)2∶1或2 (2)2.50 mol·L-1
【提炼】 将CO2通入NaOH溶液中,充分反应后再向溶液中滴加盐酸,设产生的气体体积与加入盐酸的体积的关系如图所示,则依据a与b的关系可以判断溶液的组成并计算各组分的物质的量。
(1)若a=0,溶质只有NaHCO3;
(2)若a=b-a即a=b,溶质只有Na2CO3;
(3)若a>b-a即2a>b,溶质为NaOH和Na2CO3(NaOH只消耗HCl,不产生气体);
(4)若a<b-a即2a<b,溶质为Na2CO3和NaHCO3。
相关文档
- 2020届高考化学一轮复习化学与自然2021-05-24 16:46:2223页
- 2021届高考化学一轮复习化学计算中2021-05-24 11:40:376页
- 2021届高考化学一轮复习化学反应速2021-05-23 01:48:0310页
- 2020届高考化学一轮复习化学工艺流2021-05-23 00:52:216页
- 2020届高考化学一轮复习化学与技术2021-05-22 22:46:3223页
- 2021届高考化学一轮复习化学实验的2021-05-22 21:15:3012页
- 2021届高考化学一轮复习化学平衡常2021-05-22 19:51:118页
- 2020届高考化学一轮复习化学平衡常2021-05-22 18:03:4226页
- 2021届(鲁科版)高考化学一轮复习化学2021-05-22 16:58:0010页
- 2020版高考一轮复习化学通用版学案2021-05-22 14:17:2211页