- 1.20 MB
- 2021-04-25 发布
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
“皖南八校”2O20届高三第一次联考
化学
2019.10
考生注意:
1.本试卷分第I卷(选择题)和第II卷(非选择题)两部分。满分100分,考试时间100分钟。
2.考生作答时,请将答案答在答题卡上,第I卷每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;第II卷请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
3.本卷命题范围:必修1,必修2。
可能用到的相对原子质量:H1 C12 O16 Co59 Cu64
第I卷(选择题共48分)
一、选择题(本大题共16小题,每小题3分,共计48分。在每小题列出的四个选项中,只有一项是最符合题目要求的)
1.化学与生活、生产密切相关。下列说法错误的是
A.废弃的秸秆可用于生产生物质燃料乙醇
B.硫酸钡可用于胃肠X射线造影检查
C.高纯单质硅可用于制作光导纤维
D.钙、锶、钡、铜和碱金属等金属化合物可用于制作烟花
2.下列有关物质分类的说法正确的是
A.二氧化硫的水溶液可以导电,所以二氧化硫是电解质
B.胶体、溶液、浊液的本质区别是分散质粒子的大小不同
C.硫酸、烧碱、纯碱在水溶液中均能发生电离,所以它们均为离子化合物
D.二氧化硅既能与强碱反应,又能与氢氟酸反应,所以二氧化硅是一种两性氧化物
3.下列图示实验正确的是
·10·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
4.下列指定反应的离子方程式正确的是
A.用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-
B.向碳酸氢铵溶液中加入过量的NaOH溶液:NH4++OH-=NH3·H2O
C.向明矾溶液中加入Ba(OH) 2溶液至生成沉淀的物质的量最多:
Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
D.等体积、等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:
HCO3-+Ba2++OH-=BaCO3↓+H2O
5.亚砷酸(H3AsO3)与氯化亚锡(SnCl2)在浓盐酸中发生反应的离子方程式为:
3Sn2++2H3AsO3+6H++18Cl-=2As+3SnCl62-+6M
下列关于该反应的说法错误的是
A.M为H2O
B.还原性:Sn2+>As
C.SnCl62-是氧化反应的产物
D.每生成1.5 mol SnCl62-,H3AsO3失去电子的物质的量为3 mol
6.已知NA是阿伏加德罗常数的值,下列说法正确的是
A.18g18O含有的中子数为8NA
B.0.1 mol H2C2O4被氧化为CO2转移的电子数为0.1NA
C.32g乙醇和14g二甲醚(H3C-O-CH3)的混合物中共价键数目为8NA
D.常温下,6.4g铜片投入到足量的浓硫酸中,生成的SO2分子数为0.1NA
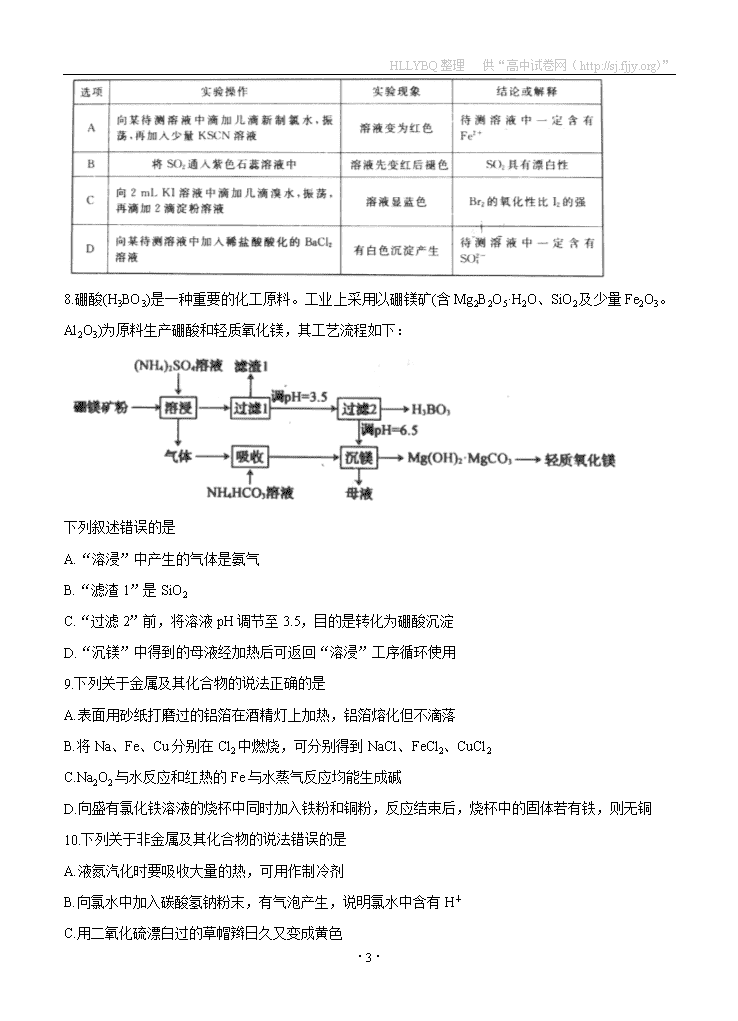
7.下列实验现象、结论或解释与实验操作相匹配的是
·10·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
8.硼酸(H3BO3)是一种重要的化工原料。工业上采用以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3。Al2O3)为原料生产硼酸和轻质氧化镁,其工艺流程如下:
下列叙述错误的是
A.“溶浸”中产生的气体是氨气
B.“滤渣1”是SiO2
C.“过滤2”前,将溶液pH调节至3.5,目的是转化为硼酸沉淀
D.“沉镁”中得到的母液经加热后可返回“溶浸”工序循环使用
9.下列关于金属及其化合物的说法正确的是
A.表面用砂纸打磨过的铝箔在酒精灯上加热,铝箔熔化但不滴落
B.将Na、Fe、Cu分别在Cl2中燃烧,可分别得到NaCl、FeCl2、CuCl2
C.Na2O2与水反应和红热的Fe与水蒸气反应均能生成碱
D.向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯中的固体若有铁,则无铜
10.下列关于非金属及其化合物的说法错误的是
A.液氮汽化时要吸收大量的热,可用作制冷剂
B.向氯水中加入碳酸氢钠粉末,有气泡产生,说明氯水中含有H+
C.用二氧化硫漂白过的草帽辫日久又变成黄色
·10·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
D.铜分别与足量的浓硝酸和稀硝酸充分反应,消耗的还原剂与氧化剂的物质的量之比相同
11.氢氧燃料电池可以使用在航天飞机上,其反应原理如图所示。下列说法正确的是
A.电池工作时,电能转化为化学能
B.负极的电极反应为O2+2H2O+4e-=4OH-
C.电子由电极b通过导线流向电极a
D.2 mol 氢气和1 mol氧气的总能量高于2 mol 水的总能量
12一定温度下,把6 mol A和5 mol B通入容积为4L的恒容密闭容器中发生反应3A(g)+B(g)2C(g)+2D(g),反应经过5min达到平衡,此时生成2 mol C,正反应速率(v正)和逆反应速率(v逆)随时间(t)的变化如图所示。下列说法正确的是
A.t2=5min,平衡时3v正(A)=2v逆(D)
B.0~t2,A的平均反应速率为0.15 mol·L-1·min-1
C.t2~t3,各物质的浓度一定相等
D.B的平衡转化率为25%
13.下列关于化合物2-环己基丙烯()的说法错误的是
A.能使酸性高锰酸钾溶液褪色
B.可以发生加成反应、加聚反应
C.分子式为C9H16,分子中所有原子共平面
D.难溶于水,但不可用于萃取溴水中的溴
14.2-甲基丁烷()的二氯代产物有(不考虑立体异构)
·10·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
A.3种 B.9种 C.10种 D.6种
15.海水化学资源的利用具有非常广阔的前景。以海水为原料制备MgCl2和NaOH的工艺流程如下:
下列说法错误的是
A.“沉淀”时常用石灰乳作为沉淀剂
B.“酸溶”时加入过量盐酸,有利于得到MgCl2·6H2O晶体
C.“电解”时,NaOH在阴极区得到
D.过程①加入试剂的顺序依次为Na2CO3溶液、NaOH溶液、BaCl2溶液、稀盐酸
16.某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,Q核外最外层电子数与Y核外电子总数相同,X的原子半径是元素周期表中最小的。下列叙述正确的是
A.WX的水溶液呈中性
B.元素非金属性的顺序为Y>Z>Q
C.Z的最高价氧化物对应的水化物是一元强酸
D.该化合物中与Y单键相连的Q不满足8电子稳定结构
第Ⅱ卷(非选择题 共52分)
二、非选择题(本大题共5小题,共52分)
17.(10分)过氧乙酸(),是一种高效消毒剂,它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下
·10·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
①在三颈烧瓶中加入一定量冰醋酸与浓硫酸的混合物,再缓缓加入适量30%的双氧水;
②不断搅拌并控制装置B中混合液的温度为20~30℃至反应结束;
③接入仪器C和抽气泵,在锥形瓶中收集得到产品。
回答下列问题:
(1)仪器C的名称是 ,仪器C中冷水流入口是 (填“a”或“b”)。
(2)为更好地控制反应温度,应采用的加热方法是 。
(3)生成过氧乙酸的化学方程式为 。
(4)实验测得产物过氧乙酸的百分含量随反应物比例和反应时间的变化数据如下表。由表中数据可知,反应物最佳比例(CH3COOH/H2O2)是 ,最佳反应时间约 。
(5)产品中过氧乙酸浓度的测定:取2.00mL过氧乙酸产品试样,加水稀释成100mL;从中取出5.00mL,逐滴滴加酸性KMnO4溶液至溶液恰好呈粉红色,以除去残余的H2O2;再加入稍过量的KI溶液,发生反应CH3COOH+2I-+2H+=I2+CH3COOH+H2O;反应完全后,滴入几滴淀粉溶液,用0.1000mol·L-1的Na2S2O3标准液滴定至终点(反应式为2S2O32-+I2=S4O62-+2I-),消耗14.30mLNa2S2O3标准液。
则产品中过氧乙酸的物质的量浓度是 mol·L-1 (保留2位小数)。
18.(10分)某混合溶液中,可能大量含有的离子如下表:
将Na2O2逐渐加入上述混合解液中并微热,产生沉淀和气体的物质的量与加入Na2O2
·10·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
的物质的量的关系分别如下图所示。
回答下列问题:
(1)将上述混合溶液中一定大量含有的阴、阳离子及其物质的量填入下表(可以不填满,也可以增加):
(2)图中a= ,6= ,c=
(3)简述溶液中还可能大量含有的离子的鉴定方法:
19.(10分)单质X、Y与化合物甲、乙有如图所示的转化关系(必要的反应条件未标出),回答下列问题:
(1)若该反应用于工业上制取粗硅,反应的化学方程式为
(2)若X、Y为日常生活中常见的两种金属,且甲为红棕色粉末,相应的化学方程式为 。
(3)若X、乙的焰色反应均呈黄色,甲是一种常见的无色无味的液体,则乙物质中所含的化学键类型有
(4)若X是黄绿色气体,甲、乙两种气体相遇会产生白烟,则X与甲反应的化学方程式为 。
(5)若X中的元素是海水中含量最多的金属元素,甲是相对分子质量为46且常温下能使酸性KMnO4溶液褪色的烃的含氧衍生物,则X与甲反应的化学方程式为 。
20.(10分)已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大。X、Z、Q的单质在常温下均呈气态;Y的原子最外层电子数是其电子层数的2倍;M与X同族;Z、G分别是地壳中含量最高的非金属元素和金属元素。
回答下列问题:
·10·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
(1)Y、Z、M、G四种元素的原子半径由大到小的顺序是 (用元素符号表示)。
(2)Z在元素周期表中的位置为 ,M2Z的电子式为 。
(3)上述元素的最高价氧化物对应的水化物中,酸性最强的水化物是 (写化学式)。
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且它的产量可以用来衡量一
个国家的石油化工发展水平的是 (写名称)。
(5)GQ3溶液与过量的MZX溶液反应的化学方程式为
(6)常温下,不能与G的单质发生反应的是 (填标号)。
a.CuSO4溶液 b.浓硫酸 c.NaOH溶液 d.浓硝酸 e.氧化铜
21.(12分)工业上常用水钴矿(主要成分为Co2O3,还含少量Fe2O3、Al2O3、MgO、CaO等杂质)制备钴的氧化物,其制备工艺流程如下(已知Na2SO3能还原Fe3+和Co3+):
回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有 (任写2种)。
(2)“酸浸”后加入Na2SO3钴的存在形式为Co2+,产生Co2+反应的离子方程式为
(3)溶液a中加入NaClO的作用是
(4)沉淀a的成分是 (写化学式),操作2的名称是
(5)溶液d中的金属离子只有Co2+和Na+两种,则溶液c中加入NaF溶液的作用是
(6)在空气中缎烧CoC2O4生成钴的某种氧化物和CO2,测得充分煅烧后固体质量为12.05g,CO2的体积为6.72L(标准状况),则此反应的化学方程式为
·10·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
·10·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
欢迎访问“高中试卷网”——http://sj.fjjy.org
·10·
相关文档
- 2019湖南省衡阳市中考数学试卷 解2021-04-25 16:49:3926页
- 深圳中考物理试卷与解析2021-04-25 16:49:3911页
- 中医内科学练习试卷15-22021-04-25 16:49:0726页
- 初二英语上册期中试卷2021-04-25 16:48:397页
- 三年中考数学试卷分析2021-04-25 16:48:3330页
- 2020年黑龙江省七台河市中考数学试2021-04-25 16:48:2630页
- 河南省安阳市洹北中学2018-2019学2021-04-25 16:48:1310页
- 2020年中卫市中宁县中考物理一模试2021-04-25 16:48:0717页
- 【物理】辽宁省阜新市第二高级中学2021-04-25 16:47:459页
- 【执业药师考试】中药鉴定学练习试2021-04-25 16:46:5822页