- 126.50 KB
- 2021-06-23 发布
甘肃省靖远县第四中学2019-2020学年高一下学期期中考试(实验班)试题
可能用到的相对原子质量:Cu 64 Zn 65
第I卷(选择题)
一、单选题(共16小题,每小题3分)
1.下列说法正确的是( )
A.HCl的电子式为H:Cl
B.Na2O2只含有离子键
C.质量数为12的C原子符号为12C
D.用电子式表示KBr的形成过程:
2.下列叙述错误的是( )
A.13C和14C属于同种元素,它们互为同位素
B.1H和2H是不同的核素,它们的质子数相等
C.14C和14N的质量数相等,它们的中子数不等
D.6Li和7Li的电子数相等,中子数也相等
3.2016年命名117元素Ts为钿(tián),根据元素周期律推测,下列说法错误的是( )
A.Ts 为金属元素 B.Ts 位于周期表的第七周期第VIIA 族
C.Ts 的主要化合价-1、+7 D.酸性: HClO4> HTsO4
4.元素性质呈周期性变化根本原因是( )
A.元素的相对原子质量逐渐增大 B.核外电子排布呈周期性变化
C.核电荷数逐渐增大 D.元素化合价呈周期性变化
5.下列各组中每种物质都既有离子键又有共价键的一组是( )
A.NaOH H2SO4 (NH4)2SO4 B.MgO Na2SO4 HNO3
C.Na2O2 KOH Na3PO4 D.HCl Al2O3 MgCl2
6.短周期元素X、Y、Z、W 的原子序数依次增大,X 原子最外层有6 个电子,Y 是至今发现非金属性最强的元素,Z 的周期序数等于族序数,W 与Z 相邻。下列说法不正确的是( )
A.可以电解Z的氯化物获得Z单质
B.Y 的氢化物可刻蚀玻璃
C.Z 的氧化物可用作耐火材料
D.W 的氧化物可用作光导纤维
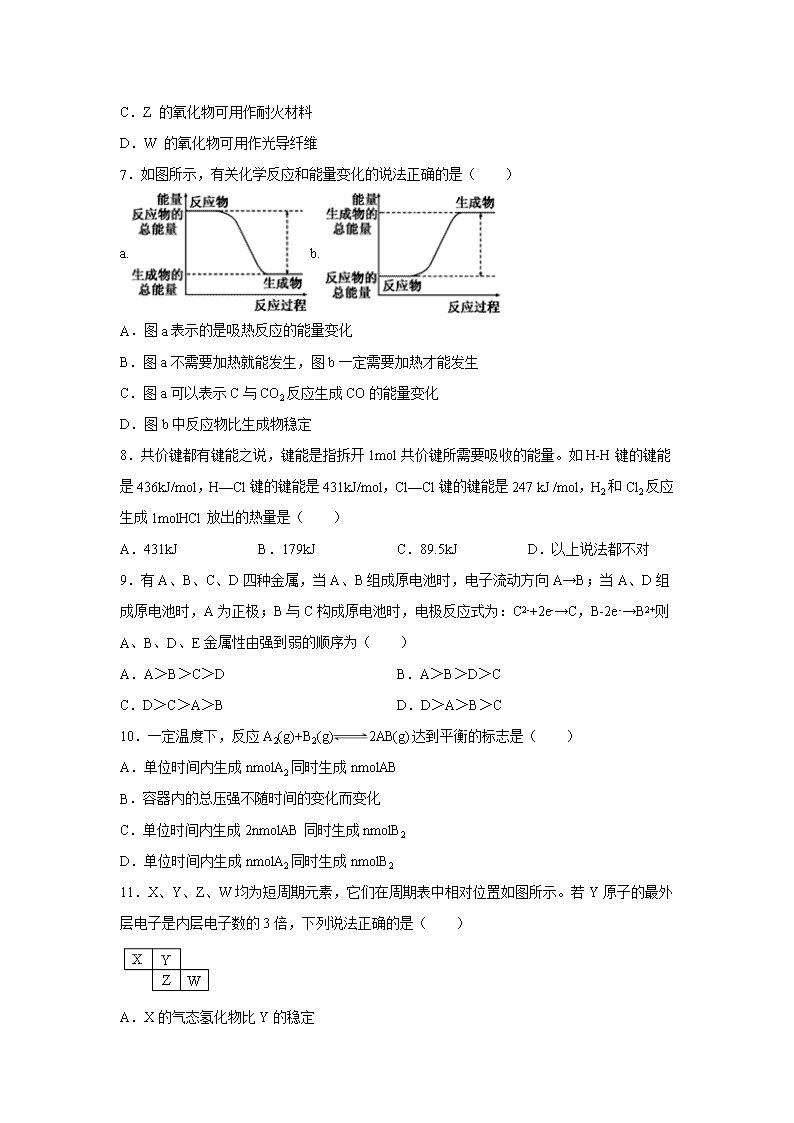
7.如图所示,有关化学反应和能量变化的说法正确的是( )
a.b.
A.图a表示的是吸热反应的能量变化
B.图a不需要加热就能发生,图b一定需要加热才能发生
C.图a可以表示C与CO2反应生成CO的能量变化
D.图b中反应物比生成物稳定
8.共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量。如H-H键的键能是436kJ/mol,H—Cl键的键能是431kJ/mol,Cl—Cl键的键能是247 kJ /mol,H2和Cl2反应生成1molHCl放出的热量是( )
A.431kJ B.179kJ C.89.5kJ D.以上说法都不对
9.有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A→B;当A、D组成原电池时,A为正极;B与C构成原电池时,电极反应式为:C2-+2e-→C,B-2e-→B2+则A、B、D、E金属性由强到弱的顺序为( )
A.A>B>C>D B.A>B>D>C
C.D>C>A>B D.D>A>B>C
10.一定温度下,反应A2(g)+B2(g)2AB(g)达到平衡的标志是( )
A.单位时间内生成nmolA2同时生成nmolAB
B.容器内的总压强不随时间的变化而变化
C.单位时间内生成2nmolAB同时生成nmolB2
D.单位时间内生成nmolA2同时生成nmolB2
11.X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
A.X的气态氢化物比Y的稳定
B.W的最高价氧化物对应水化物的酸性比Z的强
C.Z的非金属性比Y的强
D.X与Y形成的化合物都易溶于水
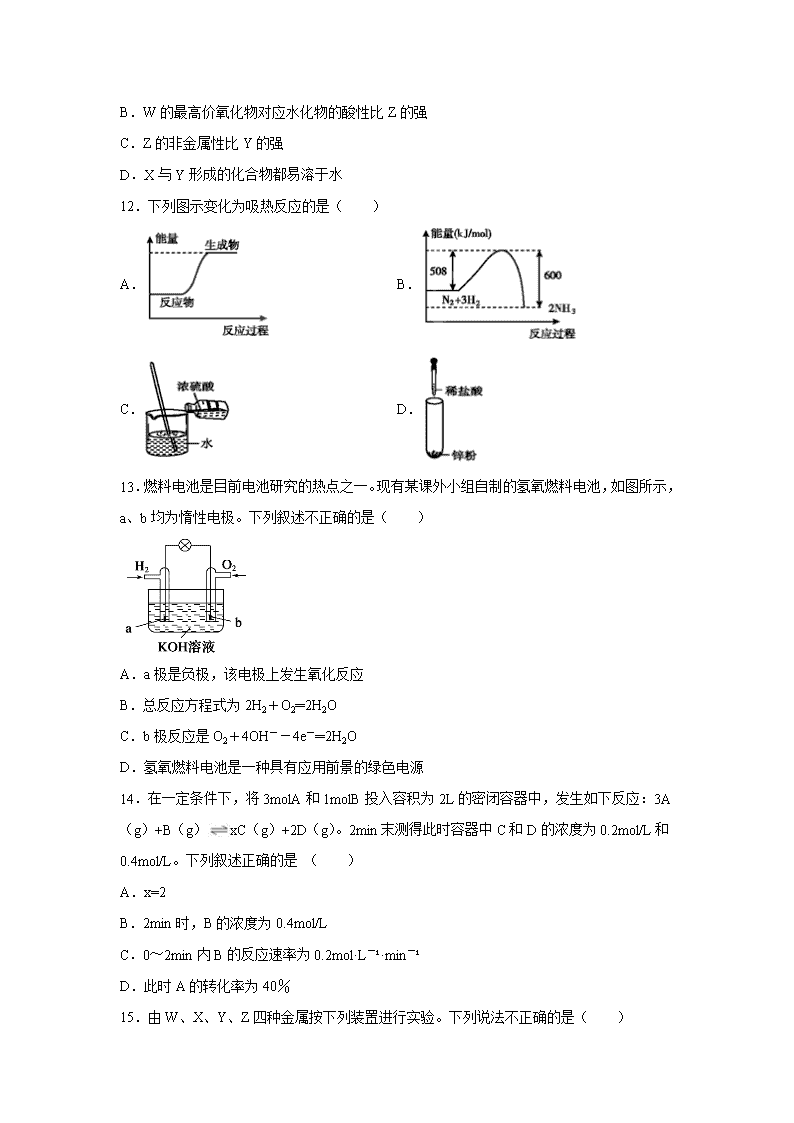
12.下列图示变化为吸热反应的是( )
A. B.
C. D.
13.燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述不正确的是( )
A.a极是负极,该电极上发生氧化反应
B.总反应方程式为2H2+O2═2H2O
C.b极反应是O2+4OH--4e-═2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
14.在一定条件下,将3molA和1molB投入容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g)。2min末测得此时容器中C和D的浓度为0.2mol/L和0.4mol/L。下列叙述正确的是 ( )
A.x=2
B.2min时,B的浓度为0.4mol/L
C.0~2min内B的反应速率为0.2mol·L-¹·min-¹
D.此时A的转化率为40%
15.由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是( )
A.装置甲中W作原电池负极
B.装置乙中Y电极上的反应式为Cu2++2e−=Cu
C.装置丙中溶液的c(H+)不变
D.四种金属的活动性强弱顺序为Z>W>X>Y
16.在密闭容器中X2 (g)+2Y2 (g)Z(g)的反应,X2、Y2、Z的起始浓度依次为0.2mol/L、0.3mol/L、0.3mol/L,当反应达到其最大限度(即化学平衡状态)时,各物质的浓度有可能的是( )
A.c(Z) ═0.45mol/L B.c(X2) ═0.3mol/L
C.c(X2) ═0.5mol/L D.c(Y2) ═0.5mol/L
第II卷(非选择题)
二、填空题(共52分)
17.(10分)下列五种物质中,①H2O ②CO2 ③Na2O2 ④NaOH ⑤NaBr,只存在共价键的是__________,只存在离子键的是__________,既存在离子键又存在共价键的是_________,含有极性键的是__________,是非极性分子的是________。(填编号)
18.(14分)已知有A、B、C、D、E五种短周期的主族元素,它们的原子序数依次递增,A是所有元素中原子半径最小的元素,B、C组成的某一种化合物能引起温室效应.常温下,金属D单质投入水中能与水剧烈反应.常温下E单质是常见的气体.请按要求回答下列几个问题:
(1)B、D的元素名称分别为:_____、_____;
(2)E在周期表中的位置为: ,
(3)C离子的结构示意图为: ;
(4)B、C、D三种元素的原子半径从大到小的顺序为 (用元素符号表示);
(5)B、E的最高价氧化物对应水化物的酸性从强到弱的顺序为: (用对应的化学式表示)
(6)写出C、D两种元素组成的阴、阳离子个数比为1:2且只含离子键的化合物的电子式: ;
(7)写出E与水反应的离子方程式: 。
19.(8分)航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,甲烷燃料电池以KOH溶液为电解质,其总反应的化学方程式为:CH4+2O2+2OH-===CO32—+3H2O。
(1)负极上的电极反应为 。
(2)正极上的电极反应为 。
(3)消耗标准状况下的5.6 L O2时,有________ mol电子发生转移。
(4)开始放电时,正极附近溶液的pH________(填“增大”、“减小”或“不变”)。
20.(6分)在由Cu片、Zn片和200 mL稀H2SO4组成的原电池中,当Cu片上放出2.24 L(标准状况下)H2时,H2SO4恰好用完。问:
(1)此时在导线上有________摩尔电子通过。
(2)Zn片溶解的质量是________。
(3)原稀H2SO4的物质的量浓度是________。
21.(8分)把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为______。
(2)2min末时Y的浓度为_____。
(3)化学反应方程式中n=____。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的____倍。
22.(6分)拆开1mol共价键所需吸收的能量如下表:
共价键
H-H
N≡N
N-H
吸收的能量/kJ
436
946
391
(1)1mol N2完全反应为NH3_____(填:吸收或放出)_____kJ能量
(2) 事实上,将1molN2和3molH2放在反应容器中,使它们充分反应,反应的热量变化总小于计算值,原因是_______________________ 。
【参考答案】
一、单选题:(每空3分,共48分)
题号
1
2
3
4
5
6
7
8
答案
D
D
C
B
C
A
D
C
题号
9
10
11
12
13
14
15
16
答案
D
C
B
A
C
D
C
D
二、填空题:(共52分)
17.(每空2分,共10分)
①② ⑤ ③④ ①②④ ②
18.(共14分)
(1)碳 钠 (各1分) (2)第三周期第ⅤⅡA族(2分)
(3) (2分) (4)Na>C>O (2分) (5) HClO4>H2CO3 (2分)
(6) (2分) (7) Cl2+H2OH++Cl﹣+HClO(2分)
19.(每空2分,共8分)
(1)CH4+10OH--8e-===CO32—+7H2O (2)2H2O+O2+4e−=4OH−
(3) 1 (4)增大
20.(每空2分,共6分)
(1)0.2 mol (2) 6.5 g (3) 0.5 mol/L
21.(每空2分,共8分)
(1) 0.075mol/(L·min) (2) 0.175mol/L (3) 4 (4)1.05
22.(每空2分,共6分)
(1)放出 92
(2)该反应是可逆反应,充分反应的最终结果是达到最大限度(既化学平衡状态),因此放出的热量总是小于理论计算值