- 94.00 KB
- 2021-05-28 发布
1
2019 年秋季学期高一年级期中考试
化学(人文)试题
考试时间:60 分钟 满分:100 分
注意:请将答案填涂在答题卡上,写在试卷上一律无效。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5
第 I 卷 选择题
一、选择题:本题共 20 小题,每小题 3 分,共 60 分。在每小题给出的四个选项中,只有一项是符
合题目要求的。
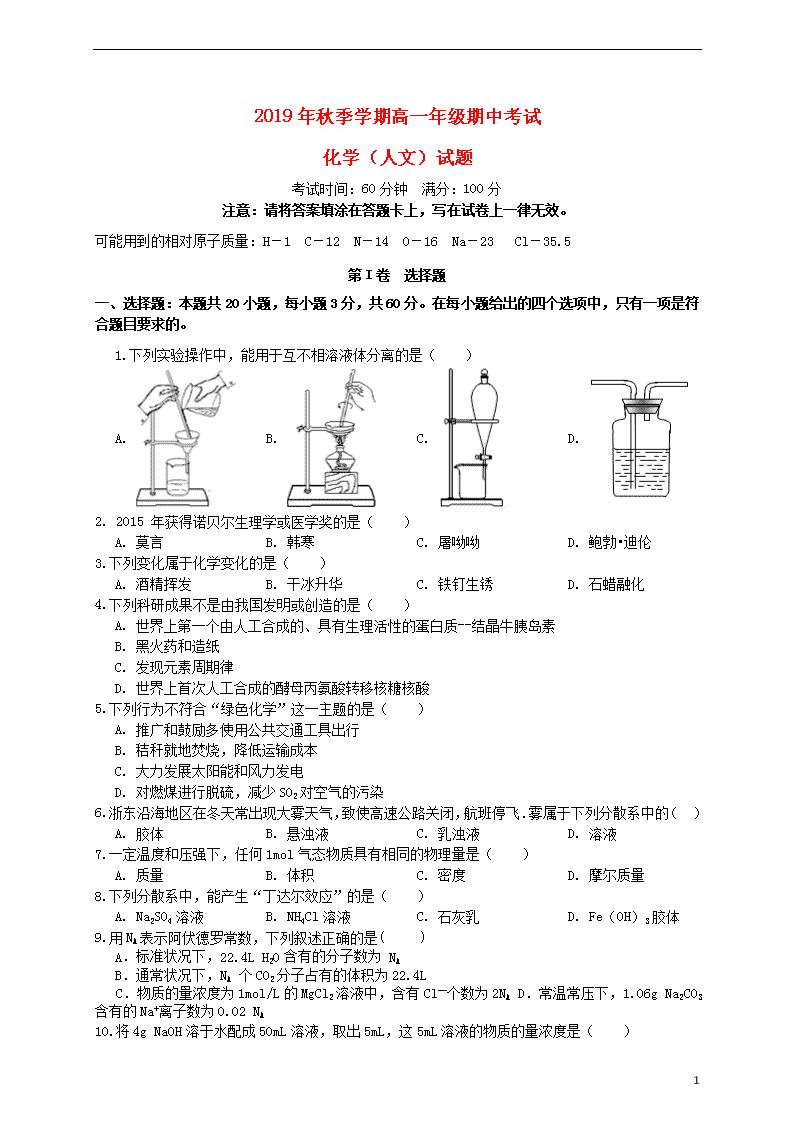
1.下列实验操作中,能用于互不相溶液体分离的是( )
A. B. C. D.
2. 2015 年获得诺贝尔生理学或医学奖的是( )
A. 莫言 B. 韩寒 C. 屠呦呦 D. 鲍勃•迪伦
3.下列变化属于化学变化的是( )
A. 酒精挥发 B. 干冰升华 C. 铁钉生锈 D. 石蜡融化
4.下列科研成果不是由我国发明或创造的是( )
A. 世界上第一个由人工合成的、具有生理活性的蛋白质--结晶牛胰岛素
B. 黑火药和造纸
C. 发现元素周期律
D. 世界上首次人工合成的酵母丙氨酸转移核糖核酸
5.下列行为不符合“绿色化学”这一主题的是( )
A. 推广和鼓励多使用公共交通工具出行
B. 秸秆就地焚烧,降低运输成本
C. 大力发展太阳能和风力发电
D. 对燃煤进行脱硫,减少 SO2 对空气的污染
6.浙东沿海地区在冬天常出现大雾天气,致使高速公路关闭,航班停飞.雾属于下列分散系中的
( )
A. 胶体 B. 悬浊液 C. 乳浊液 D. 溶液
7.一定温度和压强下,任何 1mol 气态物质具有相同的物理量是( )
A. 质量 B. 体积 C. 密度 D. 摩尔质量
8.下列分散系中,能产生“丁达尔效应”的是( )
A. Na2SO4 溶液 B. NH4Cl 溶液 C. 石灰乳 D. Fe(OH)3 胶体
9.用 NA 表示阿伏德罗常数,下列叙述正确的是( )
A.标准状况下,22.4L H2O 含有的分子数为 NA
B.通常状况下,NA 个 CO2 分子占有的体积为 22.4L
C.物质的量浓度为 1mol/L 的 MgCl2 溶液中,含有 Cl—个数为 2NA D.常温常压下,1.06g Na2CO3
含有的 Na+离子数为 0.02 NA
2
10.将 4g NaOH 溶于水配成 50mL 溶液,取出 5mL,这 5mL 溶液的物质的量浓度是( )
A. 2 mol/L B. 1 mol/L C. 0.1 mol/L D. 0.05 mol/L
11.下列叙述中正确的是( )
A. 1molCO 的质量是 28g
B. 硝酸的摩尔质量是 63g
C. 2g 氢气所含原子数目为 1mol
D. 铁的摩尔质量等于铁原子的相对原子质量
12.配制 100mL 1mol/L NaOH 溶液必须的仪器是( )
A. 量筒 B. 试管 C. 容量瓶 D. 分液漏斗
13.符合如图中阴影部分的物质是( )
A.NaHCO3
B.Cu2(OH)2CO3
C.NaCl
D.Na2CO3
14.在水溶液中能大量共存的离子组是( )
A. Ba2+、H+、HCO3
-、Cl- B. Cu2+、OH-、NH4
+、Cl-
C. Ag+、NO3
-、Cl-、H+ D. Na+、NO3
-、SO4
2-、H+
15.下列物质的分类不正确的是( )
A. 水、过氧化氢和干冰都属于氧化物 B. H2SO4、HNO3、H2CO3 都属于酸
C. 烧碱、纯碱、熟石灰都属于碱 D. NaHSO4、CuSO4 和 KMnO4 都属于盐
16.下列物质中,易溶于水的是( )
A. KNO3 B. CaCO3 C. AgCl D. CuO
17.下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是( )
A. 浓硫酸的体积增大 B. 铝的表面生成致密的薄膜
C. 澄清的石灰水变浑浊 D. 氢氧化钠的表面发生潮解
18.下列反应中,既属于氧化还原反应又属于置换反应的是( )。
第Ⅱ卷 非选择题(共 40 分)
二、非选择题:本题共 5 小题,共 40 分,考生根据要求作答。
A.CuO+H2 Cu+H2O
B.CO2+Ca(OH)2=CaCO3↓+H2O
C.Fe2O3+3CO 2Fe+3CO2
D.2Na+Cl2 2NaCl
19. 下列离子方程式中,正确的是( )。
A.稀盐酸滴在铁片上:2Fe + 6 H+ = 2Fe3++3H2↑
B.碳酸氢钠溶液与稀盐酸混合:H++HCO3
- = H2O+CO2↑
C.硫酸铜溶液与氢氧化钡溶液混合:Cu2++2OH- = Cu(OH)2↓
D.硝酸银溶液与氯化钠溶液混合: AgNO3+ Cl-=AgCl↓+ NO3
-
20.在下列反应中水既不作氧化剂又不作还原剂的是( )。
A. 2F2+2H2O=4HF+O2
B. 2Na+2H2O=2NaOH+H2↑
C. CaO+H2O=Ca(OH)2
D. 2H2O=2H2↑+O2↑
3
21.(10 分)选用正确的实验操作,将下列各组物质进行分离或提纯.
A.分液 B.过滤 C.萃取 D.蒸馏 E.蒸发结晶 F.高温分解
(1)分离 CCl4 和 H2O: ______ (填字母,下同).
(2)除去澄清石灰水中的 CaCO3: ______ .
(3)除去 CaO 固体中少量的 CaCO3 固体: ______ .
(4)从碘水中提取碘: ______ .
(5)分离乙醇(沸点为 78℃)和甲苯(沸点为 110.6℃)的液体混合物: ______ .
22. (6 分)某次实验需用 0.4mol•L-1 NaCl 溶液 500mL.配制方法如下:
(1)配制该溶液应选用 ______ mL 容量瓶;
(2)用托盘天平准确称量 ______ g 固体 NaCl;
(3)将称量好的 NaOH 固体放在烧杯中,倒入约 50mL 蒸馏水,用玻璃棒搅拌,使固体全部溶解,待
溶液冷却至室温后,将烧杯中的溶液注入容量瓶中;
(4)向容量瓶中加入蒸馏水,到液面离容量瓶颈刻度线下 1—2cm;时,改用 ______ 加蒸馏水至
液面最低点与刻度线相切.盖好瓶塞,摇匀。
(5)若在配制过程中出现下列情况,将使所配制的 NaCl 溶液的浓度偏高的是 ______ ,偏低的是
______ ,对实验结果没有影响的是 ______ (填各选项的序号).
A.用托盘天平称量一定质量固体 NaCl 后,转移到烧杯内过程中撒在桌上一点
B.配制溶液所用的容量瓶洗净后没有烘干
C.固体 NaCl 在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作
D.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
E.最后确定 NaCl 溶液体积(定容)时,俯视观察液面与容量瓶刻度线
F.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线.
23. (10 分)用电离方程式表示下列物质的电离
(1)H2SO4—
(2)Ba(OH)2—
(3)MgCl2 —
写出下列反应的离子方程式
(4)盐酸与氢氧化钠
(5)氯化钡与硫酸钠
24. (4 分)在 Fe+2HCl=FeCl2+H2↑反应中。
(1)_____________元素被氧化,________是氧化剂,氧化产物____________;
(2)此反应若转移了 12 mol 的电子,则生成氢气_____mol。
25. (10 分)有一包白色粉末,其中可能含有 Ba(NO3)2、CaCl2、K2CO3,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成;
②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生;
③取少量②的溶液滴入 AgNO3 溶液,有白色沉淀生成.
(1)根据上述实验现象,则原白色粉末中
肯定含有 ,可能含有 .
(2)写出一定发生的离子方程式:
;
。
宜昌市第一中学 2017 年秋季学期高一年级期中考试
化学试题
参考答案
4
每小题 3 分,共 60 分
1—5 CCCCB 6—10 ABDDA 11—15 ACDDC 16—20 ABABC
21.(10 分)
(1)A. (2)B(3)F(4)C(5)D
22. (6 分)
(1)500
(2)11.7
(4)胶头滴管
(5)CE; AD; B
23. (10 分)
(1)H2SO4=2H++SO4
2-
(2)Ba(OH)2=Ba2++2OH-
(3)MgCl2=Ba2++2Cl-
(4)H++OH-===H2O
(5)Ba2++SO2-
4 ===BaSO4↓
24. (4 分) (1) Fe,HCl ,FeCl2; (2)6
25. (10 分)K2CO3、CaCl2 (2 分) ; Ba(NO3)2(2 分)
Ca2++CO3
2-=CaCO3↓(3 分)
CaCO3+2H+=Ca2++CO2↑+H2O(3 分)