- 720.50 KB
- 2021-05-26 发布
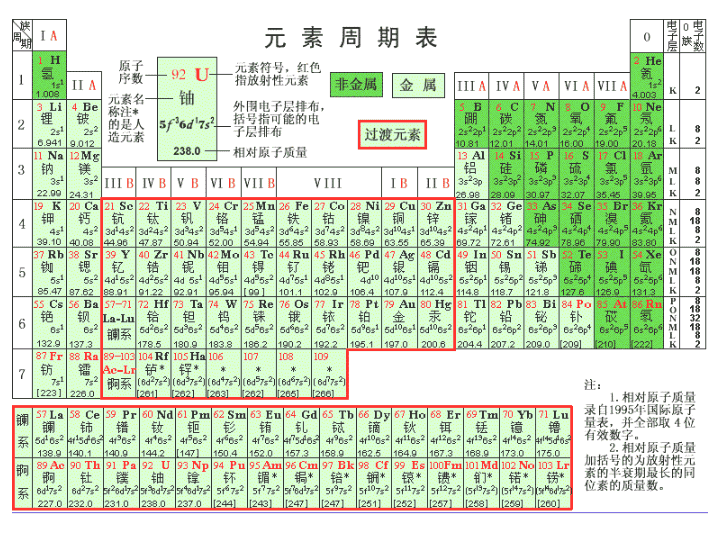
元素周期律
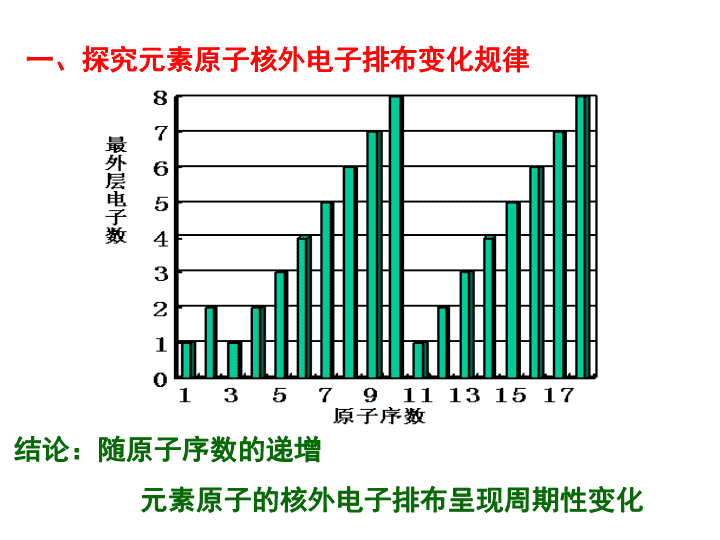
结论:随原子序数的递增
元素原子的核外电子排布呈现周期性变化
一、探究元素原子核外电子排布变化规律
二、探究元素原子半径的变化规律
结论:
随原子序数的递增元素原子半径呈现周期性变化
三、探究元素化合价的变化规律
结论:随原子序数的递增元素化合价呈现周期性变化
四、探究元素金属性、非金属性的变化规律
比较元素金属性强弱的实验方案
Ø单质跟水(或酸)反应置换出氢气的难易
Ø最高价氧化物的水化物—氢氧化物的碱性强弱
Ø金属性强的单质可以置换金属性弱的单质
比较元素非金属性强弱的实验方案
Ø单质与氢气生成气态氢化物的难易程度
Ø最高价氧化物水化物---最高价含氧酸的酸性强
弱
Ø非金属性强的单质可以置换非金属性弱的单质
Ø对应氢化物的稳定性
四、探究元素金属性、非金属性的变化规律
结论:
随原子序数的递增元素的金属性、非金属性呈现
周期性变化
随原子序数递增
核外电子排布
原子半径
元素主要化合价
周期性变化
元素金属性
非金属性
元素周期律
1、下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4
④与同浓度盐酸反应剧烈程度:Na > Mg > Al
A.①③ B.②④ C.①④ D.②③
课堂反馈
2、下列有关原子结构和元素周期律的表述正确的是( )
A.原子序数为15的元素的最高化合价为+3
B.ⅦA族元素是同周期中非金属性最强的元素
C.除零族元素外,短周期元素的最高化合价在数值上都
等于该元素所属的族序数
D.难得电子的元素一定易失电子。
B
B
3、表中数据是部分短周期元素的原子半径及主要化
合价,据此判断以下叙述正确的是( )
元素代号 L M Q R T
原子半径
/nm 0.160 0.143 0.112 0.104 0.066
主要化合
价 +2 +3 +2 +6、
-2 -2
A.氢化物的沸点为H2T<H2R
B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等
C
4、在一定条件下 RO3n- + 6I-+ 6H+ = R-+3I2+3H2O
则RO3n-中R元素的化合价为___
R原子最外层电子数为______
+5
7
追求是一个永恒的“元素周期律”,
到了终点,又是一个的新起点!
相关文档
- 2020春五年级语文下册第一单元语文2021-05-26 23:51:2022页
- 北师大版小学六年级下册数学教学课2021-05-26 23:51:1311页
- 人教版二年级上册数学教学课件-第32021-05-26 23:51:137页
- 苏教版数学小学五年级下册教学课件2021-05-26 23:49:2416页
- 苏教版数学小学三年级下册教学课件2021-05-26 23:47:0517页
- 部编人教版语文四年级上册教学课件2021-05-26 23:46:5319页
- 2018_2019学年八年级数学上册第六2021-05-26 23:39:5720页
- 新部编人教版六年级下册语文教学课2021-05-26 23:39:5716页
- 冀教版数学小学五年级下册教学课件2021-05-26 23:39:468页
- 冀教版一年级数学上册第八单元20以2021-05-26 23:32:4711页