- 372.50 KB
- 2021-05-26 发布
微专题 热重分析判断物质成分
方法思路
1.设晶体为1 mol,其质量为m。
2.失重一般是先失水,再失非金属氧化物。
3.计算每步固体剩余的质量(m余)
×100%=固体残留率。
4.晶体中金属质量不再减少,仍在m余中。
5.失重最后一般为金属氧化物,由质量守恒得m氧,由n金属∶n氧,即可求出失重后物质的化学式。
专题训练
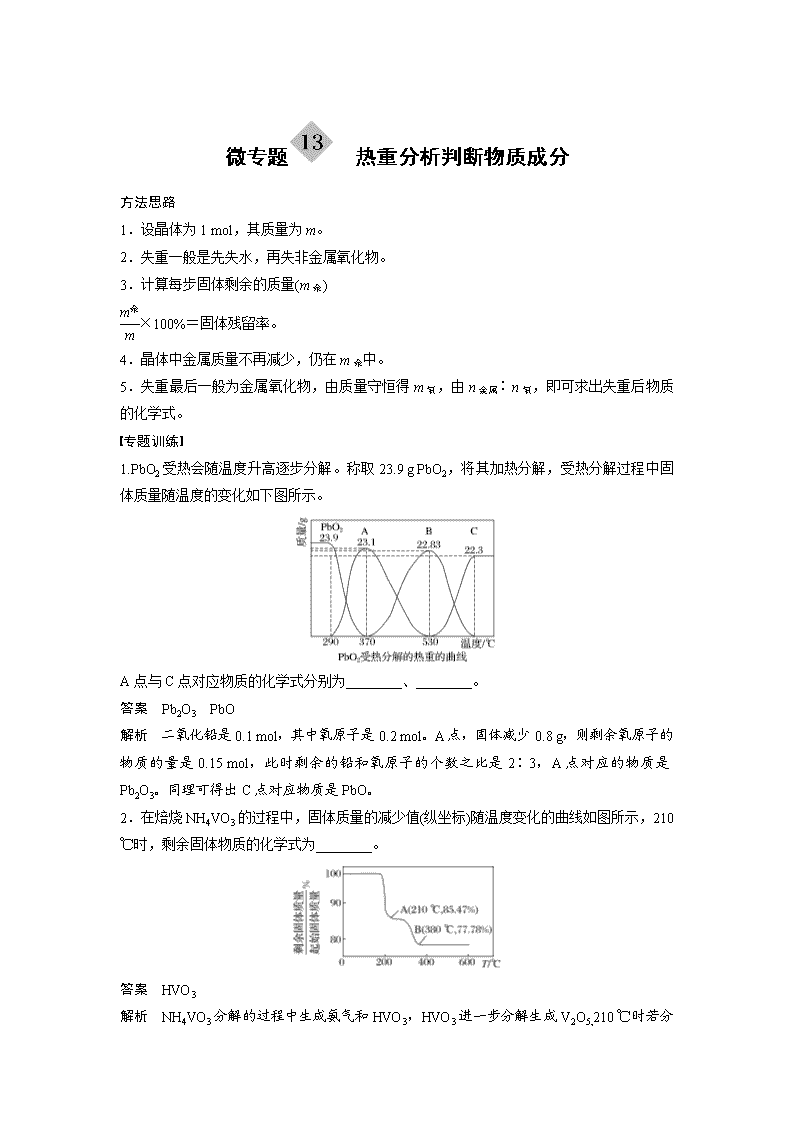
1.PbO2受热会随温度升高逐步分解。称取23.9 g PbO2,将其加热分解,受热分解过程中固体质量随温度的变化如下图所示。
A点与C点对应物质的化学式分别为________、________。
答案 Pb2O3 PbO
解析 二氧化铅是0.1 mol,其中氧原子是0.2 mol。A点,固体减少0.8 g,则剩余氧原子的物质的量是0.15 mol,此时剩余的铅和氧原子的个数之比是2∶3,A点对应的物质是Pb2O3。同理可得出C点对应物质是PbO。
2.在焙烧NH4VO3的过程中,固体质量的减少值(纵坐标)随温度变化的曲线如图所示,210 ℃时,剩余固体物质的化学式为________。
答案 HVO3
解析 NH4VO3分解的过程中生成氨气和HVO3,HVO3进一步分解生成V2O5,210 ℃
时若分解生成酸和氨气,则剩余固体占起始固体百分含量为×100%≈85.47%,所以210 ℃时,剩余固体物质的化学式为HVO3。
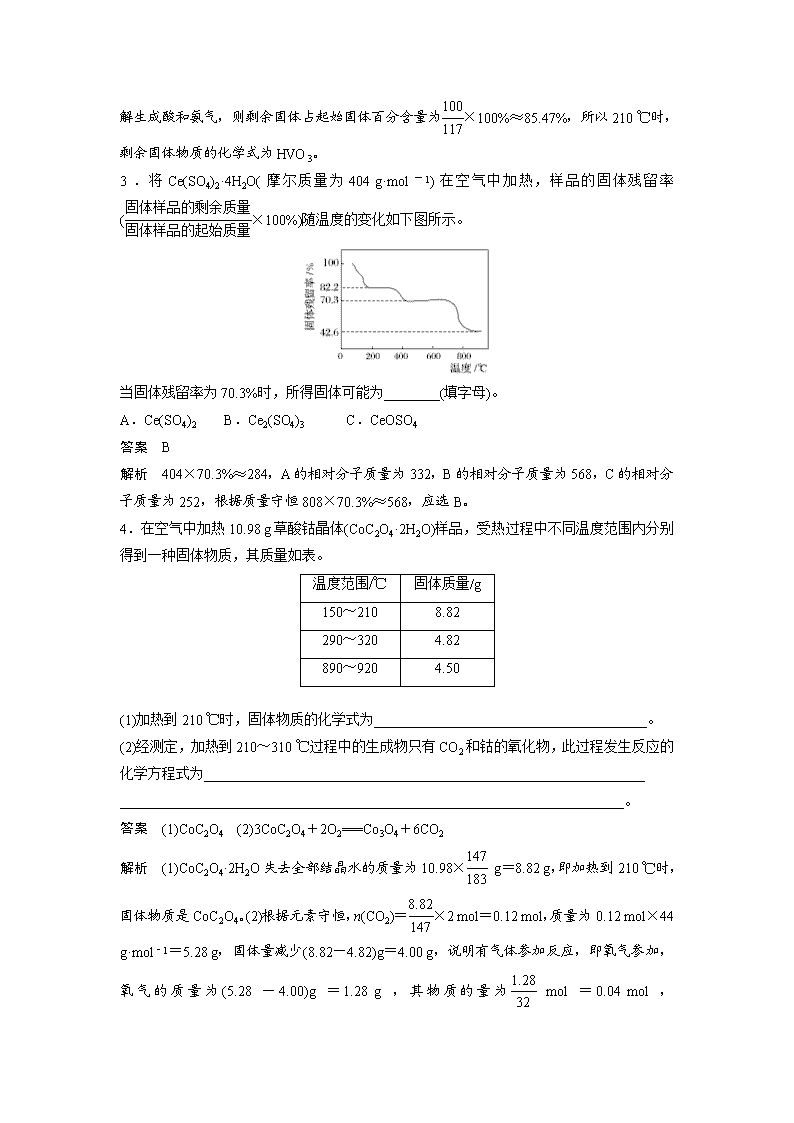
3.将Ce(SO4)2·4H2O(摩尔质量为404 g·mol-1)在空气中加热,样品的固体残留率(×100%)随温度的变化如下图所示。
当固体残留率为70.3%时,所得固体可能为________(填字母)。
A.Ce(SO4)2 B.Ce2(SO4)3 C.CeOSO4
答案 B
解析 404×70.3%≈284,A的相对分子质量为332,B的相对分子质量为568,C的相对分子质量为252,根据质量守恒808×70.3%≈568,应选B。
4.在空气中加热10.98 g草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
温度范围/℃
固体质量/g
150~210
8.82
290~320
4.82
890~920
4.50
(1)加热到210 ℃时,固体物质的化学式为_______________________________________。
(2)经测定,加热到210~310 ℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为_______________________________________________________________
________________________________________________________________________。
答案 (1)CoC2O4 (2)3CoC2O4+2O2===Co3O4+6CO2
解析 (1)CoC2O4·2H2O失去全部结晶水的质量为10.98× g=8.82 g,即加热到210 ℃时,固体物质是CoC2O4。(2)根据元素守恒,n(CO2)=×2 mol=0.12 mol,质量为0.12 mol×44 g·mol-1=5.28 g,固体量减少(8.82-4.82)g=4.00 g,说明有气体参加反应,即氧气参加,氧气的质量为(5.28-4.00)g=1.28 g,其物质的量为 mol=0.04 mol,n
(CoC2O4)∶n(O2)∶n(CO2)=∶0.04∶0.12=0.06∶0.04∶0.12=3∶2∶6,依据原子守恒,3CoC2O4+2O2===Co3O4+6CO2。
5.将草酸锌晶体(ZnC2O4·2H2O)加热分解可得到一种纳米材料。加热过程中固体残留率随温度的变化如图所示,300~460 ℃范围内,发生反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
答案 ZnC2O4ZnO+CO↑+CO2↑
解析 ZnC2O4·2H2O的摩尔质量为189 g·mol-1,ZnC2O4的百分含量为×100%≈80.95%,
ZnO的百分含量为×100%≈42.86%。
所以B点的固体为ZnO,化学方程式为ZnC2O4ZnO+CO↑+CO2↑。
6.MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则
(1)300 ℃时,剩余固体中n(Mn)∶n(O)为________。
(2)图中点D对应固体的成分为______________(填化学式)。
答案 (1)1∶2 (2)Mn3O4和MnO
解析 设MnCO3的物质的量为1 mol,即质量为115 g。
(1)A点剩余固体质量为115 g×75.65%≈87 g,
减少的质量为115 g-87 g=28 g,
可知MnCO3失去的组成为“CO”,
故剩余固体的成分为MnO2。
(2)C点剩余固体质量为115 g×61.74%≈71 g,
据锰元素守恒知m(Mn)=55 g,
则m(O)=71 g-55 g=16 g,
则n(Mn)∶n(O)=∶=1∶1,
故剩余固体的成分为MnO,
同理,B点剩余固体质量为115 g×66.38%=76.337 g,
因m(Mn)=55 g,
则m(O)=76.337 g-55 g=21.337 g,
则n(Mn)∶n(O)=∶≈3∶4,
故剩余固体的成分为Mn3O4,
因D点介于B、C之间,故D点对应固体的成分为Mn3O4与MnO的混合物。
7.(2018·滁州质检)CoC2O4是制备钴的氧化物的重要原料。下图为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300 ℃及以上所得固体均为钴氧化物。
通过计算确定C点剩余固体的化学成分为________(填化学式)。写出B点对应的物质与O2在225~300 ℃发生反应的化学方程式:____________________________________________
________________________________________________________________________。
答案 Co3O4(写成CoO·Co2O3亦可) 3CoC2O4+2O2Co3O4+6CO2
解析 CoC2O4·2H2O―→CoC2O4―→CoxOy,
C点应为钴的氧化物,18.3 g晶体中钴的物质的量为0.1 mol,质量为5.9 g,8.03 g CoxOy中氧的物质的量为≈0.133 mol,
所以=≈,
其化学式为Co3O4。
8.为研究一水草酸钙的热分解性质,进行如下实验:准确称取36.50 g样品加热,样品的固体残留率(×100%)随温度的变化如下图所示。
(1)300 ℃时残留固体的成分为________,900 ℃时残留固体的成分为________。
(2)通过计算求出500 ℃时固体的成分及质量(写出计算过程)。
答案 (1)CaC2O4 CaO
(2)500 ℃时残留固体的成分为CaC2O4和CaCO3的混合物,样品中CaC2O4·H2O的物质的量n(CaC2O4·H2O)==0.25 mol,
设混合物中CaC2O4和CaCO3的物质的量分别为x mol和y mol,
根据500 ℃时固体总质量可得128x+100y=36.50 g×76.16%,
根据钙元素守恒可得x+y=0.25,
解得x=0.1,y=0.15,
m(CaC2O4)=0.1 mol×128 g·mol-1=12.8 g,
m(CaCO3)=0.15 mol×100 g·mol-1=15.0 g
500 ℃时固体的成分为12.8 g CaC2O4和15.0 g CaCO3。
相关文档
- 2020届高考化学一轮复习化学反应与2021-05-26 01:38:0329页
- 2020届高考化学一轮复习化学反应速2021-05-26 00:16:5218页
- 2020届高考化学一轮复习化学工艺流2021-05-25 23:40:3819页
- 2021届高考化学一轮复习化学平衡常2021-05-25 17:25:4819页
- 2020届高考化学一轮复习化学反应与2021-05-25 16:02:438页
- 高考化学一轮复习化学实验常见物质2021-05-25 15:23:559页
- 2021届高考化学一轮复习化学平衡状2021-05-25 14:20:2610页
- 2020版高考一轮复习化学通用版学案2021-05-25 11:07:1521页
- 2020届高考化学一轮复习化学能与热2021-05-25 02:16:376页
- 2020届高考化学一轮复习化学反应与2021-05-24 23:20:165页