- 559.50 KB
- 2021-02-26 发布
- 1、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 2、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报QQ:3215808601
化学反应速率
一、选择题(本题包括5小题,每题5分,共25分)
1.(2020·吴忠模拟)下表为某学生进行的两组实验:
反应物
Na2S2O3溶液
H2SO4溶液
水
甲
0.1 mol·
L-1
10 mL
0.1 mol·
L-1
10 mL
5 mL
乙
0.2 mol·
L-1
5 mL
0.2 mol·
L-1
5 mL
20 mL
若其他条件均相同,上述两组实验中,对应反应的反应速率关系为 ( )
A.甲>乙 B.甲<乙
C.甲=乙 D.无法判断
【解析】选A。甲组溶液的总体积是25 mL,混合溶液中,甲组反应物的浓度c(Na2S2O3)=c(H2SO4)==0.04 mol·L-1;乙组溶液的总体积是30 mL,混合溶液中,乙组反应物的浓度c(Na2S2O3)=c(H2SO4)=≈
0.033 mol·L-1。由于甲组中反应物的浓度较大,故在其他条件相同时,其反应速率较大,即甲组的反应速率大于乙组的反应速率,A项正确。
2.一定条件下,乙醛可发生分解:CH3CHO(l)CH4+CO,已知该反应的活化能为190 kJ·mol-1。在含有少量I2的溶液中,该反应的机理如下:
反应Ⅰ:CH3CHO+I2CH3I+HI+CO(慢)
反应Ⅱ:CH3I+HICH4+I2(快)
下列有关该反应的叙述正确的是 ( )
A.反应速率与I2的浓度有关
B.HI在反应Ⅰ中是氧化产物
C.反应焓变的绝对值等于190 kJ·mol-1
D.乙醛的分解速率主要取决于反应Ⅱ
【解析】选A。碘为催化剂,能增大反应速率,在一定范围内催化剂浓度越大,反应速率越大,A正确;反应Ⅰ中碘元素化合价降低,HI为还原产物,B错误;焓变为反应物与生成物的活化能之差,C错误;反应Ⅰ较慢,决定着总反应的速率,D错误。
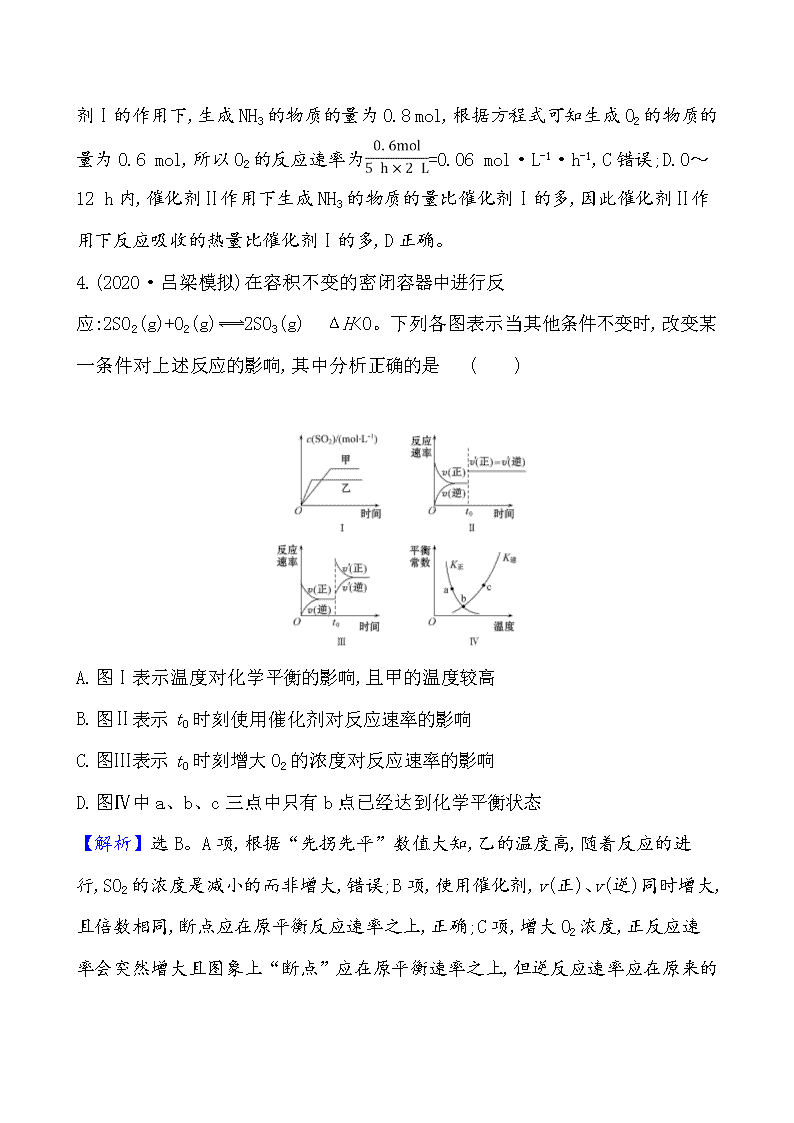
3.(2020·郑州模拟)已知:2N2(g)+6H2O(g)4NH3(g)+3O2(g) ΔH=+Q kJ·mol-1,如图为该反应在不同初始浓度的N2和不同催化剂Ⅰ、Ⅱ作用下(其他条件相同),体积为2 L的密闭容器中n(NH3)随反应时间的变化曲线,下列说法正确的是 ( )
A.0~6 h内,催化剂Ⅰ的催化效果比催化剂Ⅱ的好
B.a点时,催化剂Ⅰ、Ⅱ作用下N2的转化率相等
C.0~5 h内,在催化剂Ⅰ的作用下,O2的反应速率为0.12 mol·L-1·h-1
D.0~12 h内,催化剂Ⅱ作用下反应吸收的热量比催化剂Ⅰ的多
【解析】选D。A.催化剂Ⅰ和催化剂Ⅱ的条件下,N2的初始浓度不同,催化剂Ⅰ和催化剂Ⅱ的催化效果没法比较,A错误;B.N2的初始浓度不同,a点时生成NH3的物质的量相等,因此N2的转化率不相等,B错误;C.由图象可知0~5 h内,
在催化剂Ⅰ的作用下,生成NH3的物质的量为0.8 mol,根据方程式可知生成O2的物质的量为0.6 mol,所以O2的反应速率为=0.06 mol·L-1·h-1,C错误;D.0~12 h内,催化剂Ⅱ作用下生成NH3的物质的量比催化剂Ⅰ的多,因此催化剂Ⅱ作用下反应吸收的热量比催化剂Ⅰ的多,D正确。
4.(2020·吕梁模拟)在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是 ( )
A.图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B.图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
【解析】选B。A项,根据“先拐先平”数值大知,乙的温度高,随着反应的进行,SO2的浓度是减小的而非增大,错误;B项,使用催化剂,v(正)、v(逆)同时增大,且倍数相同,断点应在原平衡反应速率之上,正确;C项,增大O2浓度,正反应速率会突然增大且图象上“断点”应在原平衡速率之上,
但逆反应速率应在原来的基础上逐渐增大,错误;D项,a、b、c三点是在不同温度下的平衡曲线上,三点都是平衡点,错误。
5.(2018·浙江4月选考)某工业流程中,进入反应塔的混合气体中NO和O2的物质的量分数分别为0.10和0.06,发生化学反应2NO(g)+O2(g)2NO2(g),在其他条件相同时,测得实验数据如下表:
压强/
(×
105 Pa)
温度
/℃
NO达到所列转化率需要时间/s
50%
90%
98%
1.0
30
12
250
2 830
90
25
510
5 760
8.0
30
0.2
3.9
36
90
0.6
7.9
74
根据表中数据,下列说法正确的是 ( )
A.升高温度,反应速率加快
B.增大压强,反应速率变慢
C.在1.0×105 Pa、90 ℃条件下,当转化率为98%时反应已达平衡
D.若进入反应塔的混合气体为a mol,反应速率以v=表示,则在8.0×105 Pa、30 ℃条件下,转化率从50%增至90%时段NO的反应速率为 mol·s-1
【解析】选D。A选项,两组压强相同的实验中,当NO转化率相同时,温度高时需要时间长,因此由表中数据可知,升高温度,反应速率减慢,错误;B选项,当温度均为30 ℃或90 ℃,且NO转化率相同时,压强大时需要时间短,因此增大压强,反应速率变快,错误;C选项,从题给数据无法判断当转化率为98%时,
反应是否已达到平衡状态,错误;D选项,起始时NO的物质的量为 mol,NO的转化率从50%增至90%时,NO转化的物质的量为 mol×(90%-50%)= mol,需要时间为3.7 s,因此反应速率为 mol·s-1,正确。
二、非选择题(本题包括2小题,共25分)
6.(12分)化学反应速率是化学反应原理的重要组成部分。请回答下列问题:
(1)已知一定条件下发生反应:2SO2(g)+O2(g)2SO3(g) ΔH<0,在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件)。
t1
t2
t3
t4
(2)探究反应条件对0.10 mol·L-1 Na2S2O3溶液与稀H2SO4反应速率的影响。其设计与测定结果如下:
编
号
反应
温度/℃
Na2S2O3
溶液/mL
甲
0.1 mol·L-1
H2SO4溶液/mL
乙
①
25 ℃
10.0
0
10.0
②
25 ℃
5.0
a
10.0
③
45 ℃
10.0
0
10.0
上述实验①③是探究 对化学反应速率的影响;若上述实验①②是探究浓度对化学反应速率的影响,则表格中“甲”为 ,a为 ;乙是实验需要测量的物理量,则表格中“乙”为 。
(3)已知2KMnO4+5H2C2O4+3H2SO4K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。
①针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是 的影响。
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入 (填字母序号)。
A.硫酸钾 B.氯化锰 C.硫酸锰 D.水
【解析】(1)分析图象知,t1时刻,v正瞬时增大,后逐渐减小,则改变条件反应速率加快,平衡正向移动,对于反应:2SO2(g)+O2(g)2SO3(g) ΔH<0而言,改变的条件是加压或增大反应物浓度(充入SO2或O2);t2时刻,v正瞬时增大,后保持不变,说明改变条件反应速率加快而平衡不移动,改变的条件为加入催化剂;t3时刻,v正瞬时减小,后逐渐增大,则改变条件反应速率减慢,平衡逆向移动,对于反应:2SO2(g)+O2(g)2SO3(g) ΔH<0而言,改变的条件是减压或减小反应物浓度(分离移除SO2或O2);t4时刻,v正瞬时不变,后逐渐减小,则改变条件正反应速率瞬时不变,平衡正向移动,对于反应:2SO2(g)+O2(g)2SO3(g) ΔH<0而言,改变的条件是减小生成物浓度(分离移除SO3)。
(2)分析表中①③两组数据知除温度外的其他反应条件相同,故实验①③是探究温度对化学反应速率的影响;若上述实验①②是探究浓度对化学反应速率的影响,必须保证其他条件相同,则表格中“甲”为水/mL,a为5.0;乙是实验需要测量的物理量,则表格中“乙”为出现浑浊的时间/s。
(3)①根据影响化学反应速率的外界条件分析,还可能是催化剂(或硫酸锰或Mn2+的催化作用)的影响。②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入硫酸锰,选C。
答案:(1)t1:加压或增大反应物浓度(充入SO2或O2) t2:加入催化剂 t3:减压或减小反应物浓度(分离移除SO2或O2) t4:减小生成物浓度(分离移除SO3) (2)温度 水/mL 5.0
出现浑浊的时间/s(填“岀现浑浊的时间”也可)
(3)①催化剂(或硫酸锰或Mn2+的催化作用) ②C
7.(13分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条(足量)浸入锥形瓶内一定量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
①请在图3的方框中画出上述反应的速率与时间的关系曲线。
②根据图象变化趋势分析变化原因:
。
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快。他决定对其原因进行探究。
填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而S对反应没有影响;
原因Ⅱ: ;
原因Ⅲ:Cl-对反应具有促进作用,而S对反应具有阻碍作用;
原因Ⅳ:Cl-、S均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ: 。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入盛有同体积、[H+]相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验a中 ,实验b中
,则说明原因Ⅲ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
【解析】(1)①通过图2中的2、4、6 min时的速率画出速率走向弧线。
②该反应为放热反应,0~4分钟H+浓度降低,但是温度升高是主要因素,所以速率加快;4~6分钟H+浓度降低是主要因素,所以速率减慢。
(2)①根据原因Ⅰ:Cl-1对反应具有促进作用,而S对反应没有影响,提出相反猜想即得原因Ⅱ答案。根据原因Ⅳ:Cl-1:S均对反应具有促进作用,但Cl-影响更大,提出相反猜想即得。原因Ⅴ②根据原因Ⅲ:Cl-对反应有促进作用,而S对反应具有阻碍作用,可推测,实验a中反应速率加快,实验b中反应速率减慢。
答案:(1)①
②镁和盐酸的反应是放热反应,随着反应体系温度升高,反应速率增大;4 min后由于溶液中H+浓度降低,所以反应速率减小
(2)①Cl-对反应没有影响,而S对反应具有阻碍作用 Cl-、S均对反应具有阻碍作用,但Cl-影响更小(或S影响更大)
②反应速率加快 反应速率减慢
一、选择题(本题包括3小题,每题6分,共18分)
1.(2020·芜湖模拟)已知臭氧第二步分解过程的机理为①O3+ClO2+ClO ②ClO+OO2+Cl。下列说法错误的是 ( )
A.该过程的化学方程式为O3+O2O2
B.若改变催化剂,反应的ΔH不变
C.催化剂可以加快反应速率,使反应的平衡常数增大
D.氯原子可以降低反应的活化能,增加活化分子的数目
【解析】选C。根据臭氧第二步分解过程的机理可知,Cl为催化剂,ClO为中间产物,将①、②反应相加可得总反应为O3+O2O2,A项正确;改变催化剂,能够改变反应的活化能,但反应热ΔH不变,B项正确;催化剂可以加快反应速率,但不能使平衡发生移动,且平衡常数只与温度有关,故平衡常数不变,C项错误;氯原子在该反应中作催化剂,可以降低反应的活化能,使一部分普通分子变为活化分子,使活化分子数目增加,D项正确。
2.(2020·南阳模拟)实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件相同),则下列有关说法正确的是 ( )
A.若增大压强,该反应的反应速率一定增大
B.pH=6.8时,随着反应的进行反应速率逐渐增大
C.一定pH范围内,溶液中H+浓度越小,反应速率越快
D.可采用调节pH的方法使反应停止
【解析】选D。无法确定反应有没有气体参加,A项错误;图象中表示反应速率的是曲线的斜率,曲线斜率逐渐减小,反应速率逐渐减小,B项错误;pH越小,H+浓度越大,反应速率越快,C项错误;pH=8.8时,反应速率接近0,D项正确。
3.(2020·海淀区模拟)一定温度下,向10 mL 0.40 mol·L-1H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示:
t/min
0
2
4
6
v(O2)/mL
0
9.9
17.2
22.4
资料显示,反应分两步进行:①2Fe3++H2O22Fe2++O2↑+2H+;②H2O2+2Fe2++2H+2H2O+2Fe3+。反应过程中能量变化如图所示:
下列说法不正确的是 ( )
A.0~6 min的平均反应速率:v(H2O2)=3.33×10-2 mol·L-1·min-1
B.Fe3+的作用是增大过氧化氢的分解速率
C.反应①是吸热反应,反应②是放热反应
D.反应2H2O2(aq)2H2O(l)+O2(g)的ΔH=E1-E2<0
【解析】选D。A项,依据题意知,0~6 min生成O2的体积为22.4 mL,则消耗n(H2O2)=2×10-3 mol,v(H2O2)===3.33×10-2 mol·L-1·min-1;B项,Fe3+在过氧化氢分解过程中起催化作用,能够增大过氧化氢的分解速率;C项,观察反应过程中的能量变化图知,反应①是吸热反应,反应②是放热反应;D项,
观察反应过程中的能量变化图知,反应2H2O2(aq)2H2O(l)+O2(g)为放热反应,但ΔH≠E1-E2。
二、非选择题(本题包括2小题,共32分)
4.(16分)(2020·唐山模拟)大气中的部分碘源于O3对海水中I-的氧化。某科学小组进行O3与含I-溶液反应相关研究。
(1)O3将I-氧化生成I2的过程由3步反应组成:
①I-(aq)+O3(g)IO-(aq)+O2(g) ΔH1
②IO-(aq)+H+(aq)HOI(aq) ΔH2
③HOI(aq)+I-(aq)+H+(aq)I2(aq)+H2O(l) ΔH3
用热化学方程式表示O3氧化I-生成I2的反应
。
(2)O3在水中易分解,在一定条件下,O3的浓度减少一半时所需的时间(t)如下表所示。已知O3的起始浓度为0.021 6 mol·L-1。
①在30 ℃、pH=4.0条件下,O3的分解速率为 mol·L-1·min-1。
②pH增大能加速O3分解,表明对O3分解起催化作用的是 。
③根据表中数据,推测O3在下列条件下分解速率依次增大的顺序为 (填字母代号)。
a.40 ℃、pH=3.0
b.10 ℃、pH=4.0
c.30 ℃、pH=7.0
【解析】(1)将所给的三个反应相加,即①+②+③可得总反应:2I-(aq)+O3(g)+2H+(aq)I2(aq)+O2(g)+H2O(l) ΔH=ΔH1+ΔH2+ΔH3。
(2)①v===1.00×10-4 mol·L-1·min-1;②pH增大,则OH-浓度增大,pH增大能加速O3分解,表明对O3分解起催化作用的是OH-;③由表中数据可知,40 ℃、pH=3.0时,所需时间在31~158 min之间;10 ℃、pH=4.0时,所需时间>231 min;30 ℃、pH=7.0时,所需时间<15 min,则分解速率依次增大的顺序为b、a、c。
答案:(1)O3(g)+2I-(aq)+2H+(aq)I2(aq)+H2O(l)+O2(g) ΔH=ΔH1+ΔH2+ΔH3
(2)①1.00×10-4 ②OH- ③bac
5.(16分)(2020·深圳模拟)甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2Mn+5H2C2O4+6H+2Mn2++10CO2↑+8H2O)
甲组:利用如图装置,通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小(实验中所用KMnO4溶液均已加入H2SO4)。
序号
A溶液
B溶液
①
2 mL 0.2 mol·L-1 H2C2O4溶液
4 mL 0.01 mol·L-1 KMnO4溶液
②
2 mL 0.1 mol·L-1 H2C2O4溶液
4 mL 0.01 mol·L-1 KMnO4溶液
③
2 mL 0.2 mol·L-1 H2C2O4
4 mL 0.01 mol·L-1 KMnO4溶液和少量
溶液
MnSO4
(1)该实验的目的是探究 对化学反应速率的影响。
(2)分液漏斗中A溶液应该 加入(填“一次性”或“逐滴滴加”)。
(3)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是 。
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率,为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
实验编号
1
2
3
4
水/mL
10
5
0
x
0.5 mol·L-1
H2C2O4/mL
5
10
10
5
0.2 mol·L-1
KMnO4/mL
5
5
10
10
时间/s
40
20
10
(4)x= 。
A.5 B.10 C.15 D.20
4号实验中始终没有观察到溶液褪色,你认为可能的原因是 。
【解析】(1)根据表中数据可知,实验①②探究的是浓度对反应速率的影响,实验①③探究的是催化剂对反应速率的影响,所以实验目的是探究草酸浓度和催化剂对化学反应速率的影响;(2)为了避免实验误差,实验过程中分液漏斗中的溶液A必须一次性加入,不能逐滴加入;(3)实验结束后读数前需要移动量气管,使两个量气管的液面相平,其作用是使两个量气管的压强相等,避免产生压强差,影响测定结果;(4)为了探究KMnO4与H2C2O4浓度对反应速率的影响,实验1~4中溶液的总体积应该为20,则x=20-10-5=5;根据反应2Mn+5H2C2O4+6H+2Mn2++10CO2↑+8H2O可知,10 mL酸性高锰酸钾需要消耗
10 mL草酸溶液,所以实验4中高锰酸钾过量,导致溶液没有褪色。
答案:(1)草酸浓度和催化剂
(2)一次性
(3)移动量气管,使两个量气管的液面相平
(4)A KMnO4溶液过量