- 351.00 KB
- 2021-02-26 发布
- 1、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 2、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报QQ:3215808601
课时跟踪训练(十四)
[基础巩固]
1.下列晶体中不属于原子晶体的是( )
A.干冰 B.金刚砂
C.金刚石 D.水晶
[解析] 干冰是固体CO2,属于分子晶体,A正确;金刚砂属于原子晶体,B不符合题意;金刚石属于原子晶体,C不符合题意;水晶属于原子晶体,D不符合题意。
[答案] A
2.根据下表中给出的有关数据,判断下列说法中错误的是( )
AlCl3
SiCl4
晶体硼
金刚石
晶体硅
熔点/℃
190
-68
2300
>3550
1410
沸点/℃
178
57
2550
4827
2355
A. SiCl4是分子晶体
B.晶体硼是原子晶体
C.AlCl3是分子晶体,加热能升华
D.金刚石中的C-C键比晶体硅中的Si-Si键弱
[解析] SiCl4、AlCl3的熔沸点低,都是分子晶体,AlCl3的沸点低于其熔点,即在未熔化的温度下它就能汽化,故AlCl3加热能升华,A、C正确;单质硼的熔沸点高,所以晶体硼是原子晶体,B正确;C原子的半径比Si原子的半径小,金刚石中的C-C键键长比晶体硅中的Si-Si键键长短,金刚石中的C-C键比晶体硅中的Si-Si键强,D错误。
[答案] D
3.美国《科学》杂志曾报道:在40 GPa的高压下,用激光加热到1800 K,人们成功制得了原子晶体CO2,下列对该物质的推断一定不正确的是( )
A.该原子晶体中含有极性共价键
B.该原子晶体易汽化,可用作制冷材料
C.该原子晶体有很高的熔、沸点
D.该原子晶体硬度大,可用作耐磨材料
[解析] CO2由固态时形成的分子晶体变为原子晶体,其成键情况也发生了变化,由原来的碳氧双键变为碳氧单键,但化学键依然为极性共价键,故A项正确。由于晶体类型及分子结构发生变化,物质的熔、沸点等性质也发生了变化。CO2原子晶体具有高硬度,高熔、沸点等特点,故C、D项正确,B项错误。
[答案] B
10
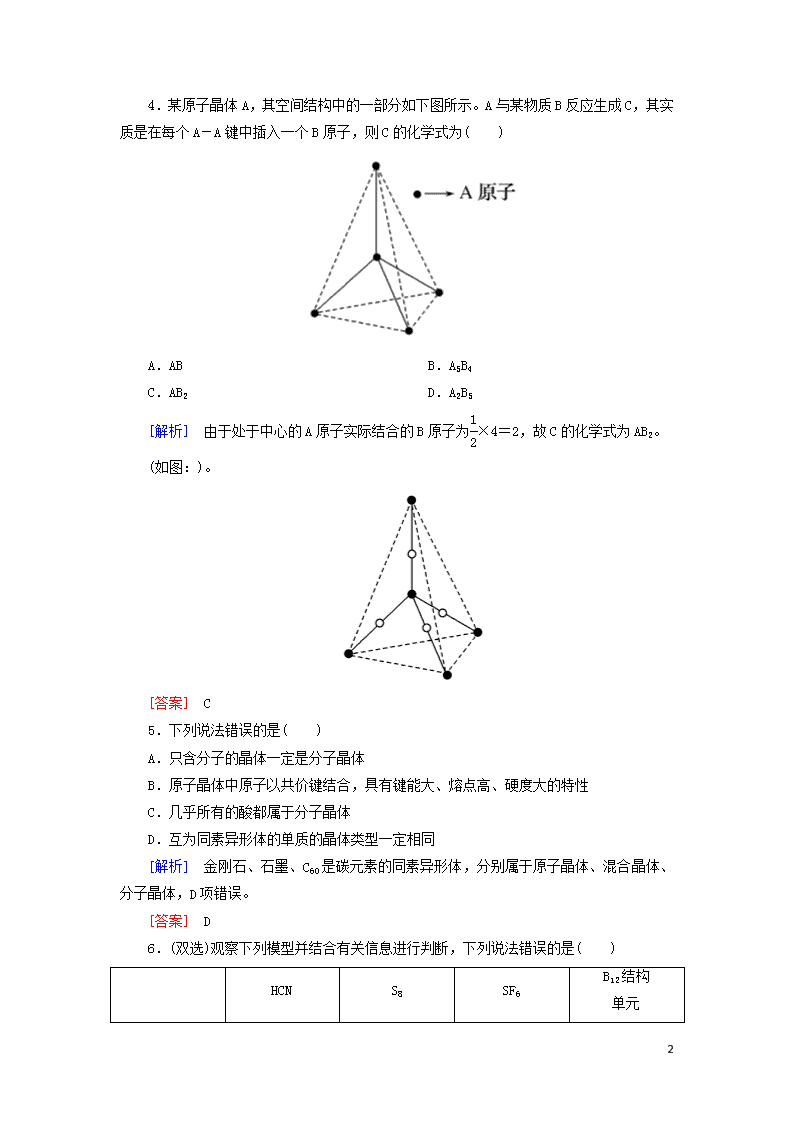
4.某原子晶体A,其空间结构中的一部分如下图所示。A与某物质B反应生成C,其实质是在每个A-A键中插入一个B原子,则C的化学式为( )
A.AB B.A5B4
C.AB2 D.A2B5
[解析] 由于处于中心的A原子实际结合的B原子为×4=2,故C的化学式为AB2。
(如图:)。
[答案] C
5.下列说法错误的是( )
A.只含分子的晶体一定是分子晶体
B.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
C.几乎所有的酸都属于分子晶体
D.互为同素异形体的单质的晶体类型一定相同
[解析] 金刚石、石墨、C60是碳元素的同素异形体,分别属于原子晶体、混合晶体、分子晶体,D项错误。
[答案] D
6.(双选)观察下列模型并结合有关信息进行判断,下列说法错误的是( )
HCN
S8
SF6
B12结构
单元
10
结构模
型示
意图
备注
-
易溶于CS2
-
熔点1873 K
A.HCN的结构式为HCN,分子中含有1个σ键和2个π键
B.固态硫S8属于原子晶体
C.SF6是由极性键构成的非极性分子
D.单质硼属原子晶体,结构单元中含有30个B-B键
[解析] “C≡N”键中含有1个σ键和2个π键,A项不正确;S8属于分子晶体,B项错;SF6是正八面体对称结构,是非极性分子,C项正确;硼晶体的结构单元中有12个B原子,每个原子形成5个B-B键,而每个B-B键为2个原子所共有,所以B-B键数为12×5/2=30个,D项正确。
[答案] AB
7.在x mol石英晶体中,含有Si-O键数是( )
A.x mol B.2x mol
C.3x mol D.4x mol
[解析] 由石英的晶体结构可以看出一个硅原子周围有四个氧原子,即一个硅原子形成4个Si-O键,所以在x mol石英晶体中含有Si-O键数是4x mol。
[答案] D
8.现在已能在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2原子晶体的说法中正确的是( )
A.CO2的原子晶体中存在范德华力,每1 mol CO2原子晶体中含有2NA个π键
B.在一定条件下,CO2原子晶体转化为CO2分子晶体是物理变化
C.熔点:金刚石>原子晶体CO2
D.在CO2的原子晶体中,每个C原子周围结合4个O原子,每个O原子与两个C原子相结合
[解析] 原子晶体中不存在分子间作用力,A不正确;两者的晶体类型不同,CO2原子晶体转化为CO2分子晶体时存在化学键的断裂和生成,属于化学变化,B不正确;由于氧原子的半径小于碳原子的半径,所以熔点应该是原子晶体CO2>金刚石,C不正确;由题意知CO2原子晶体与SiO2结构相似,所以D正确。
[答案] D
9.下列说法正确的是( )
A.金刚石晶体中的最小碳原子环由6个碳原子构成
B.熔点很高的晶体一定属于原子晶体
10
C.1 mol SiO2晶体中含2 mol Si-O键
D.金刚石化学性质稳定,与任何物质都不反应
[解析] 据金刚石结构模型可知,金刚石中的最小碳环为六元环,在高温下可断开C-C键与O2反应,故A项正确,D项错误;钨的熔点很高,但属于金属晶体,B项错误;1 mol SiO2晶体中含4 mol Si-O键,C项错误。
[答案] A
10.(双选)下列关于原子晶体的说法中错误的是( )
A.原子晶体中不存在独立的“分子”
B.原子晶体中所有原子之间以共价键结合成空间网状结构
C.金刚石是原子晶体,所以其化学性质稳定,即使在高温下也不与氧气发生反应
D.原子晶体中必须有共价键,可能存在分子间作用力
[解析] 原子晶体中原子之间以共价键结合形成空间网状结构,故原子晶体中不存在单独的“分子”;由原子晶体的定义可知,原子晶体中只有共价键,不存在分子间作用力。碳的化学性质不活泼,但在一定条件下能与O2、CO2等发生反应。故选CD。
[答案] CD
11.下列说法正确的是( )
A.在含4 mol Si-O键的二氧化硅晶体中,氧原子的数目为4NA
B.金刚石晶体中,碳原子数与C-C键数之比为1∶2
C.30 g二氧化硅晶体中含有0.5 NA个二氧化硅分子
D.晶体硅、晶体氖均是由相应原子直接构成的原子晶体
[解析] 在二氧化硅晶体中,每个硅原子形成4个Si-O键,故含有4 mol Si-O键的二氧化硅晶体的物质的量为1 mol,即含有2NA个氧原子,A项错误;金刚石中每个碳原子均与另外4个碳原子形成共价键,且每两个碳原子形成一个C-C键,故1 mol 金刚石中共有2 mol C-C键,因此碳原子与C-C键数目之比为1∶2,B项正确;二氧化硅晶体中不存在分子这种微粒,C项错误;氖晶体是由单原子分子靠分子间作用力结合在一起形成的,属于分子晶体,D项错误。
[答案] B
12.二氧化硅晶体是立体的网状结构,其晶体结构模型如图所示,请认真观察该模型后回答下列问题:
10
(1)二氧化硅晶体中最小环上有________个原子,晶体结构中存在以________原子为中心、________原子为顶点的正四面体结构。
(2)晶体中每个最小环上有________个硅原子,________个氧原子。
(3)晶体中存在的作用力有________。
A.共价键 B.离子键 C.配位键
D.范德华力 E.氢键
[解析] 二氧化硅晶体中,最小环上有6个硅原子和6个氧原子,并形成以硅原子为中心、氧原子(或硅原子)为顶点的正四面体结构。原子晶体中只存在共价键,且Si-O键为极性键,不是配位键。
[答案] (1)12 Si O(或Si) (2)6 6 (3)A
13.有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z。E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)金刚石>晶体硅
B.熔点从高到低的顺序:金刚石>晶体硅>碳化硅
C.三种晶体中的单元都是正四面体结构
D.三种晶体都是原子晶体且均为电的绝缘体
[解析] 依题意,金刚石、碳化硅和晶体硅都是原子晶体,且都有类似于金刚石的正四面体结构单元,因为原子半径:r(C)C-Si>Si-Si,键能越大,原子晶体的熔点越高,故熔点从高到低的顺序:金刚石>碳化硅>晶体硅,三种晶体中晶体硅具有特殊性,是半导体。
[答案] C
17.硅是一种重要的非金属单质,硅及其化合物的用途非常广泛。根据所学知识回答硅及其化合物的相关问题。
(1)基态硅原子的核外电子排布式为____________________。
(2)晶体硅的微观结构与金刚石相似,晶体硅中Si-Si键之间的夹角大小约为________。
(3)请在下框图中补充完成SiO2晶体的结构示意图(部分原子已画出),并进行必要的标注。
(4)下表列有三种物质(晶体)的熔点:
物质
SiO2
SiCl4
SiF4
熔点/℃
1710
-70.4
-90.2
简要解释熔点产生差异的原因:
①SiO2和SiCl4:_____________________________________;
②SiCl4和SiF4:______________________________________。
[解析] (2)晶体硅以一个硅原子为中心,与另外4个硅原子形成正四面体结构,所以Si-Si键之间的夹角大小约为109°28′。(3)图中给出的是硅晶体的结构,SiO2晶体相当于在硅晶体结构中的每个Si-Si键中“插入”一个氧原子,所以只要在上述每两个硅原子之间“画”一个半径比硅原子小的原子,再用实线连起来即可。(4)晶体类型不同,其熔点具有很大的差别,一般原子晶体的熔点高,而分子晶体的熔点低。
[答案] (1)1s22s22p63s23p2
(2)109°28′
10
(3)如图所示
(4)①SiO2是原子晶体,微粒间作用力为共价键。SiCl4是分子晶体,微粒间作用力为范德华力,故SiO2熔点高于SiCl4的 ②SiCl4和SiF4均为分子晶体,微粒间作用力均为范德华力,结构相似时相对分子质量越大,范德华力越大,故SiCl4的熔点高于SiF4的
10