- 487.50 KB
- 2021-05-22 发布
第十二章 烃的含氧衍生物
第一节 醇、酚
一、醇
1.醇的概念及分类
(1)概念: 化合物称为醇。
(2)分类:按 ,分为一元醇、二元醇、多元醇。
按 ,分为脂肪醇、芳香醇。
按 ,分为饱和醇、不饱和醇。
(3)饱和一元醇的分子通式为 。
2.醇的物理性质及氢键的影响
(1)物理性质:
①醇类多是 色、 气味、 态。
②密度:一元醇密度比水 ,碳原子数较少的多元醇如乙二醇等密度比水 。
③熔沸点:随碳原子数增多,熔沸点 。
④溶解性:分子中有1~3个碳原子的一元醇 ;
分子中有4~6个碳原子的一元醇 ;
分子中有7个碳原子以上的一元醇 。
(2)氢键的影响:
①醇分子中 与另一醇(或水)分子中 之间存在的相互吸引作用称为氢键。
②由于氢键的影响,醇的沸点 分子质量差不多的卤代烃和烷烃。
③因为与水分子形成了氢键,甲醇、乙醇、丙醇均可以 。
3.化学性质
(1)醇的结构特点分析:乙醇分子中化学键编号如图
①醇的官能团是 。
②反应时有可能C—O键即(2)断裂,发生取代反应或消去反应。
③反应时也可能O—H 断即(1)裂,发生取代(置换)反应或氧化反应。
(2)取代反应
①乙醇与活泼金属钠反应方程式: 。
a.反应现象: 。
b.通过上述现象,证明分子中氢原子的活泼性:酸中氢 水中氢 醇中氢。
c.断键本质:醇分子中 断裂。由于所有的醇都存在O—H键,可推知
醇及 的物质可以与活泼金属反应,如醇、酚、酸、水等。
②乙醇与溴化氢反应方程式: 。
a.反应条件: 。
b.断键本质:分子中 键断裂,可推知 醇能与氢卤酸发生取代反应。
③乙醇分子间脱水反应方程式: 。
a.反应条件: 。
b.浓H2SO4作用: ,与乙醇消去反应时作用相同。
c.断键本质:一个分子中 键断裂,另一个分子中 键断裂,可推知 醇分子间都可以发生该脱水成醚的反应。
④乙醇与乙酸酯化反应方程式: (以后详述)。
(3)乙醇催化氧化反应方程式: 。
①现象: 。
②反应条件: 。
③断键本质:分子中 键和 键断裂。可推知醇催化氧化的规律:
a.含—CH2—OH结构的醇,即与—OH相连的C上有2或3个H原子, ;
b.含>CH—OH结构的醇,即与—OH相连的C上只有一个H原子, ;
c.含—C—OH
结构的醇,即与—OH相连的C上没有H原子, 。
④醇被氧化的过程实质是分子中 。因此在解题时见到 时,常联想到醇生成醛的过程。
⑤铜的催化原理是: , 。
a.催化过程中两个反应交替进行,才有醇氧化时铜丝红色、黑色交替变化的现象。
b.乙醇在加热条件下,能与CuO直接反应生成醛。因此可用 除去铜器表面黑色氧化膜。
⑥其它氧化反应:
a.醇能使酸性KMnO4溶液褪色。必须是 醇使KMnO4溶液褪色,反之不能。
b. 乙醇燃烧方程式: 。现象: 。
(4)乙醇消去反应方程式: 。
①反应条件: 。其它醇消去反应条件为 。
②浓硫酸作用: 。
③断键本质:醇分子中 健和 键断裂。可推知:连接醇羟基的C原子若无 或邻位碳原子上 ,则不能发生消去反应。如: 、 均不能发生消去反应。
二、实验室用乙醇消去制乙烯
1.反应原理: 。
2.收集方法: 。因为 ,所以不能用排气法收集。
3. 净化方法:用 洗气除杂。因为酒精会被浓硫酸脱水炭化,反应生成 等气体杂质。相关方程式为:C2H5OH+2H2SO4(浓)2C+2SO2↑+5H2O;
C+2H2SO4(浓)CO2↑+2SO2↑+2H2O。
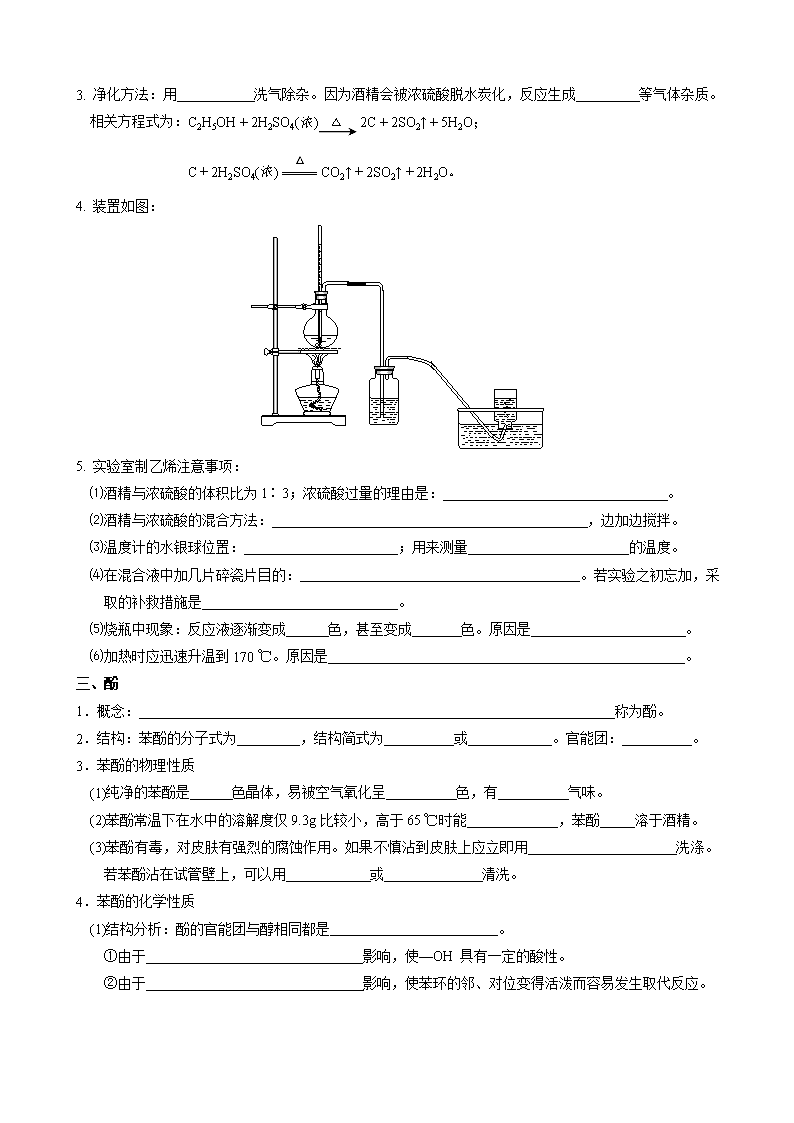
4. 装置如图:
5. 实验室制乙烯注意事项:
⑴酒精与浓硫酸的体积比为1∶3;浓硫酸过量的理由是: 。
⑵酒精与浓硫酸的混合方法: ,边加边搅拌。
⑶温度计的水银球位置: ;用来测量 的温度。
⑷在混合液中加几片碎瓷片目的: 。若实验之初忘加,采取的补救措施是 。
⑸烧瓶中现象:反应液逐渐变成 色,甚至变成 色。原因是 。
⑹加热时应迅速升温到170 ℃。原因是 。
三、酚
1.概念: 称为酚。
2.结构:苯酚的分子式为 ,结构简式为 或 。官能团: 。
3.苯酚的物理性质
(1)纯净的苯酚是 色晶体,易被空气氧化呈 色,有 气味。
(2)苯酚常温下在水中的溶解度仅9.3g比较小,高于65 ℃时能 ,苯酚 溶于酒精。
(3)苯酚有毒,对皮肤有强烈的腐蚀作用。如果不慎沾到皮肤上应立即用 洗涤。若苯酚沾在试管壁上,可以用 或 清洗。
4.苯酚的化学性质
(1)结构分析:酚的官能团与醇相同都是 。
①由于 影响,使—OH 具有一定的酸性。
②由于 影响,使苯环的邻、对位变得活泼而容易发生取代反应。
(2)弱酸性:
①苯酚与NaOH反应: 现象:浊液变澄清。
②酸性强弱关系:H2CO3 —OH HCO3-
a.苯酚钠与CO2反应: ,产物只能生成 。
b.苯酚与Na2CO3反应: ,产物只能生成 。
③苯酚酸性很弱, (能否)使石蕊指示剂变色。
(3)取代反应:
①苯酚与浓溴水反应方程式: 。
②反应现象: 。
③对反应物Br2的要求:是 。其它物质如烷烃、苯与Br2发生取代反应时,都用 Br2。
④该取代反应只能发生在苯环上羟基的 位、 位,不能发生在 位。
⑤由于三溴苯酚在水中是沉淀,在有机物中则可溶,所以 (能/不能)用加溴水法除去苯中苯酚。
(4)显色反应:
①苯酚跟FeCl3溶液作用显 色,这一反应可以用来 。
②反应本质:是 与Fe3+反应。由此可推知, 能与FeCl3显色反应。
(5)氧化反应:
①在空气中被氧化而变 色。
② (能/不能)使KMnO4溶液褪色。
③能燃烧,现象是 。
一、验证醋酸溶液、碳酸、苯酚溶液的酸性强弱
1.装置:如图。
2.现象: 。
3.结论: 。
4.NaHCO3溶液作用: ,
防止 。
二、醇与酚的比较
类别
脂肪醇
芳香醇
苯酚
实例
CH3CH2OH
C6H5—CH2—OH
C6H5—OH
官能团
结构特点
主要
化学性质
(1)取代反应:①与活泼金属反应;②与氢卤酸反应;
③酯化反应;④脱水成醚反应。
(2)消去反应。
(3)催化氧化;
(1)弱酸性;
(2)取代反应;
(3)显色反应;
(4)氧化反应;
(5)加成反应
检验方法
1.下列物质的沸点,按由高到低的顺序排列正确的是:①丙三醇 ②丙烷 ③乙二醇 ④乙醇 ( )
A.①②③④ B.④③②① C.①③④② D.①③②④
2.醇在发生下列化学反应时,醇分子不是断裂C—O键的是 ( )
A.甲醇生成甲醛
B.乙醇在浓H2SO4存在下加热至170 ℃,发生消去反应
C.丙醇在浓H2SO4催化条件下生成丙烯
D.乙醇和浓H2SO4共热温度控制在140 ℃生成乙醚
3.白藜芦醇广泛存在于食物中,它可能具有抗癌性。
(1)能够跟1 mol该化合物起反应的Br2或H2的最大用量分别是( )
A.1 mol,1 mol B.3.5 mol,7 mol C.3.5 mol,6 mol D.6 mol,7 mol
(2)下列不能与白藜芦醇反应的是 ( )
A.Na2CO3溶液 B.FeCl3溶液 C.NaHCO3溶液 D.酸性KMnO4溶液
4.已知:某有机物的结构简式为 。等物质的量的该物质分别与足量Na、NaOH、NaHCO3恰好反应应时,则Na、NaOH、NaHCO3的物质的量之比为( )
A.3∶3∶2 B.3∶2∶1 C.1∶1∶1 D.3∶2∶2
参考答案
【基础落实】
一、醇
1. (1) 羟基与链烃基或苯环侧链上的碳原子相连的
(2)分子中羟基数目 分子中是否含有苯环 烃基是否饱和 (3)CnH2n+2O
2. (1)无 特殊 液或固 小 大 逐渐升高 与水任意比互溶 可溶或微溶于水 微溶或难溶于水
(2) 羟基的氧原子 羟基的氢原子 高于 与水任意比例互溶
3. (1)羟基(—OH)
(2) ① 2CH3CH2OH+2Na —→ 2CH3CH2ONa+H2↑ 金属钠沉入液体底 部,缓慢产生气泡 > > O—H 所有 所有含O—H健
②CH3CH2OH+HBr CH3CH2Br+H2O 浓HBr溶液、加热 C—OH 所有的
③2CH3CH2OH 浓H2SO4
140℃
CH3CH2—O—CH2CH3+H2O 浓H2SO4,加热到140℃ 催化剂,脱水剂 C—OH O—H 所有的
④CH3CH2OH + CH3COOH浓硫酸
△
CH3COOCH2CH3 + H2O
(3) 2CH3CH2OH+O2 Cu
△
2CH3CHO+2 H2O
①金属铜表面出现黑 色、红 色交替变化,并有刺激性气味产生
②Cu或Ag作催化剂,加热
③—O—H 与羟基相接C原子上的C—H
可被催化氧化生成醛 能被氧化,只能生成酮 不能被催化氧化
④失去两个氢原子 相对分子质量减小2
⑤2Cu+O22CuO , CuO+CH3CH2OH CH3CHO+Cu+H2O 热酒精
⑥能被催化氧化的醇 CH3CH2OH+3O2 点燃
2CO2+3H2O 淡蓝色火焰
(4) CH3CH2OH 浓H2SO4
170℃
CH2=CH2↑+H2O
①浓H2SO4 加热170℃ 浓H2SO4 加热 ②催化剂 ,脱水剂
③C—OH 醇羟基相连接C的邻位的C—H 邻位碳原子 没有氢原子 CH3—OH (CH3)3CCH2OH
二、实验室用乙醇消去制乙烯
1. CH3CH2OH 浓H2SO4
170℃
CH2=CH2↑+H2O
2.排水集气法 乙烯的密度很接近
3. NaOH溶液 CO2、SO2
5. ⑴ 保持足够的脱水性 ⑵先在容器中加入酒精,再沿器壁慢慢加入浓硫酸,边加边搅拌
⑶插入反应混合液面下 反应混合液
⑷防止暴沸 冷却后补加
⑸棕 黑褐
⑹减少副反应:2CH3CH2OHCH3CH2OCH2CH3+H2O
三、酚
1. 羟基与苯环直接相连而形成的化合物
2. C6H6O —OH OH
—OH
3. 无 粉红色 特殊 与水互溶 易 酒精 酒精 NaOH溶液
4. (1) 羟基(—OH) 苯环对—OH的 羟基对苯环的
(2) ① —OH+NaOH→C6H5—ONa+H2O
②> > —ONa+CO2+H2O→C6H5—OH+NaHCO3 NaHCO3
—OH+ Na2CO3→C6H5—ONa+ NaHCO3 NaHCO3 ③不能
(3) ① OH
+3Br2 ——→ (2,4,6—三溴苯酚)↓ +3HBr ②溴水褪色,产生白色沉淀
③浓溴水 纯 ④邻 对 间 ⑤不能
(4) __紫 检验酚羟基 酚中—OH 所有含酚羟基的物质
(5) 浅红 能 火焰明亮,有黑烟
【规律总结】
一、验证醋酸溶液、碳酸、苯酚溶液的酸性强弱
2.A中有气泡产生,C中溶液变浑浊
3. 酸性强弱顺序为CH3COOH> H2CO3> C6H5OH
4. 吸收醋酸蒸气 醋酸直接与苯酚钠溶液反应,影响碳酸与苯酚酸性的比较
二、醇与酚的比较
醇羟基(—OH)
醇羟基(—OH)
酚羟基(—OH)
—OH与链烃基相连
—OH与苯环侧链C原子相连
—OH与苯环直接相连
灼热铜丝插入醇中有刺激性气味的气体生成
与FeCl3溶液反应显紫色
【对点训练】
1. C 2. A 3. (1)D (2)C 4. B
相关文档
- 2020届高考化学一轮复习化学能与热2021-05-22 12:12:128页
- 2020届高考化学一轮复习化学平衡状2021-05-22 00:21:426页
- 高考第一轮复习化学:醛、羧酸和酯2021-05-21 22:21:0915页
- 2020届高考化学一轮复习化学实验基2021-05-21 21:26:4514页
- 2019届高考化学一轮复习化学反应与2021-05-21 20:55:0321页
- 2020届高三化学一轮复习化学实验综2021-05-21 12:44:1810页
- 2019高考化学一轮复习化学反应速率2021-05-21 00:06:076页
- 2020届高考化学一轮复习化学能和热2021-05-20 22:26:3514页
- 2021届(鲁科版)高考化学一轮复习化学2021-05-20 22:17:5911页
- 2020届高考化学一轮复习化学反应速2021-05-20 13:59:4013页