- 1.42 MB
- 2021-05-22 发布
专题17 物质的检验、分离与提纯
备考篇提纲挈领
【考情探究】
课
标
解
读
考点
物质的检验
物质的分离与提纯
解读
掌握常见物质检验的方法
掌握常见物质分离和提纯的方法
考情分析
本专题以中等题和难题为主。设题形式有选择题、实验题、计算题。选择题通常以“判断指定实验操作和现象的结论是否正确”为切入口,以表格的形式既考查元素化合物知识又考查实验常识;实验题通常以工业生产上实际问题为载体,层层递进设问,涉及元素化合物知识及相关实验知识;计算题中前两个空有时会考查实验基础知识
备考指导
2021年高考备考一定要重点关注“实验基础知识”,如酸性(酸根结合H+能力)强弱比较、氧化性强弱比较、萃取分液、制备Fe(OH)3胶体、检验Fe2+和Fe3+等
【真题探秘】
基础篇固本夯基
【基础集训】
考点一 物质的检验
1.根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
取少量淀粉水解液于试管中,加入过量氢氧化钠溶液和新制Cu(OH)2悬浊液,加热至沸腾,出现砖红色沉淀
淀粉已完全水解
B
向浓度均为0.1 mol·L-1的Na2CO3和Na2S的混合溶液中,滴入少量AgNO3溶液,先产生黑色沉淀(Ag2S)
Ksp(Ag2S)<
Ksp(Ag2CO3)
C
向溶液X中先滴加稀硝酸,再滴加BaCl2溶液,出现白色沉淀
溶液X中一定含有SO42-
D
溴乙烷与NaOH乙醇溶液共热产生的气体通入酸性KMnO4溶液中,溶液褪色
产生的气体为乙烯
答案 B
2.根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
向酸性含碘废水中加入淀粉溶液,然后滴入少量Na2SO3溶液,废水立刻变蓝色
该废水中可能含IO3-
B
向Fe(NO3)3溶液中加入铁粉,充分振荡,再滴加少量盐酸酸化后,滴入1滴KSCN溶液,溶液变红
原Fe(NO3)3只有部分被Fe还原
C
向1-溴丙烷中加入KOH溶液,加热并充分振荡,然后取少量液体滴入AgNO3溶液中,出现棕黑色沉淀
1-溴丙烷中混有杂质
D
将乙醇与浓硫酸混合溶液加热,产生的气体直接通入酸性KMnO4溶液中,溶液紫红色逐渐褪去
产生的气体一定是乙烯
答案 A
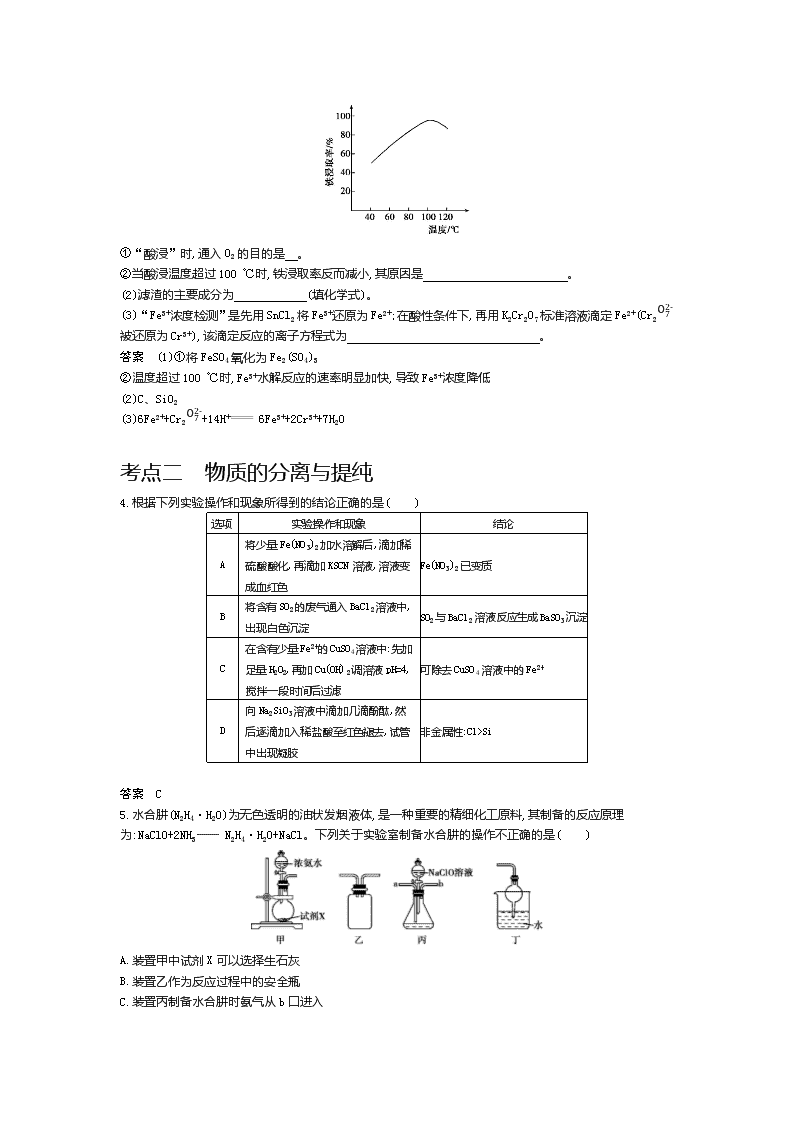
3.聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分为Fe3O4,含少量碳及二氧化硅)为原料制备的流程如下:
(1)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如图所示:
①“酸浸”时,通入O2的目的是 。
②当酸浸温度超过100 ℃时,铁浸取率反而减小,其原因是 。
(2)滤渣的主要成分为 (填化学式)。
(3)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为 。
答案 (1)①将FeSO4氧化为Fe2(SO4)3
②温度超过100 ℃时,Fe3+水解反应的速率明显加快,导致Fe3+浓度降低
(2)C、SiO2
(3)6Fe2++Cr2O72-+14H+ 6Fe3++2Cr3++7H2O
考点二 物质的分离与提纯
4.根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液,溶液变成血红色
Fe(NO3)2已变质
B
将含有SO2的废气通入BaCl2溶液中,出现白色沉淀
SO2与BaCl2溶液反应生成BaSO3沉淀
C
在含有少量Fe2+的CuSO4溶液中:先加足量H2O2,再加Cu(OH)2调溶液pH=4,搅拌一段时间后过滤
可除去CuSO4溶液中的Fe2+
D
向Na2SiO3溶液中滴加几滴酚酞,然后逐滴加入稀盐酸至红色褪去,试管中出现凝胶
非金属性:Cl>Si
答案 C
5.水合肼(N2H4·H2O)为无色透明的油状发烟液体,是一种重要的精细化工原料,其制备的反应原理为:NaClO+2NH3 N2H4·H2O+NaCl。下列关于实验室制备水合肼的操作不正确的是( )
A.装置甲中试剂X可以选择生石灰
B.装置乙作为反应过程中的安全瓶
C.装置丙制备水合肼时氨气从b口进入
D.装置丁可用于吸收多余的尾气
答案 C
6.下列有关实验装置进行的相应实验,能达到实验目的的是( )
A.利用图1所示装置制取少量NH3
B.利用图2所示装置制备Fe(OH)3胶体
C.利用图3所示装置收集HCl
D.利用图4所示装置检验是否生成乙烯
答案 A
综合篇知能转换
【综合集训】
1.(2019苏州期末,5)下列有关实验装置正确且能达到实验目的的是( )
A.用图1所示装置制取少量乙酸乙酯
B.用图2所示装置验证SO2的漂白性
C.用图3所示装置配制100 mL 0.100 mol·L-1的硫酸溶液
D.用图4所示装置分离水和溴苯
答案 D
2.(2018南京、盐城一模,4)一种从含Br-废水中提取Br2的过程包括过滤、氧化、正十二烷萃取及蒸馏等步骤。已知:
Br2
CCl4
正十二烷
密度/g·cm-3
3.119
1.595
0.753
沸点/℃
58.76
76.8
215~217
下列说法正确的是( )
A.用甲装置过滤时,需不断搅拌
B.用乙装置将Br-氧化为Br2
C.丙装置中用正十二烷而不用CCl4,是因为正十二烷密度小
D.可用装置丁进行蒸馏,先收集正十二烷再收集Br2
答案 B
3.[2020届盐城中学学情测试一,21(2)(3)]FeC2O4·2H2O(草酸亚铁)是淡黄色结晶性粉末,难溶于水,在碱性或中性溶液中不稳定。它广泛应用于新型电池材料、感光材料等。一种用钛白副产物硫酸亚铁[含TiOSO4、Al2(SO4)3、MnSO4及重金属盐]制取电池级草酸亚铁的实验步骤如下:
步骤1:将固体钛白副产物硫酸亚铁溶于水,搅拌,加热至95 ℃,并加入还原铁粉
步骤2:维持pH为4~5,静置6 h、过滤,得纯净的FeSO4溶液
步骤3:在搅拌条件下,控制温度约40 ℃,加入氨水沉铁
步骤4:将草酸溶液滴入氢氧化亚铁悬浊液中,并用硫酸调节pH约为2
步骤5:过滤、洗涤、烘干
(2)步骤3控制的温度不宜过高,其原因是
。
(3)步骤5洗涤时,检验洗涤是否完全的方法是
。
答案 (2)温度过高会导致氨水挥发、生成的Fe(OH)2分解和氧化
(3)取少量最后一次的洗涤过滤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤完全
应用篇知行合一
【应用集训】
1.(2020届扬州中学开学测试,4)下列实验装置与描述正确的是( )
A.装置①:用于吸收HCl气体
B.装置②:用于除去CO2中的HCl
C.装置③:配制1 mol·L-1 NaCl溶液时的定容操作
D.装置④:滴有淀粉碘化钾溶液的纸蝴蝶变蓝
答案 D
2.(2019苏南苏北五校联考二,12)下列根据实验操作和现象所得出的结论正确的是( )
选项
实验操作
实验现象
结论
A
用铂丝蘸取少量某无色溶液进行焰色反应
火焰呈黄色
该溶液一定是钠盐溶液
B
向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X
加热后未出现砖红色沉淀
X中一定不含醛基
C
将FeSO4加强热,得红色固体,产生的气体通入BaCl2溶液
产生白色沉淀
白色沉淀为BaSO4
D
在漂白粉中滴入70%的硫酸
产生黄绿色气体
说明硫酸具有氧化性
答案 C
3.[2020届盐城中学学情测试,22(2)]硫的化合物在生产生活中有广泛应用。
(2)工业上常利用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3。KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.126 0 g成品溶于水并加入淀粉作指示剂,再用0.010 00 mol·L-1 KIO3酸性标准溶液滴定至终点,消耗KIO3溶液31.25 mL。
①滴定终点观察到的现象为 。
②成品中Na2SO3的质量分数是 。
答案 (2)①加入最后一滴KIO3标准溶液时,溶液由无色变为蓝色,且30 s内不变色 ②93.75%
4.[2019泰州中学、宜兴中学联考,20(2)(3)]含重金属离子(如铬、锰、铅等)废水的常见处理方法有化学还原法、化学氧化法、吸附法等。
(2)化学氧化法除Mn2+。
①相同条件下,按Ⅰ、Ⅱ两种方案氧化除去水样中Mn2+,测定不同pH、相同反应时间的c(Mn2+),结果如图1所示,产生该差异的可能原因是 。
②氧化实验中除Mn2+的最佳条件为 。
图1
(3)石墨烯吸附法除Pb2+。不同的pH会使石墨烯吸附剂表面带上不同的电荷,图2为pH对Pb2+吸附率的影响,其原因是
。
图2
答案 (2)①MnO2对Mn2+的氧化有催化作用
②MnO2作催化剂,pH控制在9左右
(3)随pH增大,吸附剂表面吸附的OH-越多,带负电荷越多,越有利于吸附带正电荷的Pb2+
【五年高考】
考点一 物质的检验
1.(2018江苏单科,12,4分)根据下列实验操作和现象所得出的结论正确的是( )
选项
实验操作和现象
结论
A
向苯酚浊液中滴加Na2CO3溶液,浊液变清
苯酚的酸性强于H2CO3的酸性
B
向碘水中加入等体积CCl4 ,振荡后静置,上层接近无色,下层显紫红色
I2在CCl4 中的溶解度大于在水中的溶解度
C
向CuSO4溶液中加入铁粉,有红色固体析出
Fe2+的氧化性强于Cu2+的氧化性
D
向NaCl、NaI 的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成
Ksp(AgCl)>Ksp(AgI)
答案 B
2.(2017江苏单科,13,4分)根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
实验结论
A
向苯酚溶液中滴加少量浓溴水、振荡,无白色沉淀
苯酚浓度小
B
向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解
部分Na2SO3被氧化
C
向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液,未出现银镜
蔗糖未水解
D
向某黄色溶液中加入淀粉KI溶液,溶液呈蓝色
溶液中含Br2
答案 B
3.(2015江苏单科,13,4分)下列设计的实验方案能达到实验目的的是( )
A.制备Al(OH)3悬浊液:向1 mol·L-1 AlCl3溶液中加过量的6 mol·L-1 NaOH溶液
B.提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入适量饱和Na2CO3溶液,振荡后静置分液,并除去有机相的水
C.检验溶液中是否含有Fe2+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象
D.探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2 mL 5% H2O2和1 mL H2O,向另一支试管中加入2 mL 5% H2O2和1 mL FeCl3溶液,观察并比较实验现象
答案 BD
4.(2019课标Ⅱ,26,13分)立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为 (填标号)。
A.黄色 B.红色 C.紫色 D.绿色
(2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:
①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为 。
回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为 。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的 (填化学式)。
③沉淀器中反应的离子方程式为 。
(3)成品中S2-的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.100 0 mol·L-1的I2-KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉为指示剂,过量的I2用0.100 0 mol·L-1 Na2S2O3溶液滴定,反应式为I2+2S2O32- 2I-+S4O62-。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为 ,样品中S2-的含量为 (写出表达式)。
答案 (1)D
(2)①BaSO4+4C BaS+4CO↑ CO+H2O CO2+H2 ②BaCO3 ③S2-+Ba2++Zn2++SO42- BaSO4·ZnS↓
(3)浅蓝色至无色 (25.00-12V)×0.100 0×32m×1 000×100%
考点二 物质的分离与提纯
5.(2019课标Ⅲ,10,6分)离子交换法净化水过程如图所示。下列说法中错误的是( )
A.经过阳离子交换树脂后,水中阳离子的总数不变
B.水中的NO3-、SO42-、Cl-通过阴离子树脂后被除去
C.通过净化处理后,水的导电性降低
D.阴离子树脂填充段存在反应H++OH-H2O
答案 A
6.[2016江苏单科,19(3)(4),9分]实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:
(3)用下图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。
①实验装置图中仪器A的名称为 。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂, 、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,
,过滤、用水洗涤固体2~3次,在50 ℃下干燥,得到MgCO3·3H2O。[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
答案 (3)①分液漏斗 ②充分振荡(每空2分)
(4)至5Cl2
C
向碳酸钠溶液中加入浓盐酸,将产生的气体通入苯酚钠溶液中,溶液变浑浊
酸性:盐酸>碳酸>苯酚
D
将石蜡油蒸汽通过炽热的碎瓷片分解,得到的气体通入溴的四氯化碳溶液,溴的四氯化碳溶液褪色
分解产物中含乙烯
答案 AB
2.(2020届连云港新海中学开学测试,5)下列实验操作正确的是( )
A.用装置甲吸收SO2
B.用装置乙制取无水MgCl2
C.将25.0 g CuSO4·5H2O溶于100 mL蒸馏水,配得1.0 mol·L-1硫酸铜溶液
D.进行焰色反应时,在蘸取待测液前,先用稀硫酸洗净铂丝并灼烧至无色
答案 B
3.(2020届南通栟茶中学学情监测一,6)下列有关说法正确的是( )
A.二氧化硫能使溴水褪色,说明二氧化硫具有漂白性
B.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+、无K+
C.向Na2O2与水完全反应后的溶液中加MnO2,产生O2,是由于该溶液中含H2O2
D.提纯混有少量硝酸钾的氯化钠,应在较高温度下制得浓溶液再冷却结晶、过滤、干燥
答案 C
4.(2020届南通海门中学质检一,13)下列实验操作、现象与结论对应关系正确的是( )
选项
操作
现象
结论
A
向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液
溶液变黄色
氧化性:H2O2>Fe3+
B
向淀粉溶液中加入少量稀硫酸,加热,加入氢氧化钠调节至碱性,再加入银氨溶液,水浴加热
产生银镜
淀粉发生水解
C
向久置的Na2O2粉末中滴加盐酸
产生无色气体
该气体为O2
D
向Na2CO3和NaHCO3溶液中各滴加1滴酚酞
溶液均变红,前者红色更深
结合H+的能力:CO32->HCO3-
答案 B
5.(2019南京调研,12)根据下列实验操作和现象所得出的结论正确的是( )
选项
实验操作和现象
结论
A
用洁净的铂丝蘸取少量某无色溶液进行焰色反应,火焰呈黄色
该溶液一定是钠盐溶液
B
用饱和Na2CO3溶液充分浸泡BaSO4粉末,过滤后向所得固体中加入足量的盐酸,固体部分溶解
Ksp(BaCO3)<
Ksp(BaSO4)
C
向某黄色溶液中加入淀粉KI溶液,溶液变蓝色
黄色溶液中含有Fe3+
D
室温下,向0.1 mol·L-1 NaHC2O4溶液中滴加石蕊试液,溶液变红色
HC2O4-电离程度大于其水解程度
答案 D
6
答案B
7.江苏七市二模,12)根据下列实验操作和现象所得出的结论正确的是( )
答案 A
8.(2019宿迁期末,13)下列根据实验操作和现象所得出的结论正确的是( )
选项
实验操作与现象
结论
A
将SO2气体通入酸性高锰酸钾溶液,高锰酸钾溶液褪色
SO2具有漂白性
B
常温下,测定等浓度的Na2CO3和Na2SO3的溶液的pH,前者pH比后者大
证明非金属性:
S>C
C
向盛有5 mL AgNO3溶液的试管中滴入几滴等浓度的NaCl溶液,产生白色沉淀,继续滴加几滴NaI溶液有黄色沉淀产生
Ksp(AgCl)>
Ksp(AgI)
D
向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解
部分Na2SO3被氧化
答案 D
9.(2019无锡期中,12)根据下列实验操作和现象所得出的结论正确的是( )
选项
实验操作和现象
结论
A
相同条件下,分别测量0.1 mol·L-1和0.01 mol·L-1的醋酸溶液的导电性,前者的导电性强
醋酸浓度越大,电离程度越大
B
向苯酚浊液中滴加Na2CO3溶液,浊液变清
酸性:苯酚>碳酸
C
向KNO3和KOH的混合溶液中加入铝粉并加热,试管口放湿润的红色石蕊试纸,试纸变为蓝色
NO3-被还原为NH3
D
用蘸有浓氨水的玻璃棒靠近某有色气体X,玻璃棒周围产生白烟
气体X可能是氯气
答案 CD
10.(2018盐城期中,4)下列制取Cl2,用Cl2氧化废液中的I-,回收并提纯I2的装置和原理能达到实验目的的是( )
答案 D
二、非选择题(共50分)
11.[2020届南师附中阶段测试一,18(1)(2)](5分)用硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为原料通过下列流程可以制备晶体A。
浅绿色
悬浊液黄色沉淀… 晶体A
请回答下列问题:
(1)写出步骤Ⅰ生成黄色沉淀(FeC2O4·2H2O)的化学方程式: 。
(2)步骤Ⅱ水浴加热需控制40 ℃的理由是 。
答案 (1)(NH4)2SO4·FeSO4·6H2O+H2C2O4 FeC2O4·2H2O↓+(NH4)2SO4+H2SO4+4H2O
(2)温度太高,H2O2分解;温度太低,Fe2+氧化速度太慢
12.[2020届连云港新海中学学情检测二,19(3)(4)](5分)实验室以菱镁矿(主要成分为MgCO3,含少量的CaO、SiO2、Al2O3、Fe2O3)为原料生产高纯MgO,其主要实验流程如下:
(3)灼烧Ⅱ所用装置如图所示,仪器A的名称是 。为提高MgO的纯度,需充分灼烧,通过“称量”确定灼烧已经完全的方法是 。
(4)将用NH4Cl浸出所得溶液直接蒸干灼烧也能制得MgO,该方法的缺点是 。
答案 (3)坩埚 连续两次灼烧后称得(坩埚和固体的)质量相同(或相差不超过0.1 g) (4)直接灼烧生成的NH3和HCl污染环境、生成MgO纯度不高、能耗更高
13.[2020届南通通州学情调研一,18(1)(2)](6分)KMnO4是实验室常用的氧化剂,可用作水处理剂、化学定量测定等。
(1)实验室用MnO2等作原料制取少量KMnO4的实验流程如下:
①“熔融”时,不能使用陶瓷坩埚的原因是(用化学方程式表示) 。
②“K2MnO4歧化”的离子方程式为
。
(2)KMnO4氧化甘油(C3H8O3)时,生成MnO2黑色沉淀并产生CO2气体,则发生反应的n(KMnO4)∶n(C3H8O3)= 。
答案 (1)①SiO2+2KOH K2SiO3+H2O ②3MnO42-+4CH3COOH 2MnO4-+MnO2↓+4CH3COO-+2H2O
(2)14∶3
14.[2020届扬州中学开学测试,16(2)②③(3)](8分)由次氯酸钠碱性废水(含有杂质Ca2+)处理硫酸工业尾气的流程如下:
(2)控制合适的条件有利于提高SO2的吸收率(脱硫率)。
②提高脱硫率的可行措施有 (填序号)。
a.加快通入尾气的速率
b.吸收塔中喷淋的碱液与气体逆向接触
c.提高碱液pH
③温度控制在40~60 ℃之间,脱硫率较高,原因是
。
(3)脱硫完成后过滤。
①滤渣的主要成分为 (填化学式)。
②滤液中含有较多的Na2SO4和NaCl,需实现两者分离。其中得到高纯度Na2SO4·10H2O晶体的方法是 ,过滤,冰水洗涤,重结晶。
答案 (2)②bc ③温度过低,反应速率慢;温度过高,NaClO不稳定、易分解(或温度过高SO2溶解度减小)
(3)①CaSO4(或CaSO4·2H2O) ②30 ℃左右加热浓缩,冰水冷却结晶
15.[2019南京、盐城一模,19(1)(3)](4分)以SO2、软锰矿(主要成分为MnO2,含少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4溶液和Mn3O4,主要实验步骤如下:
步骤Ⅰ:如上图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2 MnSO4)。
步骤Ⅱ:充分反应后,在不断搅拌下依次向三口烧瓶中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S来沉铅等重金属。
步骤Ⅲ:过滤得MnSO4溶液。
(1)装置A用于制取SO2,反应的化学方程式为 。
(3)装置C的作用是 。
答案 (1)Na2SO3+H2SO4 Na2SO4+SO2↑+H2O
(3)吸收未反应的SO2
16.[2019江苏四校调研,19(2)](6分)NiSO4·7H2O大量用于电镀和催化剂。以含Ni2+、Co2+的混合液,NaClO溶液,Na2CO3溶液等为原料可制NiSO4·7H2O并回收Co,其实验流程如下:
已知:温度高于80 ℃,Ni2+大量水解,生成Ni(OH)2胶体。
(2)金属镍法也可制备NiSO4·7H2O:在反应器中加入水和硫酸,然后加入金属镍,并分数次加入稀硝酸进行反应,再经过一系列操作得到NiSO4·7H2O。写出上述反应的化学方程式: 。如果Ni、H2SO4、HNO3都比较纯净,则制得的NiSO4·7H2O中可能存在的杂质是 (填化学式),除去这种杂质的实验操作是 。
答案 (2)3Ni+3H2SO4+2HNO3 3NiSO4+2NO↑+4H2O Ni(NO3)2 重结晶
17.[2019徐州、淮安、连云港调研,19(1)(2)](6分)实验室用红土镍矿(主要成分为NiS、FeS、CaS和SiO2等)为原料制备NiSO4·6H2O的流程如下:
已知:①CaF2难溶于水,NiSO4易溶于水,不溶于乙醇;②Ni溶于稀H2SO4。
(1)“煅烧”的目的是 。
(2)“煅烧”得到的Ni2O3有强氧化性,“酸浸”时有气体产生且镍被还原为Ni2+,则产生的气体为 (填化学式),浸出渣的主要成分为 (填化学式)。
答案 (1)除去硫元素 (2)O2 SiO2
18.[2019苏州期末,16(1)(2)](6分)以软锰矿(主要成分为MnO2、SiO2等)为原料制备高纯MnO2的流程如下:
(1)酸浸时,通常加入FeSO4作催化剂加快反应速率。
①为提高酸浸速率,还可以采取的措施有 (写一种)。
②滤渣中含大量硫单质,酸浸时主要反应的化学方程式为
。
(2)证明除铁后所得溶液中不含铁元素的实验方法是
。
答案 (1)①提高酸浸温度(或将矿石粉碎)
②ZnS+MnO2+2H2SO4 ZnSO4+MnSO4+S+2H2O
(2)取少量溶液,加入KSCN溶液,再滴入少量氯水,若溶液不变血红色,则溶液中不含铁元素
19.[2019江苏三校联考,18(1)(2)](4分)三草酸合铁酸钾晶体可用于晒制蓝图,化学式为K3[Fe(C2O4)3]·3H2O,摩尔质量为491 g·mol-1。实验室以硫酸亚铁为原料制备三草酸合铁酸钾晶体的过程如下图:
FeSO4(aq)FeC2O4·2H2O(s)
K3[Fe(C2O4)3]·3H2O(s)
请回答下列问题:
(1)写出FeSO4溶液中析出FeC2O4·2H2O的化学方程式: 。
(2)由FeC2O4·2H2O转化为K3[Fe(C2O4)3]·3H2O时加入H2C2O4的目的是 。
答案 (1)FeSO4+H2C2O4+2H2O FeC2O4·2H2O↓+H2SO4
(2)抑制Fe3+水解生成Fe(OH)3沉淀