- 3.01 MB
- 2021-05-22 发布
专题一 物质的组成、性质和分类
思考
:
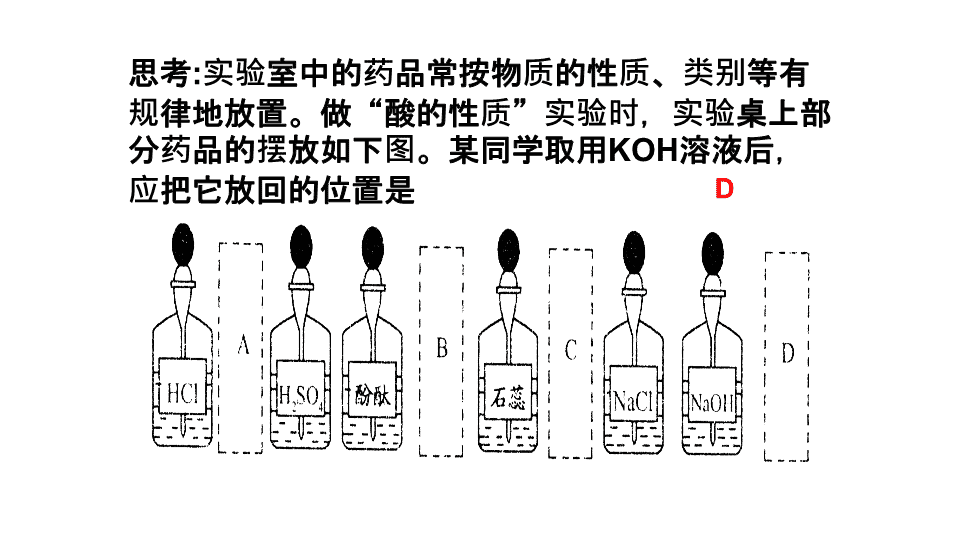
实验室中的药品常按物质的性质、类别等有规律地放置。做“酸的性质”实验时,实验桌上部分药品的摆放如下图。某同学取用
KOH
溶液后,应把它放回的位置是 ( )
D
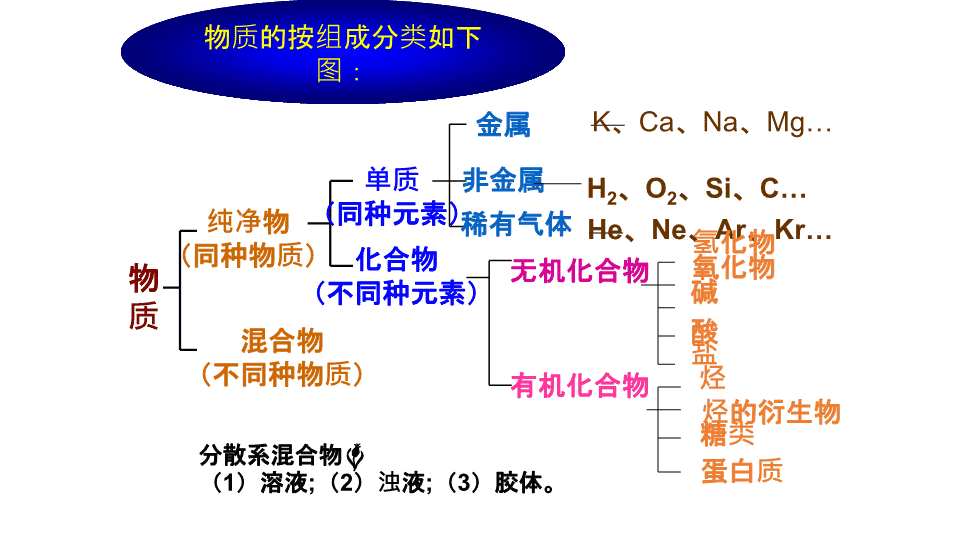
物质的按组成分类如下图:
物质
纯净物
(同种物质)
混合物
(不同种物质)
单质
(同种元素)
化合物
(不同种元素)
金属
非金属
稀有气体
K
、
Ca
、
Na
、
Mg…
H
2
、
O
2
、
Si
、
C…
He
、
Ne
、
Ar
、
Kr…
无机化合物
有机化合物
氢化物
氧化物
碱
酸
盐
烃
烃的衍生物
糖类
蛋白质
分散系混合物
(
1
)溶液
;
(
2
)浊液
;
(
3
)胶体。
物质分类法的应用
【
例
2】
物质分类的依据通常有组成和性质,下列物质分类中,只考虑组成的是
( )
A.Na
2
SO
4
是钠盐、硫酸盐、正盐
B.HNO
3
是一元酸、强酸、挥发性酸
C.Mg(OH)
2
是二元碱、难溶性碱、中强碱
D.Al
2
O
3
是两性氧化物、金属氧化物、最高价氧化物
A
1.
分类的标准及原则
必须按同一标准进行,分类的子项应当互不相
容,各子项必须是全异关系,各子项之和必须等于母项。
2.
物质类别的判断
判断物质的类别,主要看物质的组成元素和该物质中粒子的相互作用。
(
1
)根据有无固定的组成可判断是纯净物还是混合物,再根据是由几种元素形成的该物质,来判断是单质还是化合物。
(
2
)对于单质,根据结构和性质可判断是否是同素异形体。
(
3
)对于化合物可根据化学键来判断:①若含有离子键,则一定是离子化合物,如
NaCl
、
NH
4
Cl
、
Na
2
SO
4
;②
若全以共价键形成,则是共价化合物,如
CO
、
SiO
2
、
HNO
3
。
(
4
)对于化合物可根据组成元素(是否含碳)分为无机化合物和有机化合物:①无机化合物根据组成又可分为氧化物、氢化物、酸、碱、盐,它们可由原子组成,也可由分子或离子组成;②有机物根据官能团和性质可分为烃、烃的衍生物(卤代烃、醇、酚、醛、羧酸、酯)、高分子化合物等,有机物大部分由分子组成。
3.
概念辨析
(
1
)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如
Mn
2
O
7
为酸性氧化物、
Al
2
O
3
为两性氧化物、
Na
2
O
2
为过氧化物)。
(
2
)酸性氧化物不一定是非金属氧化物(如
Mn
2
O
7
);非金属氧化物也不一定是酸性氧化物
(如
CO
、
NO
)。
(
3
)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱(如
SiO
2
、
MgO
)。
2.
对于数以千万计的化学物质和为数更多的化学反
应,分类法的作用几乎是无可替代的。
(
1
)现有下列六种物质:
SO
2
、
SiO
2
、
CaO
、
MgO
、
Fe
2
O
3
、
Na
2
O
2
,
按照不同的分类标准,它
们中有一种物质与其他五种有明显的不同,请找
出这种物质,并写出分类的依据(至少要写出两
种分类方法)。
①
;
②
。
(
2
)从反应中有无离子参加,可以将化学反应分为离子反应和非离子反应。
Na
2
O
2
与水反应的离子方程式是
。
①SO
2
,
常温常压下是气体,其余为固体
②Na
2
O
2
,
是过氧化物,其余为酸性氧化物或碱性氧化物
2Na
2
O
2
+2H
2
O = 4Na
+
+4OH
-
+O
2
↑
从反应中
,可以将化学反应分为氧化还原反应和非氧化还原反应,从上述物质中分别找出两种能相互反应的物质,各写一个非氧化还原反应的方程式和氧化还原反应的方程式:
、
。
(
3
)虽然分类的方法不同,但离子反应和氧化还原反应之间也存在着一定的关系,请用简单的图示方法表示二者之间的关系。
有无电子转移
CaO+SiO
2
=
CaSiO
3
Na
2
O
2
+SO
2
=Na
2
SO
4
了解具体
,
推广一类
,
知道一般
,
注意特殊
.
例
:
碱式碳酸铜可表示为:
xCuCO
3
·
yCu(OH)
2
·
zH
2
O,
测定碱式碳酸铜组成的方法有多种。
(
1
)现采用氢气还原法,请回答如下问题:
①
写出
xCuCO
3
·
yCu(OH)
2
·
zH
2
O
与氢气反应的化学方程式
;
2.
比较法是化学中研究物质性质的基本方法之一,
请运用比较法解答下题。
Na
2
O
2
几乎可与所有的常见气态非金属氧化物反
应。如
2Na
2
O
2
+2CO
2
2Na
2
CO
3
+O
2
,Na
2
O
2
+
CO Na
2
CO
3
。
(
1
)试分别写出
Na
2
O
2
与
SO
2
、
SO
3
反应的化学方
程式:
。
(
2
)通过比较可知,当非金属元素处于
价
时,其氧化物与
Na
2
O
2
反应有
O
2
生成。
(
3
)依上述规律,写出
Na
2
O
2
分别与
N
2
O
5
、
Mn
2
O
7
反应的化学方程式
,
。
根据陈述的知识,类推得出的结论正确的是
A
.镁条在空气中燃烧生成的氧化物是
MgO
,则钠在空气中燃烧生成的氧化物是
Na
2
O
B
.乙烯可使酸性高锰酸钾溶液褪色,则丙烯也可以使其褪色
C
.
CO
2
和
SiO
2
化学式相似,则
CO
2
与
SiO
2
都能与水反应生成酸
D
.氯气与水反应有次氯酸生成,氟气与水有次氟酸生成
下列对有机物结构或性质的描述,错误的是
A
.一定条件下,
Cl
2
可在甲苯的苯环或侧链上发生取代反应
B
.苯酚钠溶液中通入
CO
2
生成苯酚,则碳酸的酸性比苯酚弱
C
.乙烷和丙烯的物质的量各
1mol
,完成燃烧生成
3molH
2
O
D
.光照下
2
,
2—
二甲基丙烷与
Br
2
反应其一溴取代物只有一种
B
下图表示从固体混合物中分离
X
的
2
种方案,请回答有关问题。
(
1
)选用方案
I
时,
X
应该具有的性质是
,残留物应该具有的性质是
;
(
2
)选用方案
Ⅱ
从某金属粉末(含有
Au
、
Ag
和
Cu
)中分离
Au
,加入的试剂是
,有关反应的化学方程式为
;
(
3
)为提纯某
Fe
2
O
3
样品(主要杂质有
SiO
2
、
A1
2
O
3
),参照方案
I
和
Ⅱ
,请设计一种以框图形式表示的实验方案(注明物质和操作)
。
有挥发性(或易升华)
受热不挥发,且具有较高的热稳定性
HNO
3
物质的分类
思考
P1
知识点
1
1)
物质是否有固定的熔、沸点是区别纯净物和混合物的重要标志。如玻璃无固定的熔点,石油无固定的沸点,两者均为混合物。
(2)
常见的混合物:溶液、悬浊液、乳浊液、胶体、高分子材料、漂白粉(漂粉精)、铝热剂、天然油脂、碱石灰、福尔马林、王水、同素异形体组成的物质(如红磷和白磷)等。
(3)
易分析错的纯净物:
HD
、结晶水合物(如
CuSO
4
·5H
2
O
)、
Na
35
Cl
、
Na
37
Cl
按天然比例混在一起。
按结构分
由离子组成
由原子组成的分子
由分子组成
直接由原子组成
含极性共价键构成的离子化合物
含非极性共价键构成的离子化合物
含非极性共价键构成的化合物
练习
:
下列物质有固定熔沸点的是
( )
⑴
、煤 ⑵、石油 ⑶、苯 ⑷、汽油
⑸、煤油 ⑹、
98%
的浓硫酸 ⑺、玻璃
⑻、液氯 ⑼、氯水 ⑽、水银 ⑾、漂白粉 ⑿、金刚石 ⒀、福尔马林溶液
⒁、冰水混合物 ⒂含氧
40%
的氧化镁 ⒃、混甘油酯 ⒄、铝热剂 ⒅、密封保存的
NO
2
气体 ⒆、
TNT
⑶
⑻
⑽
⑿
⒁
⒂
⒃
⒆
变式
2
将下列各组物质按酸、碱、盐分类顺序排列,正确的是( )
A
.
硫酸 纯碱 石膏
B
.
亚硫酸 烧碱 绿矾
C
.
油酸 乙醇 碳化钙
D
.
苯酚 熟石灰 苛性钾
解析
纯碱不是碱,组成为
Na
2
CO
3
,属于盐类,
A
错。乙醇不属于碱,为有机物的醇类;碳化钙不属于盐,
C
错。苯酚属于有机物的酚类;苛性钾成分是
KOH
,属于碱类,
D
错。故选
B
。
B
3.
某合作学习小组讨论辨析以下说法:
①粗盐和酸雨都是混合物;
②沼气和水煤气都是可再生能源;
③冰和干冰既是纯净物又是化合物;
④不锈钢和目前流通的硬币都是合金;
⑤盐酸和食醋既是化合物又是酸;
⑥纯碱和熟石灰都是碱;
⑦豆浆和雾都是胶体。
上述说法正确的是
( )
A.
①②③④
B.
①②⑤⑥
C.
③⑤⑥⑦
D.
①③④⑦
D
随堂演练
阅读
:
P1
归纳提升
注意
:
1.
氧化物
:
①
酸性氧化物不一定是非金属氧化物
;
非金属氧化物不一定是酸性氧化物
.
②
碱性氧化物一定是金属氧化物
,
但金属氧化物不一定是碱性氧化物
.
2.
易错点
P1
物质的组成
物质的组成与粒子组成元素的分析
下列观点
错误
的是 ( )
A
.
宏观物质都是由微观粒子构成的。微观粒子的种类和数量不同、彼此的结合方式多样,决定了物质的多样性
B
.
分子是保持物质化学性质的最小粒子,如果分子的组成或结构变了,其化学性质就变了
C
.
构成宏观物质的微观粒子之间存在多种形式的相互作用,如离子键、共价键等等
D
.
储存在物质中的化学能在化学反应前后是不变的
从宏观上看,物质由各种元素组成,元素存在的形态
有游离态和化合态;从微观上看,分子、原子、离子是
构成物质的基本粒子。
例
1
D
要正确判定本题,须明确以下几点:
宏观物质都是由微观粒子构成的;构成物质的微观粒子是多种多样的; 多种多样的微观粒子在构成物质时彼此之间存在相互作用(如离子键、共价键等);
一定种类和数量的微观粒子之间通过相互作用按照特定的方式结合才构成特定的物质;每种物质都有其自身独有的性质是因为每种物质都有其独特的微观组成和结构;
物质一旦发生了化学变化,其微观结构乃至微观组成就改变了,微观粒子之间的相互作用也就改变了;
这种微观组成、结构、粒子间相互作用的方式等的改变决定了化学反应是从环境中吸收能量,还是往环境中释放能量
。
解析
解答本题要联系实际,饮料中至少含有水,水就是一种化学物质。且无论如何纯净的水都存在水的电离,都有
H
+
、
OH
-
;氮、磷不是微量元素;水在各种动植物中都占有相当大的比重,所以没有水就没有生命。
变式
1
下列广告用语在科学性上没有错误的是( )
A
.
这种饮料中不含任何化学物质
B
.
这种蒸馏水绝对纯净,其中不含任何离子
C
.
这种口服液含丰富的氮、磷、锌等微量元素
D
.
没有水就没有生命
解析
D
物质的性质
物质的性质
:
物理性质
:
颜色、状态、密度、质量等表示状态的物理量或性质
化学性质
:
氧化性、还原性、酸碱性等在化学变化过程中才能表示出的性质
,
但
焰色反应为物理性质。
物质的变化
阅读
P2
物质的变化:紧扣两点
练习:
P2
例
2
随堂训练
T2
易错点:
常见的物理变化:蒸(分)馏、金属导电、升华、汽油去油污、液化、熔化、盐析、丁达尔现象、布朗运动、活性炭吸附、胶体吸附、渗析、潮解
化学变化:同素异形体(同分异构体)的转化,风化、干馏、硬化(氢化)、水化、炭化、硫化、变性、电解质溶液导电、硝化、裂化、皂化
考点一 物理变化与化学变化的判断
【
例
1】
下列各组物质发生的变化中,均属于化学
变化的一组是 ( )
A.
少量酒精在空气中挥发不见了;少量酒精在空气
中燃烧后消失
B.
块状生石灰在空气中逐渐变成粉末;晶体碳酸钠
在空气中逐渐变成粉末
C.
木炭燃烧发光、发热;电灯发光、发热
D.
石灰水中通入少量
CO
2
后变浑浊;室温下的饱
和石灰水加热后变浑浊
B
物理变化和化学变化的判断
物质变化中的“三色”、“五解”、“十八化”
物理变化
化学变化
三色
焰色反应
①
颜色反应 ②显色反应
五解
潮解
①
分解②裂解③水解
④电解
十八化
①
熔化②汽化
③液化④酸化
①
氢化②氧化③水化
④风化⑤钝化⑥皂化
⑦炭化⑧催化⑨硫化
⑩酯化 硝化 裂化
卤化 (油酯)硬化
注意
①化学变化中常伴有发光、放热现象,但有发光、放热现象的变化不一定属于化学变化,如金属受热发光。
②化学变化中一定存在化学键的断裂和形成,但存在化学键断裂的变化不一定是化学变化,如
HCl
溶于水、熔融
NaCl
电离等。
③原子的裂变、聚变虽有新物质生成,但它不属于中学化学意义上的化学变化。
下列过程中发生了化学变化的是
( )
A.
红磷加热到
416℃
升华后冷凝得白磷
B.
分馏石油产生汽油
C.
二氧化碳气体变成干冰
D.
氯化钠变成氯离子和钠离子
A
胶体
1.
胶体的制备和性质
(
1
)水解法制备
Fe(OH)
3
胶体:制备过程中发生反应的离子方程式为
。
Fe
3+
+3H
2
O Fe(OH)
3
(胶体)
+3H
+
(
2
)
Fe(OH)
3
胶体区别于
FeCl
3
溶液的本质特征为:
,二者可利用
来区分。
(
3
)
Fe(OH)
3
胶体较稳定的主要原因是
。如果要使其发生凝聚常用的方法有:
①
,②
,③
。
分散质粒子直径大小
丁达尔效应
Fe(OH)
3
胶体粒子带正电荷
加热
搅拌
加电解质溶液
△
(
4
)用水解法制备的
Fe(OH)
3
胶体中含有
Fe
3+
、
Cl
-
,
可用
进行提纯。
渗析
2.
胶体的应用及解释
(
1
)土壤保肥
(
2
)含
Fe
2+
、
Al
3+
的盐净水
(
3
)入海口三角洲形成
(
4
)工业电泳除尘
(
5
)血液透析原理
胶体
阅读
P2
注意易错点
P2
随堂训练
T4
1.
我国科学家在世界上第一次为一种名为“钴酞菁”的
分子
(
直径为
1.3×10
-9
m)
恢复了磁性。“钴酞菁”
分子结构和性质与人体内的血红素及植物体内的叶
绿素非常相似。下列关于“钴酞菁”分子的说法中正
确的是 ( )
A.
在水中所形成的分散系属悬浊液
B.“
钴酞菁”分子既能透过滤纸,也能透过半透膜
C.
分子直径比
Na
+
小
D.
在水中形成的分散系能产生丁达尔效应
D
2.
下列说法正确的是 ( )
A.
直径介于
1~100 nm
之间的微粒称为胶体
B.
电泳现象可以证明胶体属于电解质
C.
将饱和
FeCl
3
溶液滴入沸水中可以制得胶体
D.
胶体粒子很小,可以透过半透膜
C
1.
胶体分散系比较稳定的原因:在胶体中,分散质粒子不断地进行无规则运动;胶体粒子带电荷,由于电荷的存在使胶粒之间相互排斥,不易聚沉从而使胶体保持相对稳定,这是主要原因。
2.
在胶体分散系中,胶体粒子是带电荷的,不能说胶体带电荷,因为整个胶体是呈电中性的。
3.
电泳现象:证明了胶体粒子是带电荷的。但有些胶体粒子(如淀粉胶体)不带电荷,同时还应注意电泳现象是胶粒定向移动产生的,并没有发生聚沉。
4.
胶粒呈中性的胶体如淀粉胶体,无电泳现象,遇电解质溶液不发生聚沉,若使之聚沉可采用加热法。
5.
有些胶体遇足量强酸或强碱时,先聚沉形成沉淀,后沉淀溶解形成溶液,如
Fe(OH)
3
胶体、
Al(OH)
3
胶体、硅酸胶体。
关于胶体的下列说法中正确的是
。
①制备
Fe(OH)
3
胶体,通常是将
Fe(OH)
3
固体溶于热水中;②当带有相反电荷的胶体粒子相混合时,不会发生聚沉;③电泳现象证明胶体带电,属于电解质溶液;④血液透析原理依据的是胶体的性质; ⑤布朗运动是胶体微粒特有的运动方式,可以据此把胶体和溶液、浊液区别开来;⑥氢氧化铁胶体稳定存在的主要原因是胶粒带正电荷。
④⑥
化学用语
①
分子式:
用元素符号表示分子组成的式子。分子式只适用于由分子组成的物质。如
HCl
、
H
2
等。
②
实验式(最简式):
组成物质最简单的原子个数整数比的化学式。最简式在有机物中应用最多。如
CH
3
是乙烷的最简式,
CH
2
O
是乙酸的最简式。
③
结构式:
表示物质内部结构中各元素原子的排列和结合方式的化学式。原子之间的共用电子对用“
-”
表示。且化合物中所有的共价键都须表示出来。如乙酸的结构式为
O
∥
H─C─C─O─H
H
│
│
H
物质的表示方法
(
1
)物质
的表示方法
④
结构简式:
把连接在相同原子的相同结构累加书写,仅标出官能团的式子,是结构式的简便写法。如丙酸的结构简式:
CH
3
CH
2
COOH
。
*
电子式:
在元素符号周围,用小黑点“
·”(
或“
×”)
等符号表示元素原子或离子最外层电子个数的图式。
*
原子结构示意图:
表示原子核电荷数和核外电子分层排布情况示意图。如氖原子结构示意图:
*
离子符号:
如
Ca
2+
、
OH
-
、
SO
2-
4
等。
考点四 表示物质组成、结构的化学用语
【
例
4】
判断以下化学用语是否正确,并将错误的改正。
a.
次氯酸的电子式:
b.
硫离子结构示意图:
c.
羟基的电子式:
d.CO
2
的摩尔质量为
44
e.
乙烯的结构简式:
CH
2
CH
2
f.
乙酸的分子式:
C
2
H
4
O
2
g.
明矾的化学式:
KAlSO
4
·12H
2
O
h.NH
3
的结构式:
H N H
答案
正确的有
b
、
f
、
h,
其他错误,改正略。
H
1.
五种符号:①元素符号:
H
、
Na
等;②原子符号(又称核素符号)
H
、
Cl
等;③离子符号:
Cl
-
、
Mg
2+
等;④化合价符号
;⑤
原子结构示意图: 如氟原子的结构示意图: 铝离子的结构示意图: 。
2.
五种式子
:①
分子式(又称为化学式)
:CO
2
、
H
2
、
SO
3
等;②最简式(又称为实验式):
CH
2
O
、
CH
等;③电子式:如
K
2
S
的电子式:
K
+
[
S
]
2-
K
+
; H Cl
的电子式
H Cl
;
④结构式:
O C O
、
H—Cl
等;⑤结构简式:
CH
3
CH
2
CH
3
、
CH
3
CH
2
OH
等。
下列化学用语的表达方式中正确的是 ( )①水分子的电子式
H
+
[
O
]
2-
H
+
②CO
2
分子的结构式
O C O
· ·
×
·
×
· ·
·
·
·
·
·
. .
. .
.
×
. .
. .
. .
③
乙炔的实验式
C
2
H
2
④
乙醛的结构简式
CH
3
COH
⑤
乙酸的结构简式
C
2
H
4
O
2
⑥F
-
的结构示意图
A.
只有②⑥
B.
只有③④
C.
只有②③⑥
D.
只有①③⑤
答案
A
例
3
下列化学用语中错误的是
( )
C
A
.
二氧化硅的化学式为
SiO
2
B
.
Br
-
的结构示意图为
C
.
次氯酸的结构式为
H—Cl—O
D
.
一氯甲烷的电子式为
:
H:C:H
:
H
:Cl:
..
2
8
18
8
+
35
点悟
复习中应注意以下电子式表示时的常见错误,避免不必要的失
分。
(1)
漏写未参与成键的电子对。如
N
2
:
, NH
3
: ,
CCl
4
: 等。
(2)
离子错误归并。如
MgCl
2
: ,
Na
2
O
2
: 等。
(3)
错写分子中原子的结合方式。如
HClO
中
H
与
O
相连,应写成 。
(4)
漏写或多加“[ ]”及错写
电荷数等。如
NaCl:
,
HCl:
。
:
H:O:Cl
:
:
:
:
Na
+
:Cl:
-
:
:
:
H
+
[ Cl:]
-
:
×
.
Mg
2+
[ Cl ]
-
2
:
:
:
.
x
Na
2
+
[ O O ]
2-
:
:
:
.
x
:
:
.
x
1.
下列化学名词
(
或化学名称
)
正确的是
( )
A.
三溴笨酚
B.
乙酸乙脂
C.
2-
甲基
-3-
乙基丁烷
D.
石炭酸
解析
A
:苯,
B
:酯,
C
:主链为
4
个碳原子的烷烃的
2
、
3
位上不能拥有乙基。
D
注意名称中的字的正确
(
2
)化学变化的表示法
化学方程式
离子方程式
电离方程式
电极反应式等
练习
.
在做制备氢氧化铁胶体的实验时,有些学生没有按
要求进行,结果没有观察到胶体的性质,请你预测
其现象并分析其原因
:
(
1
)甲同学没有选用饱和氯化铁溶液,而用稀氯
化铁溶液滴入沸水中,结果没有观察到
,
其原因是
。
(
2
)乙同学在实验中没有使用蒸馏水,而是用自
来水,结果会
,原因是
。
(
3
)丙同学往沸水中滴加饱和氯化铁溶液后,长
时间加热,结果
,原因是
。
解析
氯化铁溶于水会发生水解反应即
Fe
3+
+3H
2
O
Fe(OH)
3
+3H
+
。胶体的微粒直径在
10
-9
~
10
-7
m
之间,生成的微粒过小属于溶液,生成的微粒过大则属于浊液。如果加热时间过长,会促进水解向正反应方向进行,导致氢氧化铁胶体聚沉。
答案
(
1
)丁达尔效应 如果氯化铁浓度过小,生成的氢氧化铁少,微粒直径小于
10
-9
m
,不能形成胶体
(
2
)出现浑浊 自来水中含电解质、杂质较多,易使制备的胶体马上发生聚沉
(
3
)出现浑浊 长时间加热能促进
Fe
3+
水解,使水解向正反应方向进行,导致氢氧化铁胶体聚沉
下图是某药物中间体的结构示意图:
(
I
)试回答下列问题:
⑴观察上面的结构式与立体模型,通过对比指出结构式中的“
Et”
表示
;该药物中间体分子的化学式为
。
⑵请你根据结构示意图,推测该化合物所能发生的反应及所需反应条件
。
乙基
C
9
H
12
O
3
与
NaOH
溶液在加热条件下反应
⑶
解决有机分子结构问题的最强有力手段是核磁共振氢谱(
PMR
)。有机化合物分子中有几种化学环境不同的氢原子,在
PMR
中就有几个不同的吸收峰,吸收峰的强度或面积与
H
原子数目成正比。
现有一种芳香族化合物
A
与上述药物中间体互为同分异构体,其模拟的核磁共振氢谱图如上图所示,试写出该化合物的结构简式:
。