- 251.50 KB
- 2021-05-19 发布
www.ks5u.com
微专题强化训练2 常见气体的实验室制法
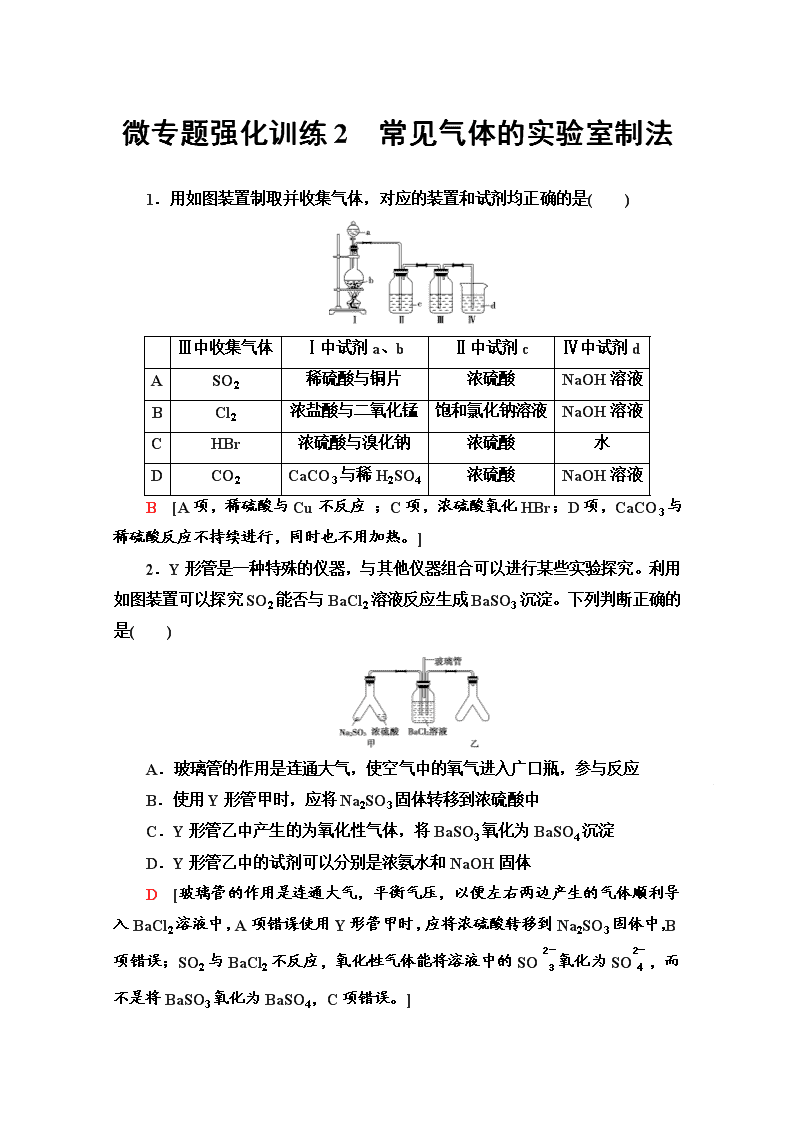
1.用如图装置制取并收集气体,对应的装置和试剂均正确的是( )
Ⅲ中收集气体
Ⅰ中试剂a、b
Ⅱ中试剂c
Ⅳ中试剂d
A
SO2
稀硫酸与铜片
浓硫酸
NaOH溶液
B
Cl2
浓盐酸与二氧化锰
饱和氯化钠溶液
NaOH溶液
C
HBr
浓硫酸与溴化钠
浓硫酸
水
D
CO2
CaCO3与稀H2SO4
浓硫酸
NaOH溶液
B [A项,稀硫酸与Cu不反应 ;C项,浓硫酸氧化HBr;D项,CaCO3与稀硫酸反应不持续进行,同时也不用加热。]
2.Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究SO2能否与BaCl2溶液反应生成BaSO3沉淀。下列判断正确的是( )
A.玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
B.使用Y形管甲时,应将Na2SO3固体转移到浓硫酸中
C.Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
D.Y形管乙中的试剂可以分别是浓氨水和NaOH固体
D [玻璃管的作用是连通大气,平衡气压,以便左右两边产生的气体顺利导入BaCl2溶液中,A项错误;使用Y形管甲时,应将浓硫酸转移到Na2SO3固体中,B项错误;SO2与BaCl2不反应,氧化性气体能将溶液中的SO氧化为SO,而不是将BaSO3氧化为BaSO4,C项错误。]
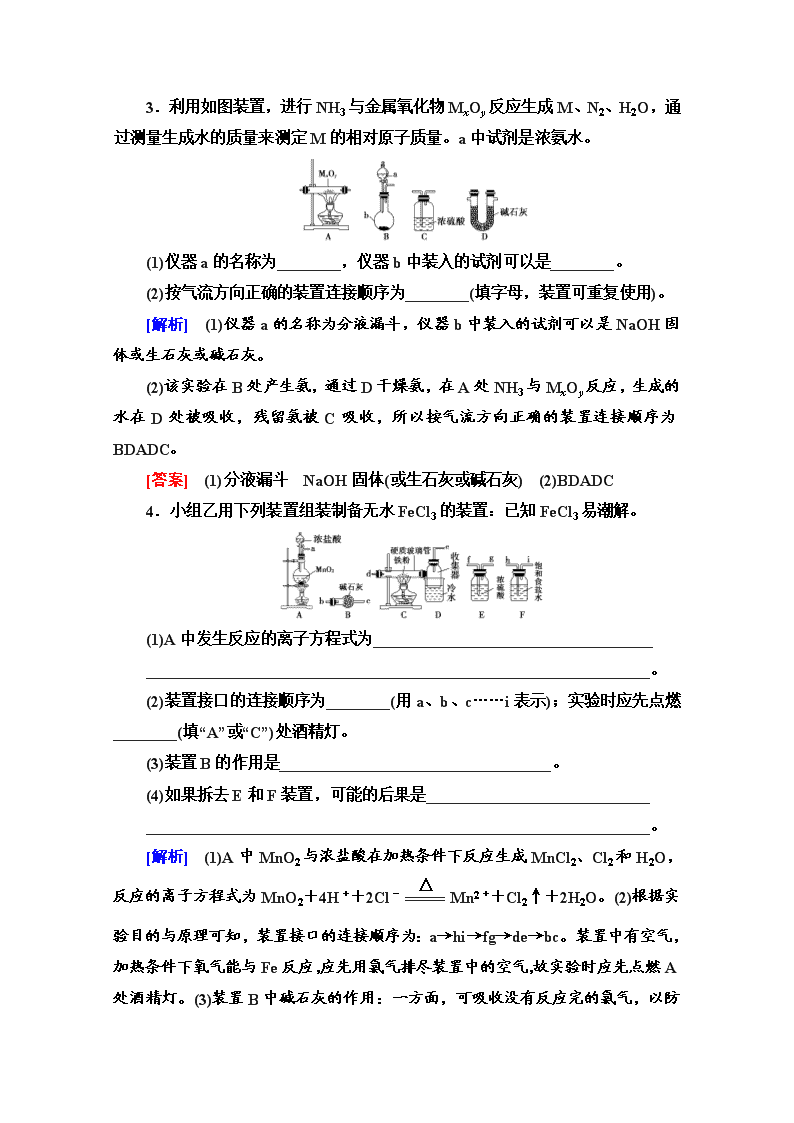
3.利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。
(1)仪器a的名称为________,仪器b中装入的试剂可以是________。
(2)按气流方向正确的装置连接顺序为________(填字母,装置可重复使用)。
[解析] (1)仪器a的名称为分液漏斗,仪器b中装入的试剂可以是NaOH固体或生石灰或碱石灰。
(2)该实验在B处产生氨,通过D干燥氨,在A处NH3与MxOy反应,生成的水在D处被吸收,残留氨被C吸收,所以按气流方向正确的装置连接顺序为BDADC。
[答案] (1)分液漏斗 NaOH固体(或生石灰或碱石灰) (2)BDADC
4.小组乙用下列装置组装制备无水FeCl3的装置:已知FeCl3易潮解。
(1)A中发生反应的离子方程式为___________________________________
_______________________________________________________________。
(2)装置接口的连接顺序为________(用a、b、c……i表示);实验时应先点燃________(填“A”或“C”)处酒精灯。
(3)装置B的作用是__________________________________。
(4)如果拆去E和F装置,可能的后果是____________________________
_______________________________________________________________。
[解析] (1)A中MnO2与浓盐酸在加热条件下反应生成MnCl2、Cl2和H2O,反应的离子方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O。(2)根据实验目的与原理可知,装置接口的连接顺序为:a→hi→fg→de→bc。装置中有空气,加热条件下氧气能与Fe反应,应先用氯气排尽装置中的空气,故实验时应先点燃A处酒精灯。(3)装置B中碱石灰的作用:一方面,可吸收没有反应完的氯气,
以防污染空气;另一方面,可防止空气中的水蒸气进入装置D使生成的FeCl3潮解。(4)如果拆去E和F装置,可能会发生反应Fe+2HCl===FeCl2+H2↑,在C中加热氢气与氯气的混合气体,易发生爆炸。
[答案] (1)MnO2+4H++2Cl-Mn2++Cl2↑+2H2O (2)a→hi→fg→de→bc(c可不写,2分) A
(3)防止反应结束后空气中的水蒸气进入装置D中使无水FeCl3潮解;吸收尾气,防止氯气污染空气
(4)发生反应Fe+2HCl===FeCl2+H2↑,在C中加热氢气与氯气的混合气体,易发生爆炸
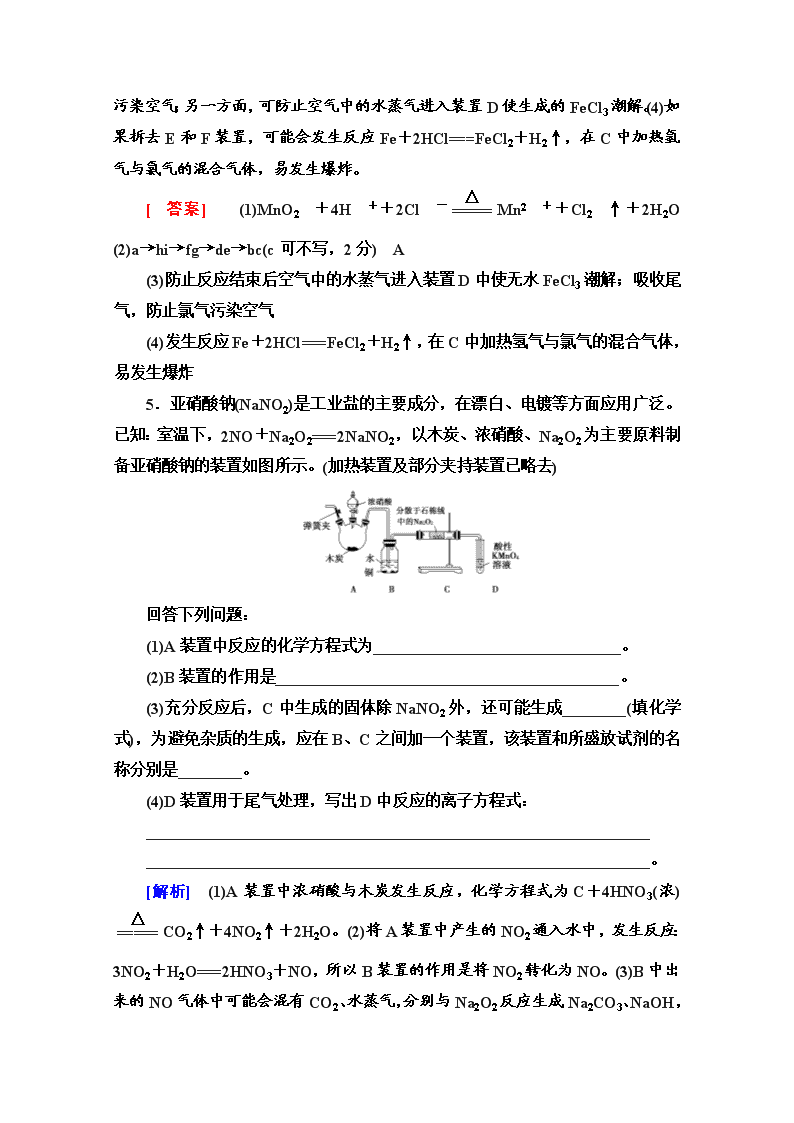
5.亚硝酸钠(NaNO2)是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下,2NO+Na2O2===2NaNO2,以木炭、浓硝酸、Na2O2为主要原料制备亚硝酸钠的装置如图所示。(加热装置及部分夹持装置已略去)
回答下列问题:
(1)A装置中反应的化学方程式为_______________________________。
(2)B装置的作用是___________________________________________。
(3)充分反应后,C中生成的固体除NaNO2外,还可能生成________(填化学式),为避免杂质的生成,应在B、C之间加一个装置,该装置和所盛放试剂的名称分别是________。
(4)D装置用于尾气处理,写出D中反应的离子方程式:
_______________________________________________________________
_______________________________________________________________。
[解析] (1)A装置中浓硝酸与木炭发生反应,化学方程式为C+4HNO3(浓)CO2↑+4NO2↑+2H2O。(2)将A装置中产生的NO2通入水中,发生反应:3NO2+H2O===2HNO3+NO,所以B装置的作用是将NO2转化为NO。(3)B中出来的NO气体中可能会混有CO2、水蒸气,分别与Na2O2反应生成Na2CO3、NaOH,
所以C中生成的固体除NaNO2外,还可能生成Na2CO3、NaOH;为避免杂质的生成,可以在B、C之间加一个干燥管(或U形管),所盛放的试剂应该为碱石灰,用于吸收混合气体中的CO2和水蒸气。(4)D装置中盛放的是酸性KMnO4溶液,用于尾气处理,根据得失电子守恒、原子守恒和电荷守恒可得D装置中反应的离子方程式为5NO+3MnO+4H+===5NO+3Mn2++2H2O。
[答案] (1)C+4HNO3(浓)CO2↑+4NO2↑+2H2O
(2)将NO2转化为NO
(3)Na2CO3、NaOH 干燥管、碱石灰
(4)5NO+3MnO+4H+===5NO+3Mn2++2H2O
6.取m g的产品,用以下装置测定产品中AlN的纯度(夹持装置已略去)。
已知:AlN+NaOH+H2O===NaAlO2+NH3↑
(1)完成以下实验步骤:组装好实验装置,首先_________________,加入实验药品。接下来的实验操作是关闭______________并打开________,再打开分液漏斗活塞加入足量NaOH浓溶液后关闭,至不再产生气体。再______________,通入氮气一段时间,测定装置Ⅲ反应前后的质量变化为n g。
(2)实验结束后,计算产品中AlN的纯度为________%(用含m、n的代数式表示)。
[解析] (1)实验步骤,在装药品之前,要对装置进行检漏。实验开始进行,首先不通入氮气,K1是关闭的,K2是打开的,反应至不再产生气体时,反应停止,需要将所有的氨气通入浓硫酸中被吸收,因此需要通入氮气,打开K1;
(2)根据方程式
AlN~NH3
41 17
m(AlN) n
可得m(AlN)= g,ω=×100%=%。
[答案] (1)检查装置的气密性 K1 K2 打开K1
(2)%或×100%
相关文档
- 2020_2021学年新教材高中数学第四2021-05-19 16:03:1617页
- 2020_2021学年高中历史专题八19世2021-05-19 16:00:394页
- 2019-2020学年同步人教版高中历史2021-05-19 15:59:104页
- 2019届一轮复习通用版版高中地理32021-05-19 15:59:015页
- 精编高中班主任工作计划两篇(三)2021-05-19 15:54:366页
- 2019-2020学年人教版高中生物必修12021-05-19 15:52:0413页
- 2018年《高考领航》高中地理二轮复2021-05-19 15:51:5490页
- 2020秋高中历史专题五一“神圣的中2021-05-19 15:50:2821页
- 2020-2021高中物理 《磁场》专题2021-05-19 15:45:3135页
- 高中教师述职报告(二)2021-05-19 15:44:023页