- 2.39 MB
- 2021-05-13 发布
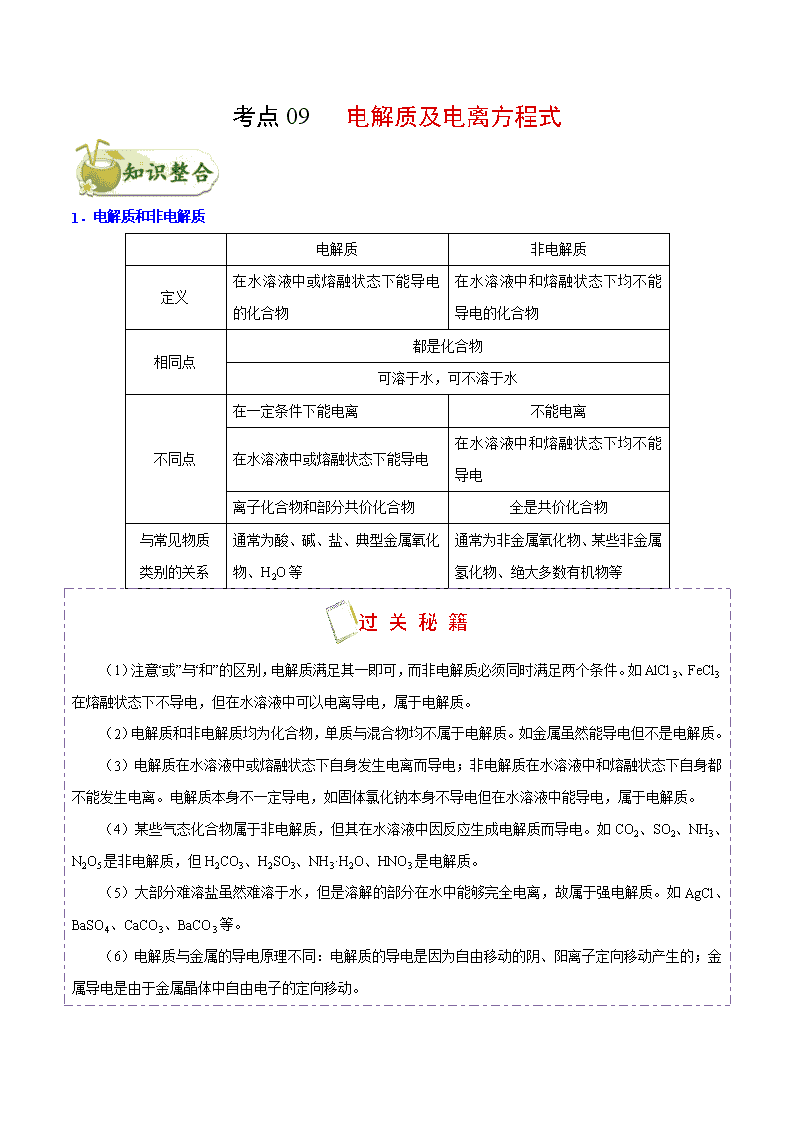
考点 09 电解质及电离方程式
1.电解质和非电解质
电解质 非电解质
定义
在水溶液中或熔融状态下能导电
的化合物
在水溶液中和熔融状态下均不能
导电的化合物
相同点
都是化合物
可溶于水,可不溶于水
不同点
在一定条件下能电离 不能电离
在水溶液中或熔融状态下能导电
在水溶液中和熔融状态下均不能
导电
离子化合物和部分共价化合物 全是共价化合物
与常见物质
类别的关系
通常为酸、碱、盐、典型金属氧化
物、H2O 等
通常为非金属氧化物、某些非金属
氢化物、绝大多数有机物等
过 关 秘 籍
(1)注意“或”与“和”的区别,电解质满足其一即可,而非电解质必须同时满足两个条件。如 AlCl3、FeCl3
在熔融状态下不导电,但在水溶液中可以电离导电,属于电解质。
(2)电解质和非电解质均为化合物,单质与混合物均不属于电解质。如金属虽然能导电但不是电解质。
(3)电解质在水溶液中或熔融状态下自身发生电离而导电;非电解质在水溶液中和熔融状态下自身都
不能发生电离。电解质本身不一定导电,如固体氯化钠本身不导电但在水溶液中能导电,属于电解质。
(4)某些气态化合物属于非电解质,但其在水溶液中因反应生成电解质而导电。如 CO2、SO2、NH3、
N2O5 是非电解质,但 H2CO3、H2SO3、NH3·H2O、HNO3 是电解质。
(5)大部分难溶盐虽然难溶于水,但是溶解的部分在水中能够完全电离,故属于强电解质。如 AgCl、
BaSO4、CaCO3、BaCO3 等。
(6)电解质与金属的导电原理不同:电解质的导电是因为自由移动的阴、阳离子定向移动产生的;金
属导电是由于金属晶体中自由电子的定向移动。
2.强电解质和弱电解质
强电解质 弱电解质
定义
在水溶液中或熔融状态下能完全电离的电
解质
在水溶液中只能部分电离的电解质
溶液中微
粒的存在形式
离子,不存在强电解质分子 离子和弱电解质分子
电离过程 不可逆,不存在电离平衡 可逆,存在电离平衡
电离方程式 用“ ” 用“ ”
举例
强酸:HCl、H2SO4、HNO3、HClO4、HBr、
HI 等
强碱:KOH、NaOH、Ba(OH)2、Ca(OH)2 等
活泼金属氧化物:Na2O、MgO 等
绝大部分盐:BaSO4、BaCl2 等
弱酸:CH3COOH、HCN、H2S、H2CO3 等
弱碱:NH3·H2O、Cu(OH)2 等 H2O 及小部分
盐(CH3COO)2Pb 等]
3.电解质的电离
(1)电离的概念
电解质溶于水或受热熔化时,离解成自由移动的离子的过程称为电离。
注意:电解质溶于水时是由于水分子的作用而电离;熔融时是由于热能破坏化学键而电离成自由移动
的离子,都不是因通电而电离的。
(2)电离方程式
①强电解质:完全电离,用“ ”。
如 H2SO4:H2SO4 2H++ 2
4SO ;
NaOH:NaOH Na++OH−;
(NH4)2SO4:(NH4)2SO4 2 +
4NH + 2
4SO 。
②弱电解质:
a.多元弱酸分步电离,且电离程度逐步减弱,酸性的强弱主要由第一步电离决定。多元弱碱分步电离,
可一步写出。
如 H2S:H2S H++HS− ,HS− H++S2− ;
Cu(OH)2:Cu(OH)2 Cu2++2OH−。
b.两性氢氧化物双向电离。
如 Al(OH)3:H++ 2AlO +H2O Al(OH)3 Al3++3OH−。
酸式电离 碱式电离
③酸式盐的电离:
a.强酸酸式盐完全电离,一步到底。
如 NaHSO4 在水溶液中的电离方程式:NaHSO4 Na++H++ 2
4SO ;NaHSO4 在熔融状态下的电离方程
式:NaHSO4 Na++ 4HSO 。
b.多元弱酸酸式盐,第一步完全电离,第二步酸式酸根离子部分电离。
如 NaHCO3,第一步:NaHCO3 Na++ 3HCO ,第二步: 3HCO H++ 2
3CO 。
考向一 电解质及其强弱的判断
1.电解质、非电解质的判断
(1)电解质和非电解质的前提是化合物,单质既不是电解质,也不是非电解质。
(2)常见的电解质有酸(H2SO4、HCl、CH3COOH 等)、碱[强碱(NaOH、KOH 等)、弱碱(NH3·H2O、氢
氧化镁、氢氧化铜、氢氧化铁等)]、盐(NaCl、BaCO3 等)、活泼金属的氧化物(Na2O、MgO、Al2O3 等)。常
见的非电解质有 NH3、非金属元素形成的酸酐、有机化合物中的烃、醇、醛、酯等。
(3)可通过熔融导电实验证明物质是离子化合物还是共价化合物。离子化合物一定是电解质,而共价
化合物可能是电解质(如 AlCl3),也可能是非电解质(如 SO2、NH3 等)。
2.强电解质、弱电解质的判断
(1)电解质的强弱与物质内部结构有关,与外界因素无关。
(2)电解质的强弱与溶解性无关,如 BaSO4、CaCO3 等虽难溶于水却是强电解质;Pb(CH3COO)2 尽管
能溶于水,却部分电离,是弱电解质。
(3)电解质的强弱与溶液的导电性强弱没有必然联系,溶液导电能力强弱由溶液中自由移动的离子的
浓度决定,也与离子所带电荷数有关,很稀的强电解质溶液导电性较弱,浓度较大的弱电解质溶液的导电
性可能较强。因此,强电解质溶液的导电能力不一定强,弱电解质溶液的导电能力不一定弱。
典例 1 下列说法正确的一组是( )
①不溶于水的盐都是弱电解质 ②可溶于水的盐都是强电解质 ③0.5 mol·L-1 一元酸溶液中 H+浓度为 0.5
mol·L-1 ④强酸溶液中的H+浓度不一定大于弱酸溶液中的H+浓度 ⑤电解质溶液导电的原因是溶液中有自
由移动的阴阳离子 ⑥熔融的电解质都能导电
A.①③⑤⑥ B.只有④⑤ C.②④⑤⑥ D.只有③⑥
【答案】B
【解析】①不溶于水的盐不一定是弱电解质,如 BaSO4 难溶于水,但溶于水的部分全电离,是强电解质,
故①错误;②电解质的强弱与溶解性无关,可溶于水的盐可能是弱电解质,如醋酸铅,故②错误;
③0.5mol·L-1 一元酸溶液 H+浓度不一定为 0.5mol·L-1,如醋酸,故③错误;④强酸溶液中的 H+浓度不一定
大于弱酸溶液中的 H+浓度,H+浓度与酸的浓度、分子中氢离子的个数以及电离程度有关,故④正确;
⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子,故⑤正确;⑥酸在熔融态时均不导电,只有溶
于水时才导电,故⑥错误;正确的有④⑤,故选 B。
【归纳反思】判断物质是是否电解质(或强、弱电解质)的解答思路
1.下列说法中,正确的是
A.三氧化硫的水溶液能导电,所以三氧化硫是电解质
B.自由移动离子数目多的电解质溶液导电能力一定强
C.NaHSO4 在水溶液及熔融状态下均可电离出 Na+、H+、SO2-
4
D.NH3 属于非电解质,但其水溶液能够导电
【答案】D
【解析】三氧化硫本身不能电离出离子,SO3 是非电解质,A 错误;离子数目多的溶液中,离子浓度不
一定大,离子所带电荷数不一定多,其导电能力不一定强,B 错误;NaHSO4 在熔融状态下只能电离出
Na+、 4HSO ,C 错误;NH3 是非电解质,但其溶于水后可形成电解质 NH3·H2O,溶液能导电,D 正确。
题后拓展
金属导电与电解质溶液导电的原理比较
(1)金属导电是由于自由电子在电场作用下的定向移动,温度升高、金属阳离子振动幅度增大,自由电
子定向移动阻力增大,金属导电性减弱。
(2)电解质溶液之所以导电,是由于溶液中有自由移动的离子存在。电解质溶液导电能力的大小,和电
解质的强弱没有必然联系,决定于溶液中自由移动离子的浓度和离子的电荷数。但温度升高时,弱电解质
电离程度增大,离子浓度增大,导电性会增强。
考向二 电离方程式的书写
典例 1 下列物质在指定条件下电离方程式书写正确的是
A.Na2CO3 溶于水 Na2CO3 2Na + 2
3CO
B.Al(OH)3 酸式电离 Al(OH)3 H++ 2AlO +H2O
C.NaHS 溶于水 HS−的电离 HS−+H2O H2S+OH−
D.NaHSO4 加热熔化 NaHSO4 Na++ 4HSO
【答案】D
【解析】A 项,应为 Na2CO3 2Na++ 2
3CO ;B 项,应用可逆号;C 项,是 HS−的水解方程式。
2.下列物质在水溶液中的电离方程式书写正确的是
A.CH3COOH H++CH3COO- B.NaHSO4 Na++H++ 2
4SO
C.H3PO4 3H++ 3
4PO D.NaHCO3 Na++H++ 2
3CO
【答案】B
【解析】本题主要考查电离方程式的正误判断。A.CH3COOH 是弱电解质,电离方程式要使用可逆符
号,CH3COOH H++CH3COO-,故 A 错误。B.NaHSO4 Na++H++ 2
4SO ,故 B 正确。C.H3PO4
是三元弱酸,其电离分步进行,H3PO4 H++ 2 4H PO , 2 4H PO H++ 2
4HPO , 2
4HPO H
++ 3
4PO ,D.NaHCO3 是强电解质,电离方程式要用等号,而且电离出的阴离子是碳酸氢根离子,
NaHCO3 Na++ 3HCO ,故 D 错误。
通关秘籍
(1)注意两符号:强电解质电离用“ ”表示全部电离,弱电解质电离用“ ”表示部分电离。
(2)遵循两守恒:原子守恒、电荷守恒。即在电离方程式两边原子的种类和数目相同。在电解质溶液
中,阳离子所带的正电荷总数等于阴离子所带的负电荷总数,电解质溶液呈电中性。
(3)注意分步:弱酸的一级电离常数与二级电离常数(或多级电离常数)之间一般相差约 103 或 104 倍,
不能合并各级电离,要分步书写电离方程式。
1.下列属于电解质的是
A.氯化钠 B.蔗糖 C.氯气 D.铁
【答案】A
【解析】
A 项,氯化钠溶于水或熔融状态下可以导电,是电解质,故 A 项正确;
B 项,蔗糖的水溶液或熔融状态都不导电,是非电解质,故 B 项错误;
C 项,氯气是单质,既不是电解质也不是非电解质,故 C 项错误;
D 项,铁是单质,既不是电解质也不是非电解质,故 D 项错误。
综上所述,本题正确答案为 A。
2.有下列 10 种物质,归类正确的是
①铝②H2S ③金刚石 ④氯水 ⑤NaOH 固体 ⑥BaCO3 固体 ⑦氨水 ⑧CO2 ⑨乙醇 ⑩盐酸
A.能导电的物质①④⑤⑦⑩ B.含有离子键的化合物: ⑤⑥⑩
C.电解质: ⑤⑥⑩ D.共价化合物: ②⑧⑨
【答案】D
【解析】
A. 含有自由移动电子或离子的物质可以导电,能导电的物质有金属铝、氯水、氨水和盐酸,即①④⑦⑩,
A 错误;B. 含有离子键的化合物有氢氧化钠、碳酸钡,即⑤⑥,B 错误;C. 溶于水或在熔融状态下能够导
电的化合物是电解质,属于电解质的是②⑤⑥,C 错误;D. 全部由共价键形成的化合物是共价化合物,属
于的共价化合物是②⑧⑨,D 正确,答案选 D。
点睛:电解质的判断是易错点,判断时既要考虑是不是化合物,还要考虑溶于水或在熔融状态下能否导电,
需要说明的是导电只是现象,关键是看该化合物能否自身电离出阴阳离子。
3.等物质的量浓度的下列水溶液,导电能力最强的是( )
A.醋酸溶液 B.苯酚溶液 C.乙醇溶液 D.蔗糖溶液
【答案】A
【解析】醋酸是一元弱酸,苯酚的酸性弱于醋酸,乙醇和蔗糖均是非电解质,则等物质的量浓度的水溶液,
导电能力最强的是醋酸溶液;
答案选 A。
4.将 NaCl 溶于水配成 1mol/L 的溶液,溶解过程如图所示。下列说法正确的是( )
A.a 离子为 Cl-,b 离子为 Na+
B.溶液中含有 NA 个水合 Na+
C.溶液中存在 NaCl Na++Cl-
D.NaCl 溶解过程需要在容量瓶中进行
【答案】A
【解析】A.钠离子核外有 2 个电子层,氯离子有 3 个电子层,即氯离子半径大于钠离子,a 离子为 Cl-,b
离子为 Na+,A 正确;
B.题目中没有说明溶液的体积,无法计算溶质的物质的量,即无法判断溶液中水合 Na+的个数,B 错误;
C. 氯化钠是强电解质,全部电离,电离方程式为:NaCl = Na++Cl-,C 错误;
D.容量瓶是精密仪器,不能用于溶解,NaCl 溶解需要在烧杯中进行,D 错误;
故选 A。
5.分类法在化学发展中起到了非常重要的作用,下列分类标准合理的是
A.根据是否含有氧元素,将物质分为氧化剂和还原剂
B.根据是否具有丁达尔现象,将分散系分为溶液、胶体和浊液
C.根据水溶液是否能够导电,将物质分为电解质和非电解质
D.根据是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应
【答案】D
【解析】
A、氧化剂不一定有氧元素,所以错误,不选 A;B、根据分散系中分散质的微粒直径大小将分散系分成溶
液或胶体或浊液,错误,不选 B;C、物质必须是化合物才能可能是电解质或非电解质,错误,不选 C;D、
氧化还原反应中肯定有电子转移,正确,选 D。
考点:物质的分类标准
6.在电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭
后,又逐渐变亮的是( )
A.盐酸中逐滴加入食盐溶液 B.硫酸中逐滴加入氢氧化钠溶液
C.硫酸中逐滴加入氢氧化钡溶液 D.醋酸中逐滴加入氨水
【答案】C
【解析】
A.盐酸溶液中逐滴加入食盐溶液,溶液电荷浓度不为 0,灯泡不可能熄灭,故 A 错误;
B.硫酸中逐滴加入氢氧化钠溶液生成硫酸钠,溶液电荷浓度不为 0,灯泡不可能熄灭,故 B 错误;
C.向硫酸溶液中逐滴加入氢氧化钡溶液,完全反应时生成硫酸钡沉淀和水,溶液电荷浓度接近 0,灯泡熄灭,符
合题目要求,所以 C 选项是正确的;
D.醋酸中逐滴加入氨水,生成醋酸铵,溶液电荷浓度不为 0,灯泡不可能熄灭,故 D 错误;
所以 C 选项是正确的。
7.下列物质中按照纯净物,混合物,电解质和非电解质的顺序排列的是
A.盐酸,水煤气,醋酸,干冰 B.冰醋酸,盐酸,硫酸钠,乙醇
C.苛性钠,石灰石,铁,硫酸钡 D.胆矾,漂白粉,氯化钾,氯气
【答案】B
【解析】
A、盐酸是混合物,不符合题意;
B、正确;C、铁不是电解质,硫酸钡是电解质,不符合题意;D、氯气不是非电解质,不符合题意。
8.铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示。图中
两圆相交部分(A、B、C、D)表示物质间的反应,其中对应的离子方程式书写正确的是
A.OH−+HCl=H2O+Cl− B.Ca(OH)2+Cu2+=Ca2++Cu(OH)2
C.Fe+Cu2+=Cu+Fe2+ D.Fe+2H+=Fe3++H2↑
【答案】C
【解析】
A. 稀盐酸和石灰水发生中和反应,反应的离子方程式应为 H++OH−=H2O,A 项错误;
B. 氯化铜和石灰水反应生成氢氧化铜沉淀,反应的离子方程式为 Cu2++2OH−=Cu(OH)2↓,B 项错误;
C. 铁与氯化铜溶液发生置换反应,生成氯化亚铁和铜,反应的离子方程式为 Fe+Cu2+=Fe2++Cu,C 项正确;
D. 铁为活泼金属,与稀盐酸发生置换反应生成氢气,离子方程式为 Fe+2H+=Fe2++H2↑,D 项错误;
答案选 C。
9.有下列物质:①Na2CO3•10H2O 晶体 ②铜 ③硫酸溶液 ④CO2 ⑤NaHSO4 固体
⑥Ba(OH)2 固体 ⑦红褐色的氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3 固体。
(1)上述物质属于电解质的有__(填编号),能导电的物质有__(填编号)。
(2)上述物质中有两种物质之间可发生离子反应:H++OH-=H2O,写出该离子反应对应的化学方程式 。
(3)写出固体⑤熔化时的电离方程式 。
(4)当⑤与⑥1:1 混合后,写出该离子方程式 。
(5)写出⑦的制备方法 。
【答案】(1)①⑤⑥⑩ ②③⑦⑧⑨
(2)2HNO3+Ba(OH)2=Ba(NO3)2+2H2O
(3)NaHSO4(熔融)=Na++HSO -
4
(4)H++SO 2
4
+OH-+Ba2+=BaSO4+H2O
(5)向沸水中逐滴滴加饱和氯化铁溶液,直至液体呈现红褐色,停止加热
【解析】电解质是指在熔融状态或水溶液中能导电的化合物,即电解质属于纯净物中的化合物,
①Na2CO3•10H2O 晶体是纯净物,固体本身不能导电,其水溶液能导电,属于电解质;
②铜是金属单质,能导电,但不是化合物,不是电解质也不是非电解质;
③硫酸溶液能导电,但其水溶液是混合物,不是化合物,不是电解质也不是非电解质;
④CO2 溶于水生成碳酸属于弱电解质,其水溶液能导电,但 CO2 本身不能导电,不是电解质;
⑤NaHSO4 是纯净物,固体不能导电,其水溶液或熔融状态能导电,属于电解质;
⑥Ba(OH)2 固体是纯净物,固体不能导电,其水溶液或熔融状态能导电,属于电解质;
⑦红褐色的氢氧化铁胶体,由于胶体粒子带电,则氢氧化铁胶体能导电,但胶体是混化合物,不属于电解
质;
⑧氨水中含有多种离子,能导电,但氨水属于混合物,不是电解质;
⑨稀硝酸中含有氢离子和硝酸根离子,可导电,但稀硝酸是硝酸溶液,属于混合物,不是电解质;
⑩Al2(SO4)3 是纯净物,固体状态不导电,其水溶液或熔融状态能导电,属于电解质;
(1)根据分析,上述物质属于电解质的有①⑤⑥⑩,能导电的物质有②③⑦⑧⑨;
(2)发生离子反应:H++OH-=H2O,应为可溶性强酸和强碱的中和反应,即硝酸与氢氧化钡的反应,其化学方
程式为:2HNO3+Ba(OH)2=Ba(NO3)2+2H2O;
(3)固体⑤NaHSO4 熔化时电离出钠离子和硫酸氢根离子,电离方程式 NaHSO4(熔融)=Na++HSO -
4 ;
(4)NaHSO4 与 Ba(OH)2 按 1:1 混合后反应生成硫酸钡、氢氧化钠和水,该离子方程式
H++SO 2
4
+OH-+Ba2+=BaSO4+H2O;
(5)制备氢氧化铁胶体方法为:向沸水中逐滴滴加饱和氯化铁溶液,直至液体呈现红褐色,停止加热。
10.已知 0.1mol·L-1 的 NaHSO4 溶液中 H+浓度为 0.1mol·L-1,请回答下列问题:
(1)写出 NaHSO4 在水溶液中的电离方程式:___________________;
(2)NaHSO4 属于“酸”、“碱”、“盐”中的____________,理由是____________________;
(3)①若将 NaHSO4 与 Ba(OH)2 在溶液中按照物质的量之比为 2∶1 混合,反应的化学方程式为
______________________;
②若将 NaHSO4 与 Ba(OH)2 在溶液中按照物质的量之比为 1∶1 混合,化学方程式为
___________________________。
【答案】(1)NaHSO4=Na++H++SO42-
(2)盐 NaHSO4 在水溶液中电离出金属阳离子钠离子和酸根离子硫酸根离子
(3) 2NaHSO4+ Ba(OH)2=BaSO4↓+ Na2SO4+2H2O NaHSO4+ Ba(OH)2=BaSO4↓+ NaOH +H2O
【解析】
(1)0.1mol·L-1 的 NaHSO4 溶液中 H+浓度为 0.1mol·L-1,说明 NaHSO4 是强电解质,完全电离,电离方程式为
NaHSO4=Na++H++SO42-,故答案为:NaHSO4=Na++H++SO42-;
(2)因 NaHSO4 是由钠离子和硫酸氢根离子构成,属于盐,故答案为:盐;NaHSO4 在水溶液中电离出金属阳
离子和酸根离子;
(3)①NaHSO4与Ba(OH)2在溶液中按物质的量之比2∶1混合,反应后溶液显中性,反应的方程式为2NaHSO4+
Ba(OH)2=BaSO4↓+ Na2SO4+2H2O;
②NaHSO4 与 Ba(OH)2 在溶液中按物质的量之比 1∶1 混合,反应后溶液显碱性,其反应为 NaHSO4+
Ba(OH)2=BaSO4↓+ NaOH +H2O。
1.[2020·新课标Ⅱ]二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如下图所示。下列叙
述错误的是
A.海水酸化能引起 3HCO 浓度增大、 2
3CO 浓度减小
B.海水酸化能促进 CaCO3 的溶解,导致珊瑚礁减少
C.CO2 能引起海水酸化,其原理为 3HCO H++ 2
3CO
D.使用太阳能、氢能等新能源可改善珊瑚的生存环境
【答案】C
【解析】海水酸化,H+浓度增大,平衡 H++ 2-
3CO
⇌
-
3HCO 正向移动, 2-
3CO 浓度减小, -
3HCO 浓度增大,A 正
确;海水酸化, 2-
3CO 浓度减小,导致 CaCO3 溶解平衡正向移动,促进了 CaCO3 溶解,导致珊瑚礁减少,B
正确;CO2 引起海水酸化的原理为:CO2+H2O
⇌
H2CO3
⇌
H++ -
3HCO , -
3HCO
⇌
H++ 2-
3CO ,导致 H+浓度增大,C
错误;使用太阳能、氢能等新能源,可以减少化石能源的燃烧,从而减少 CO2 的排放,减弱海水酸化,从
而改善珊瑚礁的生存环境,D 正确;答案选 C。
2.[2019 北京] 下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A B C D
NaCl 溶于水 电解 CuCl2 溶液
CH3COOH 在水中电离
H2 与 Cl2 反应能量变化
NaCl Na++Cl− CuCl2 Cu2++2Cl− CH3COOH CH3COO−+H+ H2(g)+Cl2(g) 2HCl(g)
ΔH=−183kJ·mol−1
【答案】B
【解析】
A.NaCl 为强电解质,NaCl 溶于水,NaCl 在水分子作用下,自发解离为 Na+和 Cl-,故电离方程式为
NaCl=Na++Cl-,故 A 不符合题意;
B.电解氯化铜溶液,铜离子向阴极移动,得电子,发生电极反应为:Cu2++2e-=Cu,氯离子向阳极移动,
失电子,发生电极反应为:2Cl-+2e-=Cl2,所以电解总反应为:Cu2++2Cl- Cu+Cl2↑,故 B 符合题意;
C.CH3COOH 为弱电解质,溶于水部分电离,因此电离方程式为 CH3COOH CH3COO-+H+,故 C 不
符合题意;
D.由图可知,反应 H2(g)+Cl2(g)=2HCl(g)的反应热等于断裂反应物分子中的化学键吸收的总能量(436
kJ/mol+243 kJ/mol=679 kJ/mol),与形成生成物分子中化学键放出的总能量(431 kJ/mol×2= 862 kJ/mol)
之差,即放热 183kJ/mol,放热∆H 为负值,所以 H2(g)+Cl2(g)=2HCl(g) ∆H=-183kJ/mol,故 D 不符合题意;
综上所述,本题应选 B。
3.[2018·北京]下列化学用语对事实的表述不正确的是
A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH C17H35COOC2H5+H218O
B. 常温时,0.1 mol·L-1 氨水的 pH=11.1:NH3·H2O +
4NH +OH−
C. 由 Na 和 C1 形成离子键的过程:
D. 电解精炼铜的阴极反应:Cu2+ +2e− Cu
【答案】A
【 解 析 】 A 项 , 酯 化 反 应 的 机 理 是 “ 酸 脱 羟 基 醇 脱 氢 ” , 硬 脂 酸 与 乙 醇 反 应 的 化 学 方 程 式 为
C17H35COOH+C2H518OH C17H35CO18OC2H5+H2O,A 项错误;B 项,常温下 0.1mol·L-1 氨水的
pH=11.1 , 溶 液 中 c ( OH- ) =10-2.9mol·L-1 0.1mol·L-1 , 氨 水 为 弱 碱 水 溶 液 , 电 离 方 程 式 为
NH3·H2O NH4++OH-,B 项正确;C 项,Na 原子最外层有 1 个电子,Na 易失电子形成 Na+,Cl 原子
最外层有 7 个电子,Cl 易得电子形成 Cl-,Na 将最外层的 1 个电子转移给 Cl,Na+与 Cl-间形成离子键,
C 项正确;D 项,电解精炼铜时,精铜为阴极,粗铜为阳极,阴极电极反应式为 Cu2++2e-=Cu,D 项正确;
答案选 A。
4.[2015·上海]与氢硫酸反应有沉淀生成的电解质是
A.硫酸铜 B.氢氧化钠 C.硫酸亚铁 D.二氧化硫
【答案】A
【 解 析 】 本 题 考 查 元 素 化 合 物 知 识 , 意 在 考 查 考 生 对 元 素 化 合 物 知 识 的 掌 握 情 况 。
H2S+CuSO4 CuS↓+H2SO4,A 选项正确;H2S+2NaOH Na2S+2H2O,B 选项错误;FeSO4 与 H2S
不反应,C 选项错误;SO2+2H2S 3S↓+2H2O,有沉淀生成,但 SO2 不是电解质,D 选项错误。
相关文档
- 高考化学总复习智能考点归类总结教2021-05-13 00:20:4715页
- 新课标高考化学高频考点及例题解析2021-05-13 00:09:1732页
- 高考化学二轮复习浙江讲义专题十三2021-05-13 00:03:2022页
- 高考化学总复习有机实验突破有机物2021-05-13 00:02:5013页
- 2021版高考化学一轮复习专题质量评2021-05-12 23:54:0818页
- 备战2021年高考化学模拟专练卷06(学2021-05-12 23:44:508页
- 2020届高考化学一轮复习金属及其化2021-05-12 23:43:3712页
- 2021版高考化学一轮复习专题3金属2021-05-12 23:36:22146页
- 2021高考化学一轮复习课时达标作业2021-05-12 23:36:118页
- 湖南版2021高考化学一轮复习专题102021-05-12 23:33:5317页