- 647.52 KB
- 2021-05-12 发布
模拟专练卷 06
化学
可能用到的相对原子质量:C−12 N−14 Al−27 Fe−56
一、选择题:本题共 7 个小题,每小题 6 分。共 42 分,在每小题给出的四个选项中,只有一项是符合题目要求
的。
7.化学与生活、社会发展息息相关,下列有关说法不正确的是
A.“时气错逆,霾雾蔽日”,雾所形成的气溶胶能产生丁达尔效应
B.“青蒿一握,以水二升渍,绞取汁”;屠呦呦改进提取青蒿素的方法,提取过程中发生了化学变化
C.刘禹锡的“千淘万漉虽辛苦,吹尽狂沙始到金”可以看出金性质稳定,可通过物理方法得到
D.“外观如雪,强烧之,紫青烟起”。对硝酸钾的鉴定过程中利用了焰色反应
8.NH4NO3 溶液受热可发生分解反应:NH4NO3 加热 N2↑+HNO3+H2O(未配平)。用 NA 表示阿伏加德罗
数的值,下列说法正确的是
A.分解时每生成 2.24 L(标准状况)N2,转移电子的数目为 0.6NA
B.2.8 g N2 中含有共用电子对的数目为 0.3NA
C.56 g Fe 与足量稀硝酸反应生成 NO2 分子的数目为 3NA
D.0.1 mol·L-1 NH4NO3 溶液中,NH4
+的数目小于 0.1NA
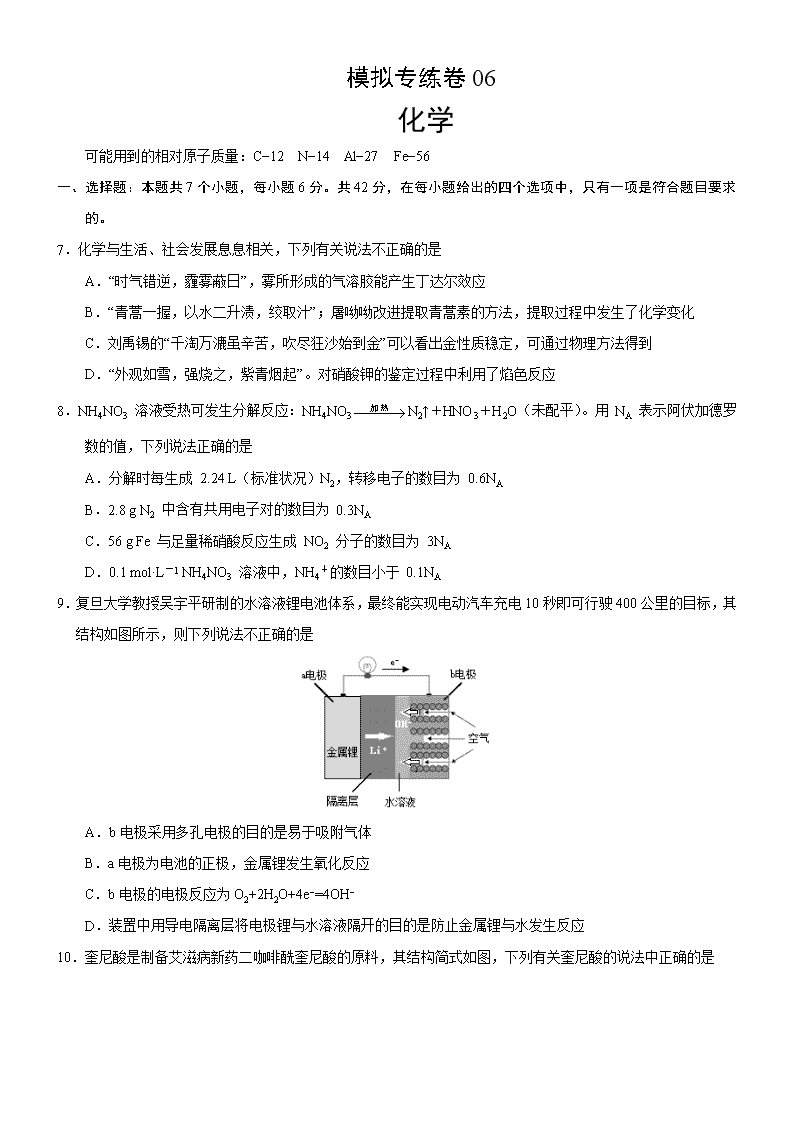
9.复旦大学教授吴宇平研制的水溶液锂电池体系,最终能实现电动汽车充电 10 秒即可行驶 400 公里的目标,其
结构如图所示,则下列说法不正确...的是
A.b 电极采用多孔电极的目的是易于吸附气体
B.a 电极为电池的正极,金属锂发生氧化反应
C.b 电极的电极反应为 O2+2H2O+4e−=4OH−
D.装置中用导电隔离层将电极锂与水溶液隔开的目的是防止金属锂与水发生反应
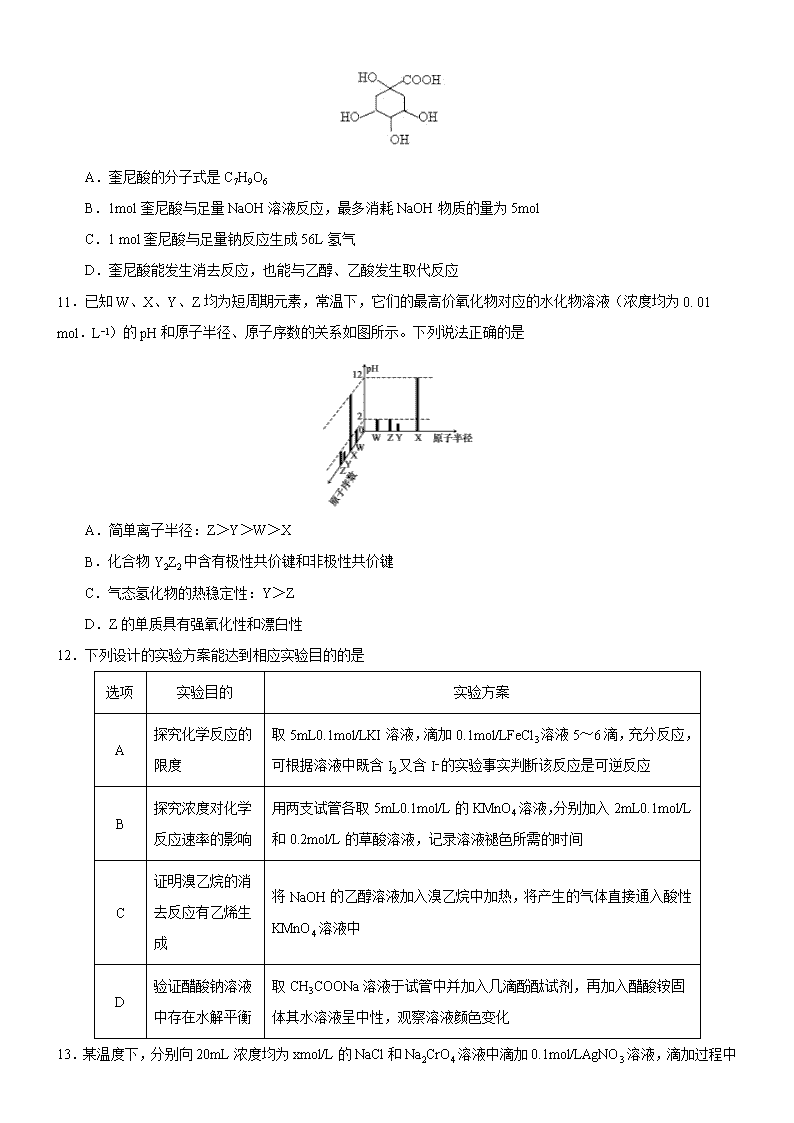
10.奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中正确的是
A.奎尼酸的分子式是 C7H9O6
B.1mol 奎尼酸与足量 NaOH 溶液反应,最多消耗 NaOH 物质的量为 5mol
C.1 mol 奎尼酸与足量钠反应生成 56L 氢气
D.奎尼酸能发生消去反应,也能与乙醇、乙酸发生取代反应
11.已知 W、X、Y、Z 均为短周期元素,常温下,它们的最高价氧化物对应的水化物溶液(浓度均为 0. 01 mol.L−l)
的 pH 和原子半径、原子序数的关系如图所示。下列说法正确的是
A.简单离子半径:Z>Y>W>X
B.化合物 Y2Z2 中含有极性共价键和非极性共价键
C.气态氢化物的热稳定性:Y>Z
D.Z 的单质具有强氧化性和漂白性
12.下列设计的实验方案能达到相应实验目的的是
选项 实验目的 实验方案
A
探究化学反应的
限度
取 5mL0.1mol/LKI 溶液,滴加 0.1mol/LFeCl3 溶液 5~6 滴,充分反应,
可根据溶液中既含 I2 又含 I−的实验事实判断该反应是可逆反应
B
探究浓度对化学
反应速率的影响
用两支试管各取 5mL0.1mol/L 的 KMnO4 溶液,分别加入 2mL0.1mol/L
和 0.2mol/L 的草酸溶液,记录溶液褪色所需的时间
C
证明溴乙烷的消
去反应有乙烯生
成
将 NaOH 的乙醇溶液加入溴乙烷中加热,将产生的气体直接通入酸性
KMnO4 溶液中
D
验证醋酸钠溶液
中存在水解平衡
取 CH3COONa 溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固
体其水溶液呈中性,观察溶液颜色变化
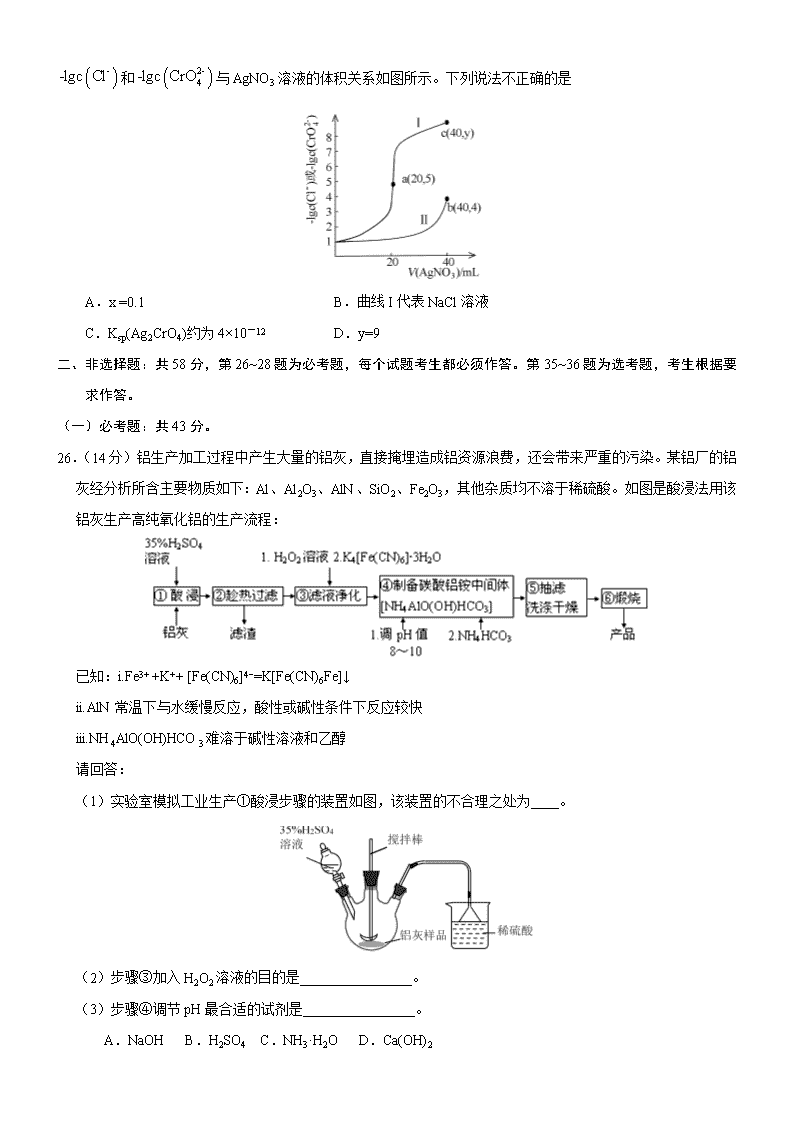
13.某温度下,分别向 20mL 浓度均为 xmol/L 的 NaCl 和 Na2CrO4 溶液中滴加 0.1mol/LAgNO3 溶液,滴加过程中
--lgc Cl 和 2-
4-lgc CrO 与 AgNO3 溶液的体积关系如图所示。下列说法不正确的是
A.x =0.1 B.曲线 I 代表 NaCl 溶液
C.Ksp(Ag2CrO4)约为 4×10-12 D.y=9
二、非选择题:共 58 分,第 26~28 题为必考题,每个试题考生都必须作答。第 35~36 题为选考题,考生根据要
求作答。
(一)必考题:共 43 分。
26.(14 分)铝生产加工过程中产生大量的铝灰,直接掩埋造成铝资源浪费,还会带来严重的污染。某铝厂的铝
灰经分析所含主要物质如下:Al、Al2O3、AlN、SiO2、Fe2O3,其他杂质均不溶于稀硫酸。如图是酸浸法用该
铝灰生产高纯氧化铝的生产流程:
已知:i.Fe3+ +K++ [Fe(CN)6]4−=K[Fe(CN)6Fe]↓
ii.AlN 常温下与水缓慢反应,酸性或碱性条件下反应较快
iii.NH4AlO(OH)HCO3 难溶于碱性溶液和乙醇
请回答:
(1)实验室模拟工业生产①酸浸步骤的装置如图,该装置的不合理之处为____。
(2)步骤③加入 H2O2 溶液的目的是________________。
(3)步骤④调节 pH 最合适的试剂是________________。
A.NaOH B.H2SO4 C.NH3·H2O D.Ca(OH)2
(4)步骤⑤吸滤瓶内液体高度快达到支管口位置时应拔掉瓶上橡皮管,_______,洗涤沉淀操作为
_______________。
(5)写出煅烧碳酸铝铵中间体得到高纯氧化铝的化学方程式______________。
(6)已知 Al3+对光的吸收与其浓度成线性关系,色度计传感器可以测量某种波长的光穿过溶液的透射率确定
溶液浓度。如图是红色光照下透光率(T)对应 c(Al3+)的标准曲线。为测定铝灰中铝元素的回收率,准确称取
0.5000g 铝灰(折合铝元素含量 60.00%)进行制备高纯氧化铝的实验,将所制得的粉末与固体 NaOH 反应后加水
溶解、过滤,滤液定容到 250mL 容量瓶中。用移液管移取 25.00mL 到锥形瓶中,加 2 滴指示剂,滴加稀盐酸
至溶液体积变为 50.00mL,NaAlO2 恰好反应生成 AlCl3。取该溶液于比色皿中进行色度检测,测得溶液透光
率为 97.5,则铝元素的回收率=_________。
27.(14 分)实验室以海绵铜(主要成分为 Cu 和 CuO)为原料制取 CuCl 的主要流程如图所示。
已知:①CuCl 微溶于水,不溶于乙醇,可溶于氯离子浓度较大的溶液中。
②CuCl 露置于潮湿的空气中易被氧化。
回答下列问题。
(1)“氧化”时温度应控制在 60~70℃,原因是____________________。
(2)写出“转化”过程中的离子方程式____________________。
(3)“过滤Ⅱ”所得滤液经__________、__________、过滤等操作获得(NH4)2SO4 晶体,可用作化学肥料。“过
滤Ⅱ”所得滤渣主要成分为 CuCl,用乙醇洗涤的优点是________________。
(4)氯化铵用量[ 4
2+
(NH Cl)
(Cu )
n
n ]与 Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多 Cu2+沉淀率增加,但当
氯化铵用量增加到一定程度后 Cu2+的沉淀率减小,其原因是__________。
(5)若 CuCl 产品中混有少量 CaSO4,补全提纯 CuCl 的实验方案:_____,过滤,_____。(实验中可选试剂:
0.1 mol·L−1 盐酸、10 mol·L−1 盐酸、蒸馏水、无水乙醇)
28.(15 分)(1)如图的氮循环是生态系统物质循环的重要部分,人类活动加剧了氮循环中的物质转化。
①下列说法正确的是_______(填字母序号)
A.固氮过程中,N2 只做氧化剂
B.硝化过程需要有氧化剂参与
C.反硝化过程有助于弥补人工固氮对氮循环造成的影响
D.同化、氨化过程中,实现了氮元素在无机物和有机物之间的转化
②反硝化过程中,CH3OH 可作为反应的还原剂,1mol 还原剂失去 6mol 电子。请将该反应的离子方程式补充
完整:5CH3OH+□NO3— □_______+□_______+□_______+□_______,_____________
(2)研究表明,氮氧化物(NOx)和二氧化硫都与大气中雾霾的形成有关。
①已知:SO2 生成 SO3 总反应方程式是 2SO2(g)+O2(g) 2SO3(g)ΔH=-196.6kJ/mol
此反应可通过如下两步完成:2NO(g)+O2(g) 2NO2(g)ΔH1=-113kJ/mol
NO2(g)+SO2(g) SO3(g)+NO(g)ΔH2=_______。
②一定温度下,向 2L 恒容密闭容器中充入 NO2 和 SO2 各 1mol,5min 达到平衡,此时容器中 NO2 和 NO 的浓
度之比为 1∶3,则 NO2 的平衡转化率是_______。
(3)砷(As)是第四周期ⅤA 族元素,其化合物,有着广泛的用途。
①AsH3 的稳定性比 NH3 的稳定性_______(填“强’’或“弱’’)。用原子结构解释原因_______。
②常将含砷废渣(主要成分为 As2S3)制成浆状,通入 O2 氧化,生成 H3AsO4 和单质硫。写出发生反应的化学
方程式_______。
③298K 时,将 20mL3xmol•L−1Na3AsO3、20mL3xmol•L−1I2 和 20mLNaOH 溶液混合,发生反应:
AsO33−(aq)+I2(aq)+2OH− AsO43−(aq)+2I−(aq)+H2O(l)。溶液中 c(AsO43﹣)与反应时间(t)的关系如图所示。若
平衡时溶液的 pH=14,则该反应的平衡常数 K 为_______。
(二)选考题:共 15 分。请考生从 2 道化学题中任选一题作答。如果多做,则按所做的第一题计分。
35.[化选修 3:物质结构与性质](15 分)
一种 Ru 络合物与 g−C3N4 复合光催化剂将 CO,还原为 HCOOH 的原理图如图所示。
(1)基态碳原子的价电子排布图为_____________。
(2)1molHCOOH 中含有的σ键数目为_____________,HCOOH 的沸点比 CO2 高的原因为_____________。
(3)Ru 络合物中第二周期元素的第一电离能由大到小的顺序为_____________
(4)Ru 络合物中与 Ru 配位的原子有 N、_____________。
(5)Ru 络合物含有的片段 和 中氮原子均采用 sp2 杂化,都存在大π键,氮原子配位能力更强的是
_____________(填“前者”或“后者”)。
(6)一种类石墨的聚合物半导体 g−C3N4,其单层平面结构如图 1,晶胞结构如图 2。
①g−C3N4 中氮原子的杂化类型是_____________。
②根据图 2,在图 1 中用平行四边形画出一个最小重复单元。_____________
③已知该晶胞的体积为 Vcm3,中间层原子均在晶胞内部。设阿伏加德罗常数的值为 NA,则 g−C3N4 的密度为
____g.cm−3。
36.[化选修 5:有机化学基础](15 分)
吡喹酮(H)是一种治疗血吸虫病的药物,合成路线如下图所示:
已知:I R−Cl+NaCN 催化剂
加热 R−CN+NaCl
ii +R′−NH−R"+NaOH +NaCl+H2O(R、R′表示烃基,R"表示烃基或 H)
(1)A 属于芳香烃,其名称是________________________。
(2)步骤②的反应类型是_______________________________。
(3)B 的一种同分异构体,含苯环且核磁共振氢谱中出现三组峰,其结构简式为______________。
(4)③中 1mol C 理论上需要消耗__________________mol H2 生成 D。
(5)④的化学方程式是 ________。
(6)F 中含氧官能团是 和_______________________(填名称)。
(7)试剂 a 的结构简式是___________________。
(8)G→H 分为三步反应,J 中含有 3 个六元环,写出 I、J 的结构简式。
I:_____;J:_____。
相关文档
- 2020届高考化学一轮复习金属及其化2021-05-12 23:43:3712页
- 2021版高考化学一轮复习专题3金属2021-05-12 23:36:22146页
- 2021高考化学一轮复习课时达标作业2021-05-12 23:36:118页
- 湖南版2021高考化学一轮复习专题102021-05-12 23:33:5317页
- 2018高考化学新课标II卷试题及解析2021-05-12 23:28:3516页
- 2020高考化学考前疑难易错专练三含2021-05-12 23:22:394页
- 2021新高考化学鲁科版一轮复习突破2021-05-12 23:19:527页
- 高考化学人教版一轮复习知识点同步2021-05-12 23:19:435页
- 2013高考化学考点精讲考点9习题课2021-05-12 23:03:1713页
- 山东专用2020届高考化学二轮复习专2021-05-12 23:00:3612页