- 1.75 MB
- 2021-05-08 发布
专题二 非选择题专项指导
题型一 工艺流程题
-
3
-
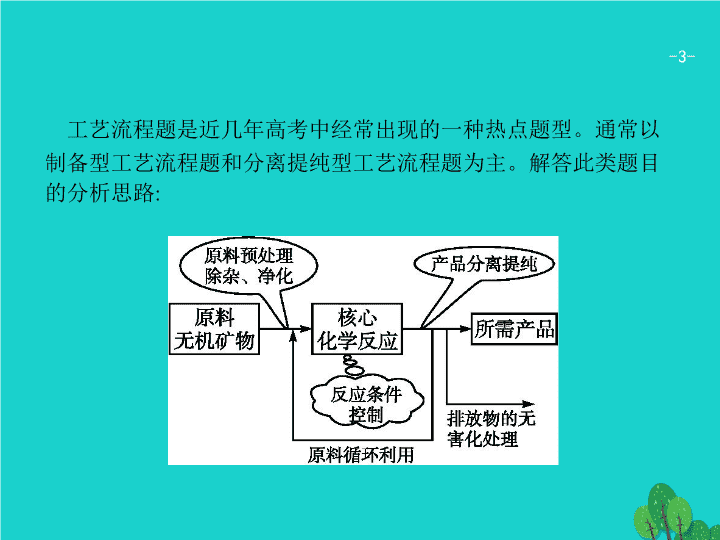
工艺流程题是近几年高考中经常出现的一种热点题型。通常以制备型工艺流程题和分离提纯型工艺流程题为主。解答此类题目的分析思路
:
-
4
-
解答工艺流程题可按照以下步骤进行
:
1
.
认真阅读题干
,
了解生产目的及有用信息。
2
.
整体分析工艺流程
,
掌握生产过程分为哪几个阶段。
3
.
分析每一个阶段的生产原理、物质变化、条件控制及其实验操作。
4
.
了解生产过程中的有关物质的回收和原料的循环利用
,
以及对
“
绿色化学
”
思想的运用和所采取的环保措施。
5
.
认真分析题中设问
,
规范作答。
-
5
-
一
二
一、物质制备型工艺流程题
例
1
硫酸是一种重要的化工产品
,
接触法制硫酸的简要流程如下图所示
:
请回答下列问题
:
(1)
上图中的造气和催化反应分别在甲、乙设备中进行
,
请写出乙设备名称
:
。
-
6
-
一
二
(2)
有关接触法制硫酸的下列说法中
,
正确的是
(
填字母
)
。
A.
从甲设备出来的炉气需净化
,
是为了防止混合气体污染空气
B.
乙设备中使用催化剂
,
是为了提高反应速率和
SO
2
的转化率
C.
煅烧含硫
48%
的黄铁矿时
,
若
FeS
2
损失了
2%,
则
S
损失
4%
D.
接触室中适宜条件是
V
2
O
5
催化剂、高温、高压
E.
乙设备中需安装热交换器
-
7
-
一
二
(3)
硫酸工厂排放的尾气中含少量二氧化硫。为防止污染大气
,
在排放前必须进行尾气处理并设法进行综合利用。硫酸工厂排放尾气中的
SO
2
通常用足量石灰水吸收
,
然后用稀硫酸处理。
①
写出上述过程的化学方程式
:
。
②
若某硫酸厂每天排放的
1
万立方米
(
标准状况
)
尾气中含
0.224%(
体积分数
)
的
SO
2
,
通过上述方法处理
,
理论上需生石灰
kg
。
(4)
硫酸厂等排放的
SO
2
尾气还可用电解法处理
,
如图所示
,Pt(1)
电极的反应式为
;
碱性条件下
,
用排出的含
的溶液吸收
NO
2
,
使其转化为
N
2
,
同时有
生成。若阳极转移电子
6 mol,
则理论上可处理
NO
2
气体
mol
。
-
8
-
一
二
-
9
-
一
二
-
10
-
一
二
解题指导
解答好本题一是要熟悉工业生产的原料、设备、基本原理以及相关反应方程式。二是关于相关计算
[
如本题第
(3)
小问
②
]
要采用关系式求解
,
利用原子守恒或得失电子守恒找出反应物和生成物之间的量的关系
,
然后根据相应数据列式计算。三是解答电解原理应用题目
,
首先要弄清楚图示中箭头走向
,
判断出反应物得失电子情况和生成物
,
然后根据守恒原理得出对应电极反应或相关计算结果。
-
11
-
一
二
方法规律拓展
无机化工流程题的审题角度
化工生产流程题中经常会出现一些表述性词语
,
这些表述性词语包含隐性信息
,
它可以暗示我们审题所应考虑的角度。常见的有
:
(1)“
控制较低温度
”——
常考虑物质的挥发
,
物质的不稳定性和物质的转化等。
(2)“
加过量试剂
”——
常考虑反应完全或增大某种反应物的转化率等。
(3)“
能否加其他物质
”——
常考虑会不会引入杂质或是否影响产品的纯度。
(4)“
在空气中或在其他气体中
”——
主要考虑
O
2
、
H
2
O
、
CO
2
或其他气体是否参与反应或达到防氧化、防水解、防潮解等目的。
(5)“
判断沉淀是否洗净
”——
常取少量最后一次洗涤液于试管中
,
向其中滴加某试剂
,
以检验其中的某种离子。
-
12
-
一
二
(6)“
检验某物质的设计方案
”——
通常取少量某液体于试管中
,
加入另一试剂产生某现象
,
然后得出结论。
(7)“
控制
pH”——
常考虑防水解、促进生成沉淀或除去杂质等。
(8)“
用某些有机试剂清洗
”——
常考虑降低物质溶解度有利于析出、减少损耗和提高利用率等。
-
13
-
一
二
对点训练
1
(2016
全国乙
)NaClO
2
是一种重要的杀菌消毒剂
,
也常用来漂白织物等
,
其一种生产工艺如下
:
回答下列问题
:
(1)NaClO
2
中
Cl
的化合价为
。
(2)
写出
“
反应
”
步骤中生成
ClO
2
的化学方程式
。
-
14
-
一
二
(3)“
电解
”
所用食盐水由粗盐水精制而成
,
精制时
,
为除去
Mg
2+
和
Ca
2+
,
要加入的试剂分别为
、
。
“
电解
”
中阴极反应的主要产物是
。
(4)“
尾气吸收
”
是吸收
“
电解
”
过程排出的少量
ClO
2
。此吸收反应中
,
氧化剂与还原剂的物质的量之比为
,
该反应中氧化产物是
。
(5)“
有效氯含量
”
可用来衡量含氯消毒剂的消毒能力
,
其定义是
:
每克含氯消毒剂的氧化能力相当于多少克
Cl
2
的氧化能力。
NaClO
2
的有效氯含量为
。
(
计算结果保留两位小数
)
-
15
-
一
二
-
16
-
一
二
-
17
-
一
二
二、分离提纯型工艺流程题
例
2
卤素单质及其化合物在生产和生活中有广泛应用
:
Ⅰ
.
氟化钠主要用作农作物杀菌剂、杀虫剂、木材防腐剂。实验室以氟硅酸
(H
2
SiF
6
)
等物质为原料
,
通过下图所示的流程制取较纯净的氟化钠
,
并得到副产品氯化铵
:
-
18
-
一
二
已知
:20
℃
时氯化铵的溶解度为
37.2 g,
氟化钠的溶解度为
4 g,Na
2
SiF
6
微溶于水。请回答下列有关问题
:
(1)
完成并配平上述流程中
①②
的化学反应方程式
:
②
。
(2)
操作
Ⅲ
分为两步
,
其顺序是
(
填序号
)
。
A.
过滤
B.
加热浓缩
C.
冷却结晶
D.
洗涤
操作
Ⅱ
是洗涤、干燥
,
其目的是
,
在操作
Ⅰ
,
Ⅲ
~
Ⅴ
中与之相同的操作步骤是
。
(3)
流程
①
中
NH
4
HCO
3
必须过量
,
其原因是
-
19
-
一
二
Ⅱ
.
紫菜与海带类似
,
是一种富含生物碘的海洋植物
,
可用于食用补碘。以下为某兴趣小组模拟从紫菜中提取碘的过程
:
已知商品紫菜轻薄松脆、比海带更易被焙烧成灰
(
此时碘转化为碘化物无机盐
)
。
(4)
将焙烧所得的紫菜灰与足量的过氧化氢和稀硫酸作用
,
写出反应的离子方程式
:
。
-
20
-
一
二
(5)
操作
①
中涉及两步操作
,
名称是
、
,
所用的主要玻璃仪器为
,
所用试剂
A
最好选用表格中的
(
填试剂名称
)
。
(6)
将下列装置图中缺少的必要仪器补画出来
,
最终将单质碘与试剂
A
分离。
-
21
-
一
二
-
22
-
一
二
-
23
-
一
二
解题指导
工艺流程题
分析问题的方法。
(1)
有些问题并不需要流程图中的信息就可回答。
(2)
有些问题只需要部分信息
,
并不需要看懂全部信息就可回答
,
题目给出完整的工业流程图是为了使其与实际工业生产相对应
,
所以不要纠缠于与问题无关的步骤之中。
(3)
当遇到问题无从解答时
,
要根据工业流程的目的思考
,
就会打开思路
,
找到解决问题的方法。
-
24
-
一
二
方法规律拓展
1
.
对原料进行预处理的常用方法。
(1)
研磨
:
减小固体颗粒
,
增大固体与液体或气体间的接触面积
,
加快反应速率。
(2)
水浸
:
与水接触反应或溶解。
(3)
酸浸
:
与酸接触反应或溶解
,
使可溶性金属离子进入溶液
,
不溶物通过过滤除去。
(4)
灼烧
:
除去可燃性杂质或使原料初步转化
,
如从海带中提取碘时
,
灼烧就是为了除去海带中的可燃性杂质。
(5)
煅烧
:
改变物质结构
,
并使一些杂质在高温下氧化、分解
,
如煅烧高岭土。
-
25
-
一
二
2
.
无机化工流程题常见设问方向
:
(1)
反应速率与平衡理论的运用
;
(2)
氧化还原反应的判断、化学方程式或离子方程式的书写
;
(3)
利用控制
pH
分离除杂
;
(4)
化学反应的能量变化
;
(5)
实验基本操作
:
除杂、分离、检验、洗涤、干燥等
;
(6)
流程中的物质转化和循环
,
资源的回收和利用
;
(7)
环境保护与绿色化学评价。
-
26
-
一
二
对点训练
2
(2015
广西南宁模拟
)
水处理技术在生产、生活中应用广泛
,
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)
下列试剂能够用于对饮用水进行杀菌消毒
,
且不会造成二次污染的是
(
填字母
)
。
A.
福尔马林
B.
漂白粉
C.
氯气
D.
臭氧
(2)Na
2
FeO
4
是一种新型水处理剂
,
工业上可用
FeSO
4
制备
,
其工艺流程如下
:
-
27
-
一
二
①
测得
FeSO
4
溶液中
c
(Fe
2+
) =
a
mol·L
-1
,
若要处理
1 m
3
该溶液
,
理论上需要消耗
25%
的
H
2
O
2
溶液
kg(
用含
a
的代数式表示
)
。
②
写出由
Fe(OH)
3
制取
Na
2
FeO
4
的化学方程式
:
。
(3)
废旧电池若不进行回收利用
,
将对水体产生严重污染。某兴趣小组对废旧镍电池正极材料
[
由
Ni(OH)
2
、炭粉、
Fe
2
O
3
等涂覆在铝箔上制成
]
进行回收研究
,
设计实验流程如下图所示
:
-
28
-
一
二
已知
:
①
NiCl
2
易溶于水
,Fe
3+
不能氧化
Ni
2+
,Cl
2
能氧化
Ni
2+
为
Ni
3+
;
②
NiO+2HCl NiCl
2
+H
2
O;
③
Fe
3+
、
Al
3+
、
Ni
2+
以氢氧化物形式沉淀时溶液的
pH
如表所示
:
④
K
sp
[Ni(OH)
2
]=5.0×10
-16
,
K
sp
(NiC
2
O
4
)=4.0×10
-10
。
-
29
-
一
二
请回答下列问题
:
①
加入盐酸酸溶后溶液中存在的金属阳离子为
。
②
步骤
X
的操作为
。
③
写出加入
Na
2
C
2
O
4
溶液后反应的化学方程式
:
。
④
写出加入
NaOH
溶液所发生反应的离子方程式
:
,
该反应的平衡常数为
。
⑤
用化学反应方程式表示沉淀
Ⅲ
转化为
Ni(OH)
3
:
-
30
-
一
二
-
31
-
一
二
-
32
-
一
二
-
33
-
一
二