- 179.50 KB
- 2021-05-06 发布
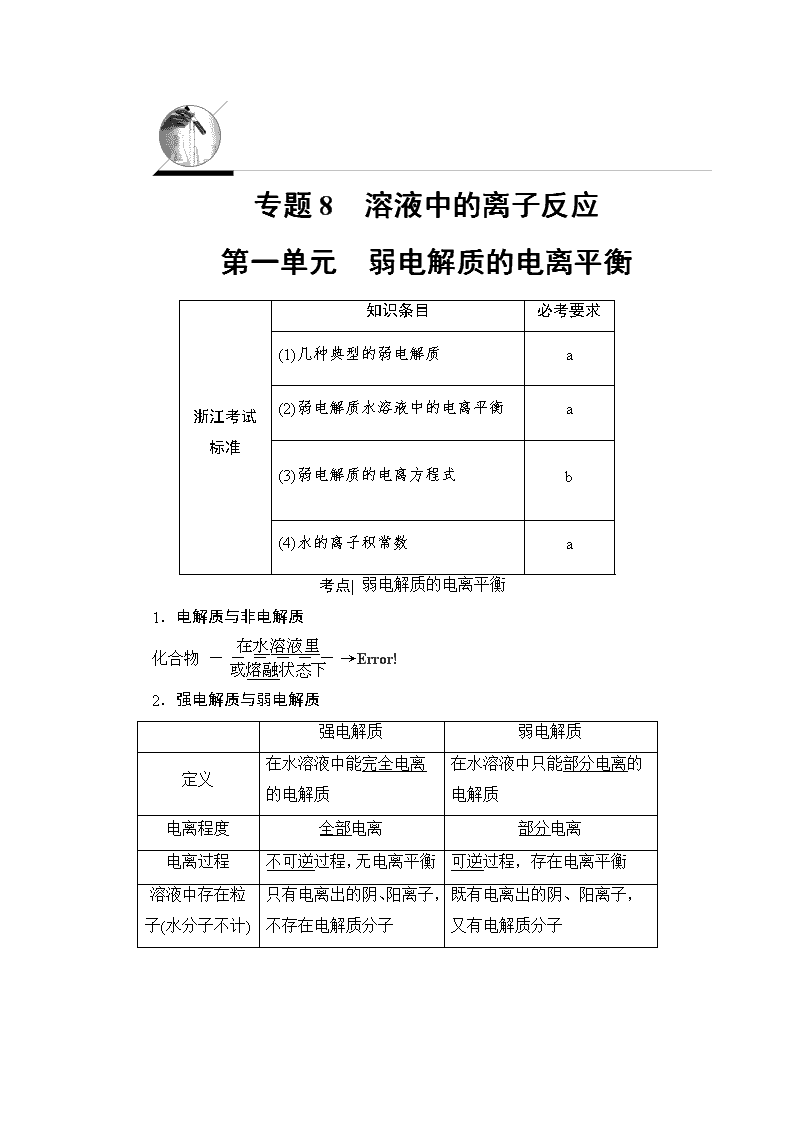
专题8 溶液中的离子反应
第一单元 弱电解质的电离平衡
浙江考试标准
知识条目
必考要求
(1)几种典型的弱电解质
a
(2)弱电解质水溶液中的电离平衡
a
(3)弱电解质的电离方程式
b
(4)水的离子积常数
a
考点| 弱电解质的电离平衡
1.电解质与非电解质
化合物
2.强电解质与弱电解质
强电解质
弱电解质
定义
在水溶液中能完全电离的电解质
在水溶液中只能部分电离的电解质
电离程度
全部电离
部分电离
电离过程
不可逆过程,无电离平衡
可逆过程,存在电离平衡
溶液中存在粒子(水分子不计)
只有电离出的阴、阳离子,不存在电解质分子
既有电离出的阴、阳离子,又有电解质分子
与物质类
别的关系
(1)绝大多数的盐(包括难溶性盐)
(2)强酸
(3)强碱
(1)水
(2)弱酸
(3)弱碱
3.电离方程式的书写
(1)强电解质:如H2SO4:H2SO4===2H++SO2。
(2)弱电解质:
①一元弱酸,如CH3COOH:CH3COOHCH3COO-+H+
②多元弱酸,分步电离,且第一步的电离程度远远大于第二步的电离程度,如H2CO3:H2CO3HCO+H+,HCOCO2+H+。
③多元弱碱,一步完成,如Fe(OH)3:
Fe(OH)3Fe3++3OH-。
4.弱电解质的电离平衡
(1)电离平衡的建立
①开始时,v电离最大,而v结合为0。
②平衡的建立过程中,v电离>v结合。
③当v电离=v结合时,电离过程达到平衡状态。
(2)电离平衡的特征
5.影响电离平衡的因素
(1)内因:弱电解质本身的性质——决定因素
(2)外因:
①温度:温度升高,电离平衡正向移动,电离程度增大。
②浓度:稀释溶液,电离平衡正向移动,电离程度增大。
③同离子效应:加入与弱电解质具有相同离子的强电解质,电离平衡逆向移动,电离程度减小。
④加入能反应的物质:电离平衡正向移动,电离程度增大。
相关文档
- 2019届高考化学一轮复习化学反应与2021-04-29 03:00:278页
- 2020版高考一轮复习化学通用版学案2021-04-28 17:51:426页
- 2020版高考一轮复习化学通用版学案2021-04-28 17:50:3913页
- 2020版高考一轮复习化学通用版学案2021-04-28 14:31:598页
- 2020版高考化学一轮复习化学能与热2021-04-28 12:51:4213页
- 2020届高考化学一轮复习化学反应速2021-04-28 11:03:2028页
- 步步高高考化学一轮复习化学物质及2021-04-28 01:59:2615页
- 2020届高考化学一轮复习化学平衡状2021-04-28 00:36:558页
- 2021届高考化学一轮复习化学反应速2021-04-27 23:28:5138页
- 2020届高考化学一轮复习化学平衡常2021-04-27 20:57:077页