- 637.50 KB
- 2021-04-28 发布
江苏省海安高级中学 2019-2020 学年高一 5 月月考试题
注意:本试卷分第一部分选择题和第二部分非选择题,共 100 分,考试时间 90 分钟。请将
答案填写到答题卡上相应区域。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al
-27
S-32 Cl-35.5 Fe-56 Cu-64
第Ⅰ卷(选择题,共 35 分)
一、单项选择题(本题包括 10 小题,每小题 2 分,共计 20 分。每小题只有一个....选项符合题
意。)
1.化学与生活、生产、环境等密切相关。下列说法错误的是( )
A.煤的液化、石油的裂化和油脂的皂化都属于化学变化
B.棉、丝、毛、油脂都是天然有机高分子化合物
C.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等
D.利用太阳能、风能和氢能等能源替代化石能源能有效改善空气质量
2.下列化学用语表达正确的是( )
A.N2 的电子式:
B.Cl-离子的结构示意图:
C.CH4 分子的比例模型:
D.质子数为 92、中子数为 146 的铀(U)原子符号:
3.高温条件下,Al 和 Fe3O4 反应生成 Fe 和 Al2O3。下列说法正确的是( )
A.该反应过程中的能量变化如图所示
B.该反应条件下,Al 的还原性弱于 Fe
C.实验室进行该反应时常加入 KClO3 作催化剂
D.1molFe3O4 参与反应转移 8×6.02×1023 个电子
4.下列有关化学反应速率和化学反应限度的叙述不正确...的是( )
A.Na 与水反应时,增加水的质量,能明显增大原反应的化学反应速率
B.制取乙酸乙酯时加入浓硫酸作催化剂并加热,可加快酯化反应的速率
C.实验室制取 H2 时,常用锌粉代替锌粒或滴加几滴 CuSO4 溶液可加快反应速率
D.一定条件下进行合成氨反应:N2+3H2 2NH3,N2 不可能完全转化为 NH3
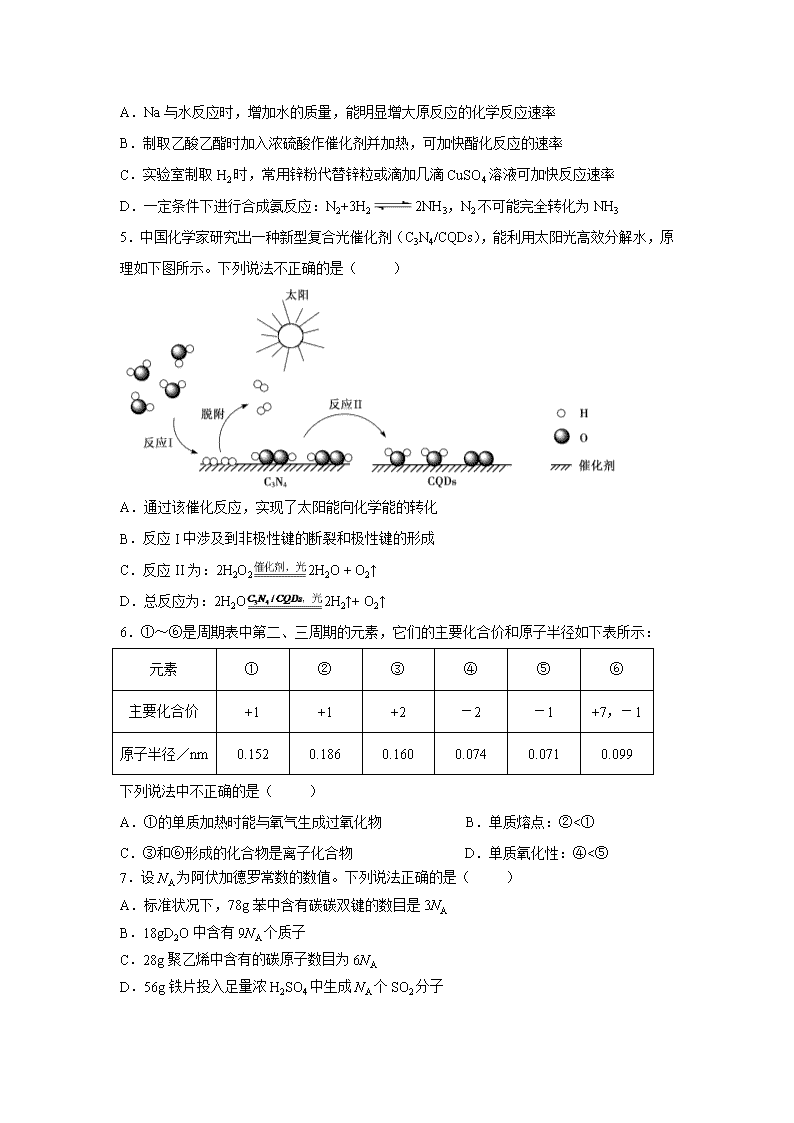
5.中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原
理如下图所示。下列说法不正确...的是( )
A.通过该催化反应,实现了太阳能向化学能的转化
B.反应 I 中涉及到非极性键的断裂和极性键的形成
C.反应 II 为:2H2O2 2H2O + O2↑
D.总反应为:2H2O 2H2↑+ O2↑
6.①~⑥是周期表中第二、三周期的元素,它们的主要化合价和原子半径如下表所示:
元素 ① ② ③ ④ ⑤ ⑥
主要化合价 +1 +1 +2 -2 -1 +7,-1
原子半径/nm 0.152 0.186 0.160 0.074 0.071 0.099
下列说法中不正确...的是( )
A.①的单质加热时能与氧气生成过氧化物 B.单质熔点:②<①
C.③和⑥形成的化合物是离子化合物 D.单质氧化性:④<⑤
7.设 NA 为阿伏加德罗常数的数值。下列说法正确的是( )
A.标准状况下,78g 苯中含有碳碳双键的数目是 3NA
B.18gD2O 中含有 9NA 个质子
C.28g 聚乙烯中含有的碳原子数目为 6NA
D.56g 铁片投入足量浓 H2SO4 中生成 NA 个 SO2 分子
8.有机物的结构可用“键线式”表示,如: 可简写为 。松油醇具有
紫丁香味,其酯类常用于香精调制,如图为松油醇的结构,以下关于它的说法正确的是
( )
A.分子式为 C10H19O
B.属于芳香烃
C.能发生取代、加成、氧化
D.与氢气加成后的产物有 4 种一氯化物
9.海洋中有丰富的资源,下图为海水资源利用的部分过程。
下列有关说法正确的是( )
A.工业上通过电解饱和 MgCl2 溶液制取金属镁
B.含氮、磷的大量废水排入海洋,易引发赤潮
C.反应④的离子方程式为:Br2+SO2+2H2O=2HBr+2H++ SO42—
D.在第①步中除去粗盐中的 SO2-
4 、Ca2+、Mg2+、Fe3+等杂质,加入药品的顺序为 Na2CO3
溶液→NaOH 溶液→BaCl2 溶液→过滤后加盐酸
10.控制变量是科学研究的重要方法。不同条件下,用 O2 氧化一定浓度的 FeCl2 溶液过程
中所测的实验数据如图所示。下列分析或推测不合理...的是( )
A.Fe2+的氧化率随时间延长而逐渐增大
B.由②和③可知,pH 越大,Fe2+氧化速率越快
C.由①和③可知,温度越高,Fe2+氧化速率越快
D.氧化过程的离子方程式为:4Fe2++O2 +4H+ ==4Fe3+ +2H2O
二、不定项选择题(本题包括 5 小题,每小题 3 分,共计 15 分。每小题有一个或两个.....选项
符合题意。若正确答案只包括一个选项,多选时,该题得 0 分;若正确答案包括两个选项,
只选一个且正确的得 1 分,选两个且都正确的得满分,但只要选错一个,该小题就得 0 分。)
11.翡翠是由 X、Y、Z、W 四种短周期元素组成的矿物,可表示为 XY[Z2W6],X、Y、W
元素的简单离子的电子层结构相同,X 的原子半径比 Y 的大,Z 的单质是常见的半导体材
料,W 是地壳中含量最多的元素。下列说法正确的是( )
A.Y在化合物中显+3 价
B.X 与 W 只能形成一种化合物
C.W 的简单氢化物稳定性比 Z 的强
D.X 的最高价氧化物对应的水化物碱性比 Y 的弱
12.下列是乙酸乙酯的制备、分离、提纯、性质验证的实验装置,下列有关说法正确的是
( )
选项 功能 装置 实验的操作或评价
A 制备 a
试管中 NaHCO3 溶液的作用:反应掉挥发的乙酸,溶解乙醇,
有利于乙酸乙酯的收集
B 蒸馏 b 应把温度计插入液面以下,以便准确测出各馏分的温度
C 分液 c 打开分液漏斗的旋塞,让乙酸乙酯缓缓流入烧杯中
D 水解 d 碱性条件下水解完全的标志为溶液不再分层
13.下列实验操作和现象与结论的关系不相符...的是( )
操作和现象 结论
A
将一小块钠分别投入盛有水和乙醇的小烧杯
中,钠与乙醇反应要平缓得多
乙醇羟基中的氢原子不如水分
子中的氢原子活泼
B
在催化剂存在的条件下,石蜡油加强热生成
的气体通入溴的四氯化碳溶液中,溶液褪色
石蜡油的分解产物中含有烯烃
C
向盛有大理石的锥形瓶中滴加稀盐酸,产生
无色气体
证明 Cl 的非金属性强于 C
D
向蔗糖溶液中加入稀硫酸,水浴加热一段时
间后,再加入新制 Cu(OH)2 悬浊液,用酒精
灯加热,未见红色沉淀
蔗糖未水解
14.利用反应 6NO2+8NH3=7N2+12H2O 设计的电池装置如图所示,该装置既能有效消除氮氧
化物的排放减轻环境污染,又能充分利用化学能。下列说法正确的是( )
A.电极 A 上发生氧化反应,电极 A 为正极
B.电池工作时,OH—从右向左迁移
C.当有 0.1molNO2 被处理时,外电路中通过电子 0.4mol
D.电极 B 的电极反应式为 2NO2+8e—+8H+=N2+4H2O
15.硫酸钙可用生产疏酸、漂白粉等一系列物质。下列说法正确的是( )
A.由 CO 与 H2 合成 CH3CH2OH 的反应中,原子利用率为 100%
B.向蔗糖中加入浓硫酸,蔗糖变黑并产生刺激性气味的气体,说明浓硫酸具有脱水性和强
氧化性
C.二氧化硫和漂白粉都能使品红溶液褪色,两者漂白性质相同
D.图中所有反应均为氧化还原反应
第Ⅱ卷(非选择题 共 65 分)
16.(14 分)现有 A、B、C、D、E 五种元素,它们的质子数依次增多。
①A 的核电荷数大于 2,可形成氢化物 H2A,该氢化物在常温下是液体;
②A 和 B 两元素可形成 B2A3 化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比 B3+离子多 8 个电子;
④C 与 D 元素可以形成化合物 CD;
⑤CD 的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中 E 处于 D 的下一个周期,E 单质可与冷水反应生成氢气,反应时 E 的单质与
生成的氢气的物质的量之比为 2:1。试回答:
(1)A 元素在周期表中的位置为 ▲ 、E 是 ▲ (填元素名称)。
(2) D 的单质分子的结构式 ▲ ,C 元素最高价氧化物的水化物的电子式
▲ 。
(3)写出工业上冶炼 B 单质的化学方程式 ▲ 。
(4)写出 CD 的溶液中通入氯气的离子方程式 ▲ 。
(5)比较 B、C、E 三种元素形成的简单离子氧化性的强弱:(B、C、E 离子用实际离子符号
表示)氧化性 ▲ 。
17.(13 分)CH4 既是一种重要的能源,也是一种重要的化工原料。
(1)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃
烧,其目的是 ▲ 。
(2)以 CH4 为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原
理如图甲所示,则通入 a 气体的电极名称为 ▲ ,通入 b 气体的电极反应式为
▲ 。(质子交换膜只允许 H+通过)
(3)在一定温度和催化剂作用下,CH4 与 CO2 可直接转化成乙酸,这是实现“减排”的一种研究
方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图乙所示,则该反应的最佳温度应
控制在 ▲ 左右。
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将 CuAlO2 溶解在稀硝酸中
生成两种盐并放出 NO 气体,其离子方程式为 ▲ 。
(4)CH4 还原法是处理 NOx 气体的一种方法。已知一定条件下 CH4 与 NOx 气体反应转化为 N2
和 CO2,若标准状况下 8.96L CH4 可处理 22.4L NOx 气体,则 x 值为 ▲ 。
18.(12 分)在某一容积为 2L 的恒容密闭容器中,A、B、C、D 四种气体物质发生可逆反应,
其物质的量 n(mol)随时间 t(min)的变化曲线如图所示。回答下列问题:
(1)该反应的化学方程式为 ▲ 。
(2)前 2min 内用 A 的浓度变化表示的化学反应速率为 ▲ ,
4min 时,v 正(A) ▲ v 逆(D) (填“>”“<”或“=”)。
(3)在 2min 时,图象发生改变的原因可能是 ▲ (填字母)
A.增大 B 的物质的量 B.降低温度
C.加入催化剂 D.减小 A 的物质的量
(4)能说明该反应已达到平衡状态的标志是 ▲ (填字母)。
A.消耗 5mol B 的同时生成 4molD
B.反应速率 4v(B) = 5v (D)
C.容器内 D 的浓度不再随时间而发生变化
D.容器内压强不再随时间而发生变化
E.容器内混合气体的密度不再随时间而发生变化
(5)由图示求得平衡时 A 的转化率为 ▲ 。
19.(16 分)以淀粉为主要原料合成一种具有果香味的物质 C 和化合物 D 的合成路线如下图
所示。
请回答下列问题:
(1)葡萄糖的结构简式为 ▲ ,B 分子中的官能团名称为 ▲ 。
(2)反应⑦中物质 X 的分子式为 ▲ ,反应⑧的类型为 ▲ 。
(3)反应③的化学方程式为 ▲ 。
(4)反应⑤的化学方程式为 ▲ 。反应⑥用于实验室制乙
烯,为除去其中可能混有的 SO2 应选用的试剂是 ▲ 。
(5)已知 D 的相对分子量为 118,其中碳、氢两元素的质量分数分别为 40.68%、5.08%,其余
为氧元素,则 D 的分子式为 ▲ 。
(6)检验反应①进行程度,需要的试剂有 ▲ 。
A.新制的 Cu(OH)2 悬浊液 B.碘水
C.NaOH 溶液 D.FeCl3 溶液
(7)乙烯的同系物丙烯(CH2=CH-CH3)可以通过加聚反应生成高分子化合物,其结构简式
是 ▲ 。
20.(10 分) 海洋是一个巨大的资源宝库。在海洋中生长的海带,富含碘元素。某同学设计
以下实验方案,从海带中提取 I2。
(1)灼烧海带时,除需酒精灯与三脚架外,还需要用到的实验仪器是 ▲ 。
(2)向滤液中加入双氧水和稀硫酸发生反应的离子方程式是 ▲ 。
(3)试剂 a 可以是 ▲ (填序号)。
A.酒精 B.四氯化碳
C.裂化汽油 D.苯
(4)I-和 IO3
-在酸性条件下生成 I2 的离子方程式是 ▲ 。
(5)上图中,含 I2 的溶液经 3 步转化为 I2 的悬浊液,其目的是 ▲ 。
【参考答案】
一、单项选择题(本题包括 10 小题,每小题 2 分,共 20 分)
1.B 2.C 3.D 4.A 5.B 6.A 7.B 8.C 9.B 10.B
二、不定项选择题(本题包括 5 小题,每小题 3 分,共 15 分。对 1 得 1 分,有错不得分。)
11.AC 12.D 13.CD 14.BC 15.B
16.(共 14 分,每空 2 分)
(1) 第 2 周期ⅥA 族 铯
(2) I—I
(3) 2Al2O3(熔融) =====
电解
冰晶石
4Al+3O2↑
(4)2I-+Cl2 ═ I2+2Cl- Al3+>K+>Cs+
17.(共 13 分,第(4)问 3 分,其余每空 2 分)
(1)提供 CH4 分解所需的能量
(2)负极 O2+4H++4e-=2H2O
(3)250℃ 3CuAlO2+16H++NO3—=3Cu2++3Al3++8H2O+NO↑
(4)1.6 (3 分)
18.(共 12 分,每空 2 分)
(1)4A(g)+5B(g) 6C(g)+4D(g) (2) 0.1mol/(L•min) =
(3) C (4) CD (5) 32%
19.(共 16 分,第(1)(2)问每空 1 分,其余每空 2 分)
(1)CH2OH(CHOH)4CHO (1 分) 羧基(1 分)
(2)Br2 (1 分) 取代反应(1 分)
(3) 2CH3CH2OH + 2O2 2CH3CHO + 2H2O (2 分)
(4) CH3CH2OH+ CH3COOH CH3COOCH2CH3 + H2O (2 分) NaOH 溶液(2 分)
(5) C4H6O4(2 分) (6)ABC (2 分) (7) (2 分)
20.(共 10 分,每空 2 分)
(1)坩埚、泥三角 (2)2I-+ H2O2 + 2H+ = I2 + 2H2O
(3)BD (4)5I-+IO3
-+6H+ = 3I2 + 3H2O (5)富集碘元素