- 1.36 MB
- 2021-04-27 发布
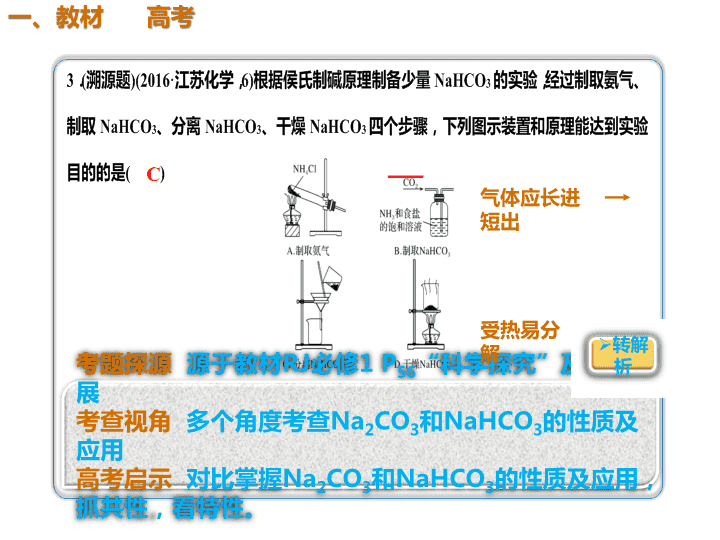
C
气体应长进
短出
受热易分
解
3.(2018·长郡中学高三大联考)实验室使用pH传感器来测定
Na2CO3和NaHCO3混合物中NaHCO3的含量。称取1.59 g样品,
溶于水配成250.00 mL溶液,取出该溶液25.00 mL用0.1 mol·L-1
盐酸进行滴定,得到如下曲线。以下说法正确的是( )
A.第一个计量点前发生反应的离子方程式为HCO3-+H+
===H2O+CO2↑
B.第二个计量点溶液中存在的大量阴离子是Cl-、HCO3-
C.此样品中n(NaHCO3)=(28.1-2×11.9)×10-3 mol
D.使用该方法测定Na2CO3和NaOH混合物中氢氧化钠含量,
将只会得到1个计量点
试
题
备
选
C
加入盐酸后,反应分3个阶段。得到3
个计量点
解析 根据图示知道上一个计量点前溶液显示碱性,发生的
离子反应:CO32-+H+===HCO3-,故A错误;下一个计量点溶
液pH=4,显示酸性,不能存在HCO3-,故B错误;Na2CO3和
NaHCO3混合物加盐酸,首先是碳酸钠转化为碳酸氢钠:CO32-
+H+===HCO3-,此时消耗的盐酸的体积为11.9 mL,随后是碳
酸氢钠转化为氯化钠的过程,HCO3-+H+===H2O+CO2↑,由
于CO32-+H+===HCO3-过程和HCO3-+H+===H2O+CO2过程消
耗的盐酸体积应该是相同的,所以样品中碳酸钠消耗的盐酸为
2×11.9 mL,则25 mL溶液中碳酸氢钠消耗的盐酸n(HCl)=(28.1
-2×11.9)×10-3L×0.1 mol·L-1=(28.1-2×11.9)×10-4mol,所
以此样品n(NaHCO3)=(28.1-2×11.9)×10-3mol,故C正确;
Na2CO3和NaOH混合溶液中加入盐酸,先与氢氧化钠中和,随
后与碳酸钠发生反应,生成碳酸氢钠,最后是生成氯化钠,不
止得到1个计量点,是3个计量点,故D错误。
(2017·北京海淀区期末)关于相同物质的量浓度的
NaHCO3溶液和Na2CO3溶液,下列说法不正确的是
( )
A.溶液中所含离子的种类相同
B.溶液的pH相同
C.都能与盐酸反应放出CO2气体
D.都能使澄清石灰水变浑浊
B
CO32-水解能力强于HCO3-
解析 Na2CO3溶液和NaHCO3溶液中都含有Na
+、H+、OH-、HCO3-、CO32-,都能与盐酸反应
放出CO2气体,都能使澄清石灰水变浑浊,故A、
C、D项正确;CO32-的水解程度大于HCO3-,故
溶液的pH:Na2CO3>NaHCO3,B项错误。
【试题备选】
Na2CO3、NaHCO3的鉴别
测定纯碱中Na2CO3质量分数的两种方法
相关文档
- 人教部编版语文 小学三年级下册教2021-04-27 15:07:4810页
- 人教版PEP小学五年级下册英语教学2021-04-27 15:05:4814页
- 人教版小学二年级上册数学教学课件2021-04-27 15:05:4412页
- 2020春六年级语文下册第三单元8匆2021-04-27 15:03:5145页
- 苏教版五年级数学上册第七单元解决2021-04-27 14:59:0117页
- 九年级英语上册Unit1Howcanwebe教2021-04-27 14:55:5118页
- 2018_2019学年四年级语文下册第三2021-04-27 14:54:4813页
- 四年级语文上册教学课件-8蝴蝶的家2021-04-27 14:52:4020页
- 人教版二年级上册数学教学课件-第22021-04-27 14:44:4610页
- 苏教版六年级数学下册期末考试复习2021-04-27 14:44:3221页