- 183.00 KB
- 2021-04-23 发布
专题:高考实验重要考点
1、 如何从氯化钠溶液中获得NaCl固体(溶解度受温度变化影响较小的):
2、 如何从硫酸铜溶液中获得CuSO4·5H2O ?
3、 除去氯化钠溶液中少量KNO3杂质?
4、 能不能直接蒸发CuCl2溶液结晶得到CuCl2·2H2O晶体? 。若不能正确的操作是 。
5、如何由CuCl2·2H2O晶体得到无水CuCl2固体 。
题源:在测定Na2SO4和NaCl的混合物中Na2SO4的质量分数时,可以向混合溶液中加入过量的氯化钡溶液,沉淀SO42—,然后过滤、洗涤、烘干、称量硫酸钡的质量。
6、怎样判断SO42—离子是否沉淀完全?
。
7、洗涤沉淀的方法?
。
8、如何判断沉淀知否洗净?
9、温度计的使用:
(1)蒸馏: 。
(2)恒温加热:如水浴加热:苯的硝化反应:用50℃——60℃的水浴加热,
温度计应该 。
(3)测反应液的温度:温度计的水银球应 中。
如中和热的测定、实验室制乙烯——用乙醇和浓硫酸迅速加热到170℃
10、FeCl2溶液的保存方法 。
11、除去除去CuCl2溶液中的FeCl3杂质的试剂是 。
原因是
(用离子方程式和简练的语言说明)。
12、除去除去MgCl2溶液中的FeCl2杂质的试剂是 、 。
13、某溶液中一定含有Fe3+,如何证明此溶液中是否含有Fe2+ 试剂是:
(1) (2) 。
14、双氧水(H2O2)的重要考点归纳
(1)强氧化性
优点:
用途:杀菌、消毒、漂白
(2)不稳定性——加热下或在某些物质如 、 、 催化下会分解,方程式是 。
有双氧水实验题或流程图题注意事项是 。
(3)弱还原性——产物是氧气。写出双氧水使酸性高锰酸钾溶液的离子方程式:
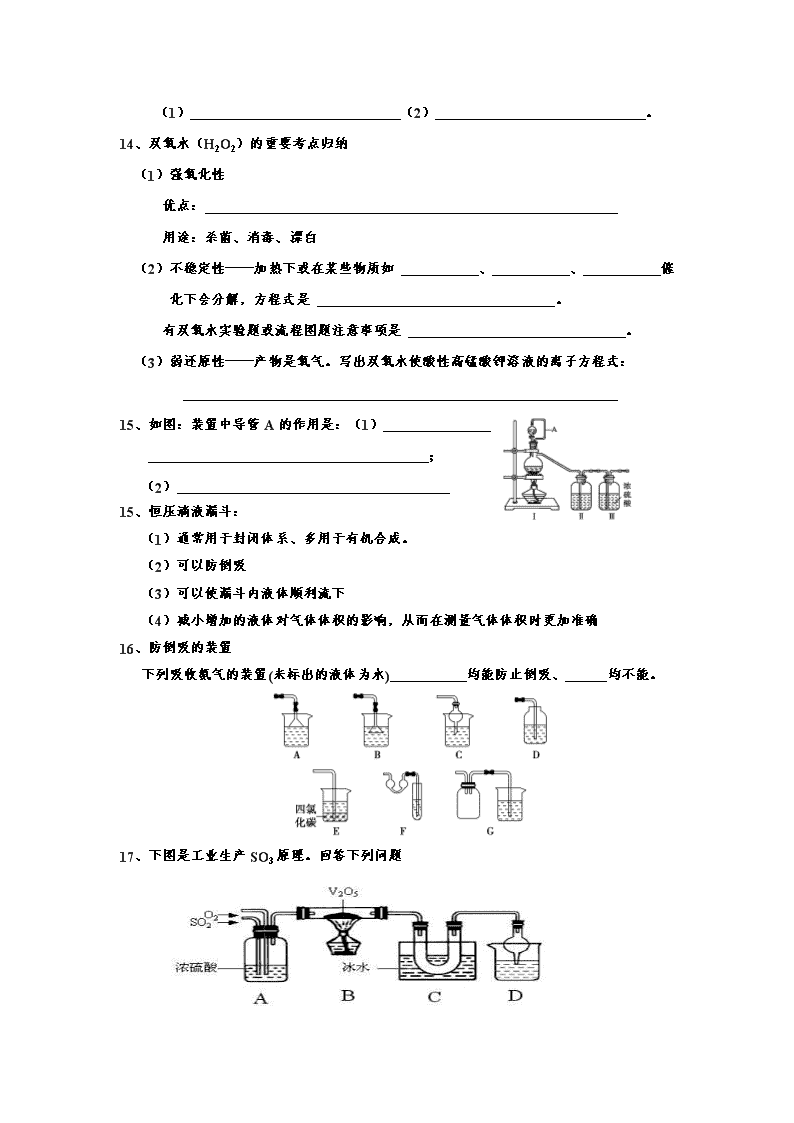
15、如图:装置中导管A的作用是:(1)
;
(2)
15、恒压滴液漏斗:
(1)通常用于封闭体系、多用于有机合成。
(2)可以防倒吸
(3)可以使漏斗内液体顺利流下
(4)减小增加的液体对气体体积的影响,从而在测量气体体积时更加准确
16、防倒吸的装置
下列吸收氨气的装置(未标出的液体为水) 均能防止倒吸、 均不能。
17、下图是工业生产SO3原理。回答下列问题
(1)装置A的作用是 ;
。
(2)装置C的作用是
(3)装置D的作用是
18、写出木炭与浓硫酸在加热条件下反应的化学方程式 ;设计实验:检验气体产物的试剂和试剂的作用:
步骤1:试剂是 ;作用是
步骤2:试剂是 ;作用是
步骤3:试剂是 ;作用是
步骤4:试剂是 ;作用是
步骤5:试剂是 ;作用是
19、定量测定型实验题
(1)气体体积的测量——量气体体积时应注意的问题
① 。
② 。
。
(2)测定实验中要有消除干扰气体的意识。
如用“惰性”气体将干扰气体排出。
例如:已知某纯碱样品中含有少量NaCl杂质,为测定该样品中纯碱的质量分数,可
用如图所示的装置进行实验。
其中:A处先通入足量的空气的作用是
NaOH溶液的作用是
B的作用是 。
(3)测定实验中要有被测量气体全部被测量的意识
可采取反应结束后继续向装置中通入“惰性”气体以使被测量气体全部被吸收剂吸收。
如2中:当不再产生气体时,从A口再缓缓鼓入一定量空气的作用是 。
(4)测定实验中要有“数据”的处理意识。
称量固体质量时,中学一般用托盘天平,可估读到 g。
测量液体体积时,选用适当规格的量筒,可估读到 ml;准确度要求高的定量实验:如中和滴定中选用滴定管,可估读到 ml。
气体除了量取外,还可以称量。称气体的质量时一般有两种方法:
a、称反应装置在放出气体前后的质量减小值;
b、称吸收装置前后的质量增大值。
为了数据的准确性,实验中要采取必要的措施,确保离子完全沉淀、气体完全被吸收
等,必要时可以进行平行实验,重复测定,然后取其平均值进行计算。如中和滴定实
验中测量酸或碱的体积要平行做2~3次滴定,取体积的平均值求算未知溶液的浓度,
对于“离群”数据的处理意识—要舍弃。产生的原因可能是操作中出现了较大的误差。