- 375.50 KB
- 2021-04-22 发布
安徽省滁州市定远县育才学校2019-2020学年高一上学期期末考试(实验班)试题
1.下列化学物质在生活、生产的运用描述不正确的是( )
A. 氢氧化钠能与二氧化硅反应,故常用氢氧化钠在玻璃上进行刻画
B. 工业上常用氨气来检查氯气管道是否泄漏
C. 氧化铝俗名刚玉,耐磨,常用于做轴承材料
D. 钠和鉀的合金呈液态,常做核反应堆的导热剂
【答案】A
【解析】常用氢氟酸在玻璃上进行刻画,故A错误;氨气与氯气反应生成氮气和氯化铵,有白烟生成,故B正确;氧化铝硬度大耐磨,故C正确;合金的熔点低于成分金属的熔点,故D正确。
2.下列有关物质的分离和提纯的方法中正确的是( )
A. 除去Cl2的HCl气体可以通过浓硫酸
B. 碳酸钠固体中碳酸氢钠杂质可以通过加热除去
C. SO2可以通过碱石灰干燥
D. FeCl3溶液中含有CuCl2可以加入足量NaOH溶液除去
【答案】B
【解析】
【详解】A. 除去Cl2的HCl气体可以通过饱和食盐水,故A错误;
B. 碳酸氢钠加热生成碳酸钠、二氧化碳、水,故B正确;
C. 碱石灰可以吸收SO2,故C错误;
D. FeCl3溶液中含有CuCl2可以加入足量NaOH溶液生成氢氧化铁、氢氧化铜两种沉淀,故D错误。
3.下列离子方程式中,错误的是( )
A. 在浓NaOH溶液中滴入几滴NH4Cl溶液:NH4+ + OH- = NH3↑ + H2O
B. 铁与盐酸反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
C. 将少量铜屑放入浓硝酸中:Cu + 4H+ + 2NO3- = Cu2+ + 2NO2↑+ 2H2O
D. 氯气与烧碱溶液反应:Cl2 + 2OH- = Cl- + ClO- + H2O
【答案】B
【解析】
【详解】A. 在浓NaOH溶液中滴入几滴NH4Cl溶液放出氨气:NH4++OH-=NH3↑+H2O,A错误;
B. 铁与盐酸反应生成氯化亚铁:Fe+2H+=Fe2++H2↑,B错误;
C. 将少量铜屑放入浓硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,C正确;
D 氯气与烧碱溶液反应生成氯化钠、次氯酸钠和水:Cl2+2OH-=Cl-+ClO- +H2O,D正确;
答案选B。
4.下列关于氢氧化铁胶体的说法不正确的是:( )
A. 往NaOH饱和溶液中滴加FeCl3饱和溶液,加热煮沸制备氢氧化铁胶体
B. 氢氧化铁胶体的胶粒大小在1-100nm之间
C. 氢氧化铁胶体可发生丁达尔效应
D. 往氢氧化铁胶体中滴加电解质溶液可发生聚沉现象
【答案】A
【解析】
【详解】A.往NaOH饱和溶液中滴加FeCl3饱和溶液,得到氢氧化铁红褐色沉淀,故A错误;
B.胶体的胶粒大小在1-100nm之间,这是胶体区别与其它分散系的本质特征,故B正确;
C.胶体可发生丁达尔效应,可借助此性质区分胶体与溶液,故C正确;
D.往氢氧化铁胶体的胶粒带电,滴加电解质溶液可发生聚沉现象,故D正确;
答案为A。
5.证明某溶液只含有Fe 2+而不含Fe 3+的实验方法是( )
A. 只需滴加KSCN溶液
B. 先滴加氯水,再滴加KSCN溶液后显红色
C. 先滴加KSCN溶液,不显红色,再滴加氯水后显红色
D. 滴加NaOH溶液,产生红褐色沉淀。
【答案】C
【解析】
【分析】先根据Fe3+的特征反应判断溶液不含Fe3+;然后加入氧化剂,如果含有Fe2+,Fe2+被氧化剂氧化成Fe3+溶液变成红色,从而证明Fe2+的存在。
【详解】A.只滴加KSCN溶液,根据溶液是否显红色,能检验出溶液中是否含有Fe3+,无法验证Fe2+存在,故A错误;B.先滴加氯水,氯气将Fe2+氧化成Fe3+,即使原溶液不含Fe3+,滴加KSCN溶液后也显红色,无法证明原溶液是否含有Fe3+,故B错误;C.KSCN与Fe3+作用使溶液显红色,与Fe2+作用无此现象,先滴加KSCN溶液,不显红色,说明原溶液不含有Fe3+,再滴加氯水后显红色,说明滴加氯水后溶液中有Fe3+,证明原溶液含有Fe2+,故C正确;D.滴加NaOH溶液,产生红褐色沉淀,说明含有Fe3+,无法验证Fe2+存在,故D错误;故选C。
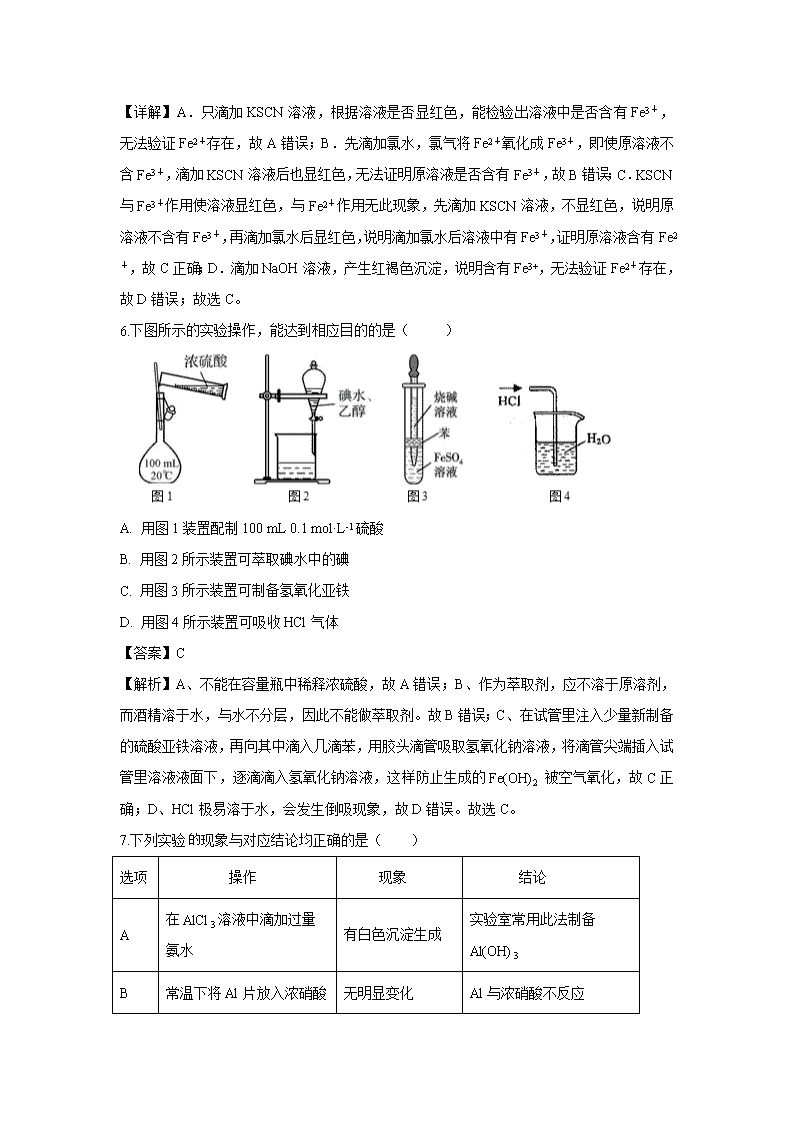
6.下图所示的实验操作,能达到相应目的的是( )
A. 用图1装置配制100 mL 0.1 mol·L-1硫酸
B. 用图2所示装置可萃取碘水中的碘
C. 用图3所示装置可制备氢氧化亚铁
D. 用图4所示装置可吸收HCl气体
【答案】C
【解析】A、不能在容量瓶中稀释浓硫酸,故A错误;B、作为萃取剂,应不溶于原溶剂,而酒精溶于水,与水不分层,因此不能做萃取剂。故B错误;C、在试管里注入少量新制备的硫酸亚铁溶液,再向其中滴入几滴苯,用胶头滴管吸取氢氧化钠溶液,将滴管尖端插入试管里溶液液面下,逐滴滴入氢氧化钠溶液,这样防止生成的Fe(OH)2 被空气氧化,故C正确;D、HCl极易溶于水,会发生倒吸现象,故D错误。故选C。
7.下列实验现象与对应结论均正确的是( )
选项
操作
现象
结论
A
在AlCl3溶液中滴加过量氨水
有白色沉淀生成
实验室常用此法制备Al(OH)3
B
无明显变化
Al与浓硝酸不反应
常温下将Al片放入浓硝酸中
C
取少量Fe(NO3)2试样加水溶解,加稀H2SO4酸化
滴加KSCN溶液,溶液变为红色
该Fe(NO3)2试样已经变质
D
将水蒸气通过灼热的铁粉
粉末变红
铁与水在高温下发生反应
【答案】A
【解析】A.氢氧化铝不溶于氨水,所以实验室常用此法制备Al(OH)3,所以现象与结论都正确,故A正确;B.常温下将Al片放入浓硝酸发生钝化现象,而不是不反应,结论错误,故B错误;C.NO3-在酸性条件下能氧化Fe2+,无法判断Fe(NO3)2试样已经变质,故C错误;D.铁与水蒸气反应生成四氧化三铁,不生成氧化铁,所以现象与结论都错误,故D错误;故选A。
8. 向某无色溶液中分别进行下列操作,所得现象和结论正确的是( )
A. 加入氨水,产生白色沉淀,证明原溶液中存在Al3+
B. 加入AgNO3溶液,产生白色沉淀,证明原溶液中存在Cl-
C. 加入盐酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中存在SO42-
D. 加入NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,证明原溶液中存在NH4+
【答案】D
【解析】
【详解】A.加入氨水,产生白色沉淀,该白色沉淀可能为氢氧化镁,原溶液中可能存在镁离子,不一定含有Al3+,故A错误;
B.加入AgNO3溶液,产生白色沉淀,该白色沉淀可能为碳酸银,原溶液中可能含有碳酸根离子,不一定含有Cl-,故B错误;
C.加入盐酸酸化的BaCl2溶液,生成白色沉淀,该白色沉淀可能为氯化银,原溶液中可能含有银离子,不一定含有SO42-,故C错误;
D.加入NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,该气体为氨气,证明原溶液中一定存在NH4+,故D正确;
故答案为D。
9.如图装置,将溶液A逐渐加入固体B中,下列叙述中不正确的是( )
A. 若a为浓硫酸,b为Na2SO3固体,c中盛石蕊溶液,则c中溶液先变红后褪色
B. 若a为浓盐酸,b为MnO2,c中盛品红溶液,则c中溶液不褪色
C. 若a为醋酸溶液,b为贝壳,c中盛过量澄清石灰水,则c中溶液变浑浊
D. 若a为浓氨水,b为生石灰,c中盛AlCl3溶液,则c中产生白色沉淀
【答案】A
【解析】
【详解】A.二氧化硫只能使石蕊溶液变红,不能使其褪色,A错误;
B.浓盐酸与MnO2常温下不反应,B正确;
C.醋酸溶液与贝壳反应生成二氧化碳,二氧化碳能使澄清石灰水变浑浊,C正确;
D.浓氨水与生石灰生成氨气,AlCl3溶液与氨气反应生成氢氧化铝沉淀,D正确。
答案为A。
10. 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系如图所示。则甲和X不可能是( )
A. 甲为C,X为O2
B. 甲为SO2,X为NaOH溶液
C. 甲为Fe,X为Cl2
D. 甲AlCl3溶液,X为NaOH溶液
【答案】C
【解析】
【详解】A. 若甲为C,则乙为一氧化碳,丙为二氧化碳。
B. 甲为二氧化硫,则乙为亚硫酸氢钠,丙为亚硫酸钠,正确。
C. 氯气只能一步和铁反应生成氯化铁。所以错误。
D. 甲为氯化铝,则乙为氢氧化铝,丙为偏铝酸钠,正确。
11.下列反应的离子方程式书写正确的是( )
A. 4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合 :4AlO2-+7H++H2O=3Al(OH)3↓+Al3+
B. 硫酸氢钠溶液与氢氧化钡溶液混合显中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
C. 稀硝酸中加入过量的铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O
D. 向AlCl3溶液中加入过量氨水:Al3+ + 4 NH3·H2O=AlO2-+4NH4++2H2O
【答案】A
【解析】
【详解】A项正确,NaAlO2和HCl按物质的量之比4:7反应:4NaAlO2+ H2O +7HCl=4NaCl+AlCl3+3 Al(OH)3↓,所以离子方程式为:4AlO2-+7H++H2O=3Al(OH)3↓+Al3+;
B项错误,应为:2H++SO42ˉ+Ba2++2OH-=H2O+BaSO4↓;
C项错误,应为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;
D项错误,应为:Al3++3NH3·H2O=Al(OH)3↓+3NH4+。
综上所述,B、C、D项错误,符合题意的选项为A。
12.向只含有Fe3+、Cu2+、H+各0.1mol及a mol SO42-的某溶液中加入足量锌粉,搅拌使其充分反应,下列说法中正确的是( )
A. 当消耗13克Zn时, 得到的还原产物为0.25mol
B. 当溶液中不再产生气泡时,溶液中大量存在的阳离子只有Zn2+
C. 反应中最多有两种单质生成
D. 反应结束时,可得到0.25molZnSO4
【答案】A
【解析】
【分析】三种阳离子氧化性大小顺序是Fe3+、Cu2+、H+,所以首先还原的是Fe3+、然后是Cu2+,最后是H+,据此分析作答。
【详解】A. 13g锌是0.2mol,失去0.4mol电子,所以根据电子的得失守恒可知,还原产物应该是0.1mol亚铁离子、0.1mo铜和0.05mol氢气,故A正确;
B. 含有亚铁离子,故B错误;
C. 锌足量还能生成单质铁,故C错误;
D. 应该是0.30mol硫酸锌,故D错误;
答案选A。
13.将一定量的氯气通入30 mL浓度为10.00 mol·L-1的氢氧化钠溶液中,加热一段时间后,溶液中形成NaCl、NaClO、NaClO3的共存体系。下列判断正确的是( )
A. 与NaOH反应的氯气一定为0.3 mol
B. 若反应中转移的电子为n mol,则0.15