- 498.50 KB
- 2021-04-15 发布
专题二十三 选修3物质结构与性质(解析版)
1.【2019新课标Ⅰ卷】在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是 (填标号)。
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是 、
。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是 ,其中与乙二胺形成的化合物稳定性相对较高的是 (填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:
氧化物
Li2O
MgO
P4O6
SO2
熔点/℃
1570
2800
23.8
﹣75.5
解释表中氧化物之间熔点差异的原因 。
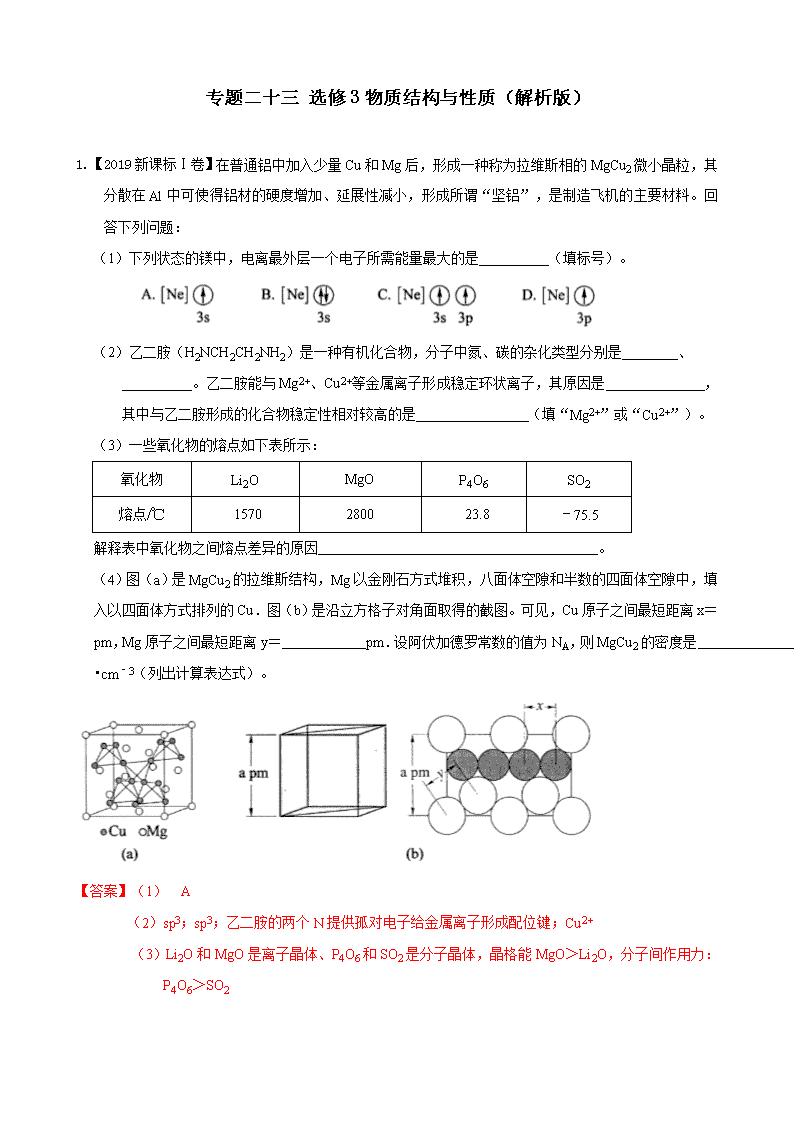
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu.图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x= pm,Mg原子之间最短距离y= pm.设阿伏加德罗常数的值为NA,则MgCu2的密度是 g•cm﹣3(列出计算表达式)。
【答案】(1) A
(2)sp3;sp3;乙二胺的两个N提供孤对电子给金属离子形成配位键;Cu2+
(3)Li2O和MgO是离子晶体、P4O6和SO2是分子晶体,晶格能MgO>Li2O,分子间作用力:P4O6>SO2
(4) a;a;
【解析】
(1)AD微粒都是Mg原子失去一个电子后得到的,但是D微粒能量高于A,稳定性A>D,所以失电子能量A>D;BC都是原子,但是B是基态、C是激发态,能量:C>B,稳定性B>C,所以失去一个电子能量:B>C;A微粒是B失去一个电子得到的,且A轨道中电子处于半满状态,较稳定,所以失去一个电子能力A>B,
通过以上分析知,电离最外层一个电子所需能量最大的是A,
故答案为:A;
(2)每个N原子形成的共价键有2个N﹣H键、1个N﹣C键,且还含有1个孤电子对;每个C原子形成的共价键有2个C﹣H键、2个C﹣N键,所以N、C原子价层电子对个数都是4,根据价层电子对互斥理论判断N、C原子杂化类型分别为sp3、sp3;含有孤电子对的原子和含有空轨道的原子之间易形成配位键,乙二胺的两个N提供孤对电子给金属离子形成配位键,所以乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子;碱土金属与乙二胺形成的化合物稳定性较弱,所以与乙二胺形成的化合物稳定性相对较高的是Cu2+.
(3)晶体熔沸点:离子晶体>分子晶体,离子晶体熔沸点与晶格能有关,晶格能越大熔沸点越高,晶格能与离子半径成反比,与电荷成正比,分子晶体熔沸点与分子间作用力有关,分子间作用力与相对分子质量有关,相对分子质量越大其分子间作用力越大,Li2O和MgO是离子晶体、P4O6和SO2是分子晶体,且晶格能MgO>Li2O,分子间作用力:P4O6>SO2,所以熔沸点:MgO>Li2O>P4O6>SO2.
(4)如图所示,AB之间的距离为面对角线长度=apm,AB之间距离相当于4个Cu原子直径,x距离1个Cu原子直径=;
体对角线长度=棱长=×apm,CD距离为y,该长度为体对角线BC长度的
=××apm=apm;该晶胞中Mg原子位于8个顶点上、6个面心上,在晶胞内部有4个Mg原子,所以Mg原子个数=8×+6×+4=8,Cu原子都位于晶胞内部,有16个;
晶胞体积=(a×10﹣10 cm)3,晶胞密度==g/cm3=g/cm3。
2.【2019新课标Ⅱ卷】近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe−Sm−As−F−O组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为_______,其沸点比NH3的_______(填“高”或“低”),其判断理由是_________________________。
(2)Fe成为阳离子时首先失去______轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为______________________。
(3)比较离子半径:F−__________O2−(填“大于”等于”或“小于”)。
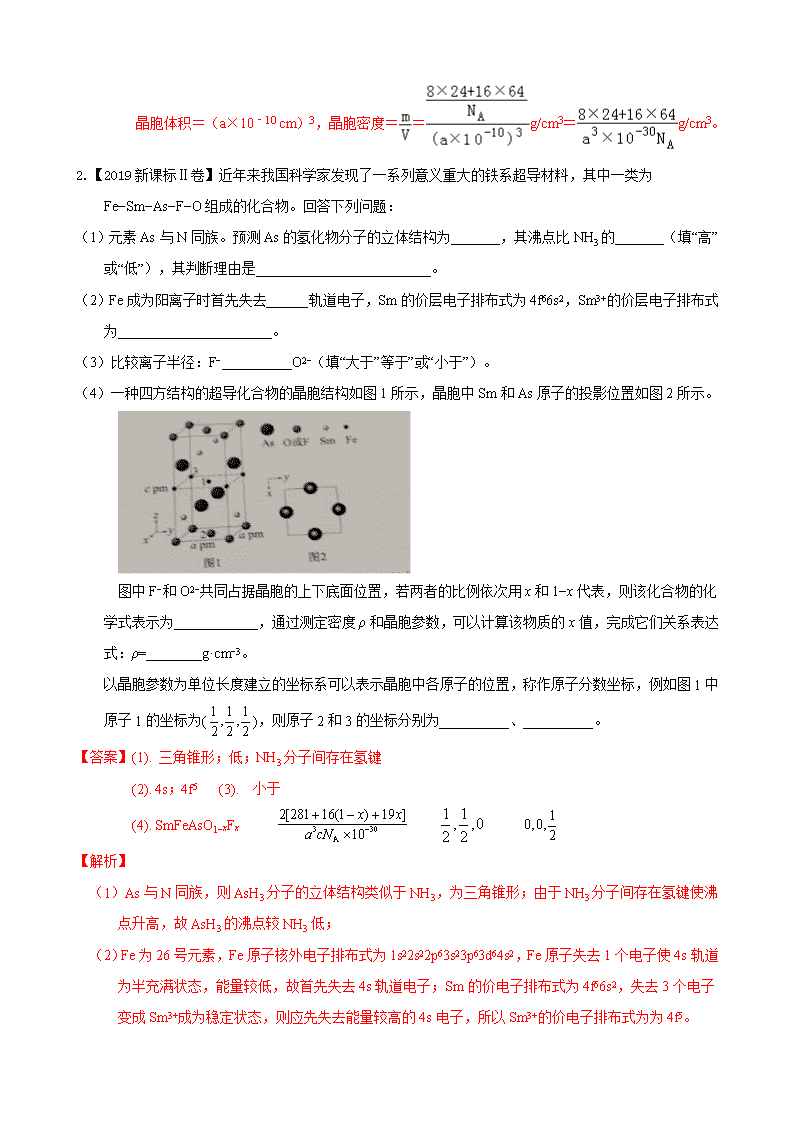
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。
图中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为____________,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________g·cm−3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(),则原子2和3的坐标分别为__________、__________。
【答案】(1). 三角锥形;低;NH3分子间存在氢键
(2). 4s;4f5 (3). 小于
(4). SmFeAsO1−xFx
【解析】
(1)As与N同族,则AsH3分子的立体结构类似于NH3,为三角锥形;由于NH3分子间存在氢键使沸点升高,故AsH3的沸点较NH3低;
(2)Fe为26号元素,Fe原子核外电子排布式为1s22s22p63s23p63d64s2,Fe原子失去1个电子使4s轨道为半充满状态,能量较低,故首先失去4s轨道电子;Sm的价电子排布式为4f66s2,失去3个电子变成Sm3+成为稳定状态,则应先失去能量较高的4s电子,所以Sm3+的价电子排布式为为4f5。
(3)F-和O2-的核外电子排布相同,核电荷数越大,则半径越小,故半径:F-
相关文档
- 【化学】贵州省正安县第二中学20192021-04-15 17:03:5110页
- 高考语文真题汇编分类2014年考点232021-04-15 17:03:344页
- 2018高考立体几何复习最新题型归纳2021-04-15 17:03:3431页
- 安徽省2020届高三名校高考冲刺模拟2021-04-15 17:03:2711页
- 上海高考试卷生物2021-04-15 17:03:0713页
- 数学高考试题模拟新题分类汇编专题2021-04-15 17:02:498页
- 2020版高考地理一轮复习第6章第162021-04-15 17:02:492页
- 2019届高三高考政治大二轮专题精讲2021-04-15 17:02:3149页
- 高考学习计划2021-04-15 17:02:182页
- 高考英语全程训练计划高考仿真模拟2021-04-15 17:02:0717页