- 725.00 KB
- 2021-06-23 发布
高2015级高二(上)期中试题
化 学
可能用到的相对原子量: H 1 Cu 64 N 14 O 16
第І卷 选择题
一、选择题(每小题只有一个最佳选项,每小题2分,共40分)
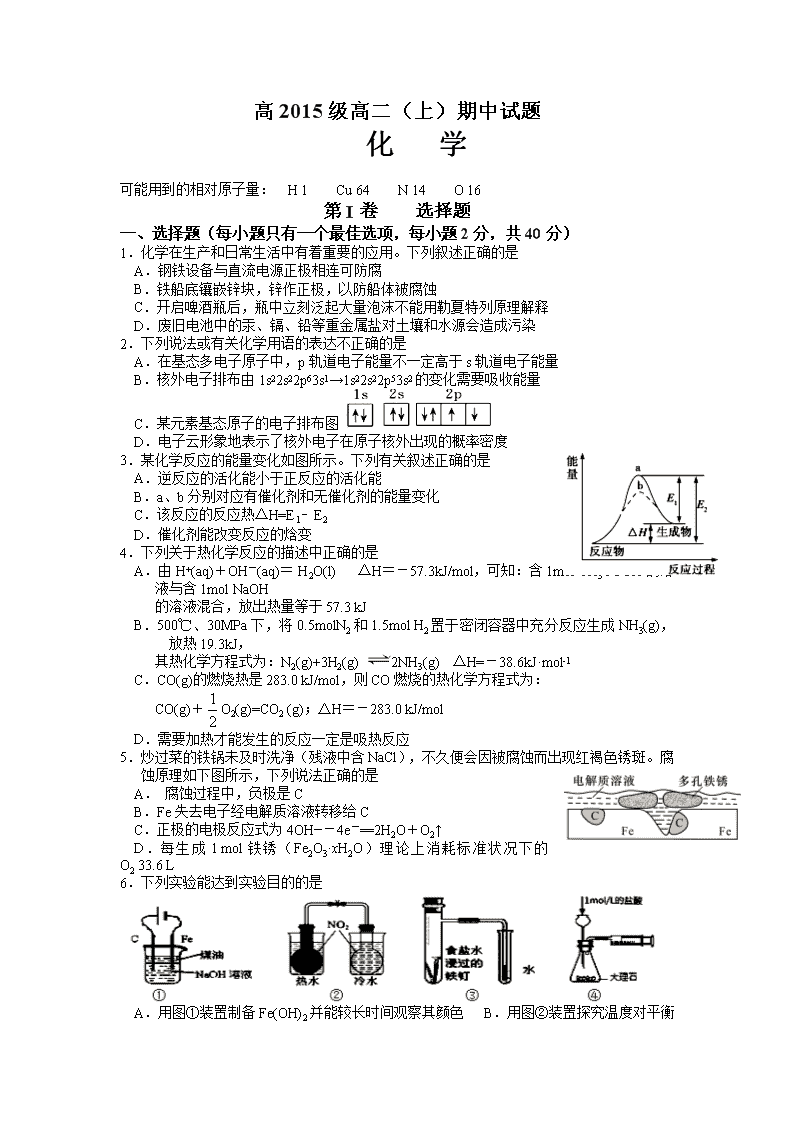
1.化学在生产和日常生活中有着重要的应用。下列叙述正确的是
A.钢铁设备与直流电源正极相连可防腐
B.铁船底镶嵌锌块,锌作正极,以防船体被腐蚀
C.开启啤酒瓶后,瓶中立刻泛起大量泡沫不能用勒夏特列原理解释
D.废旧电池中的汞、镉、铅等重金属盐对土壤和水源会造成污染
2.下列说法或有关化学用语的表达不正确的是
A.在基态多电子原子中,p轨道电子能量不一定高于s轨道电子能量
B.核外电子排布由1s22s22p63s1→1s22s22p53s2的变化需要吸收能量
C.某元素基态原子的电子排布图
D.电子云形象地表示了核外电子在原子核外出现的概率密度
3.某化学反应的能量变化如图所示。下列有关叙述正确的是
A.逆反应的活化能小于正反应的活化能
B.a、b分别对应有催化剂和无催化剂的能量变化
C.该反应的反应热△H=E1﹣E2
D.催化剂能改变反应的焓变
4.下列关于热化学反应的描述中正确的是
A.由H+(aq)+OH-(aq)= H2O(l) △H=-57.3kJ/mol,可知:含1mol CH3COOH的溶液与含1mol NaOH
的溶液混合,放出热量等于57.3 kJ
B.500℃、30MPa下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,
其热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-38.6kJ·mol-1
C.CO(g)的燃烧热是283.0 kJ/mol,则CO燃烧的热化学方程式为:
CO(g)+O2(g)=CO2 (g);△H=-283.0 kJ/mol
D.需要加热才能发生的反应一定是吸热反应
5.炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如下图所示,下列说法正确的是
A. 腐蚀过程中,负极是C
B.Fe失去电子经电解质溶液转移给C
C.正极的电极反应式为4OH―-4e-==2H2O+O2↑
D.每生成1 mol铁锈(Fe2O3·xH2O)理论上消耗标准状况下的O2 33.6 L
6.下列实验能达到实验目的的是
A.用图①装置制备Fe(OH)2并能较长时间观察其颜色 B.用图②
装置探究温度对平衡移动的影响
C.用图③装置验证铁发生析氢腐蚀 D.用图④装置测定反应速率
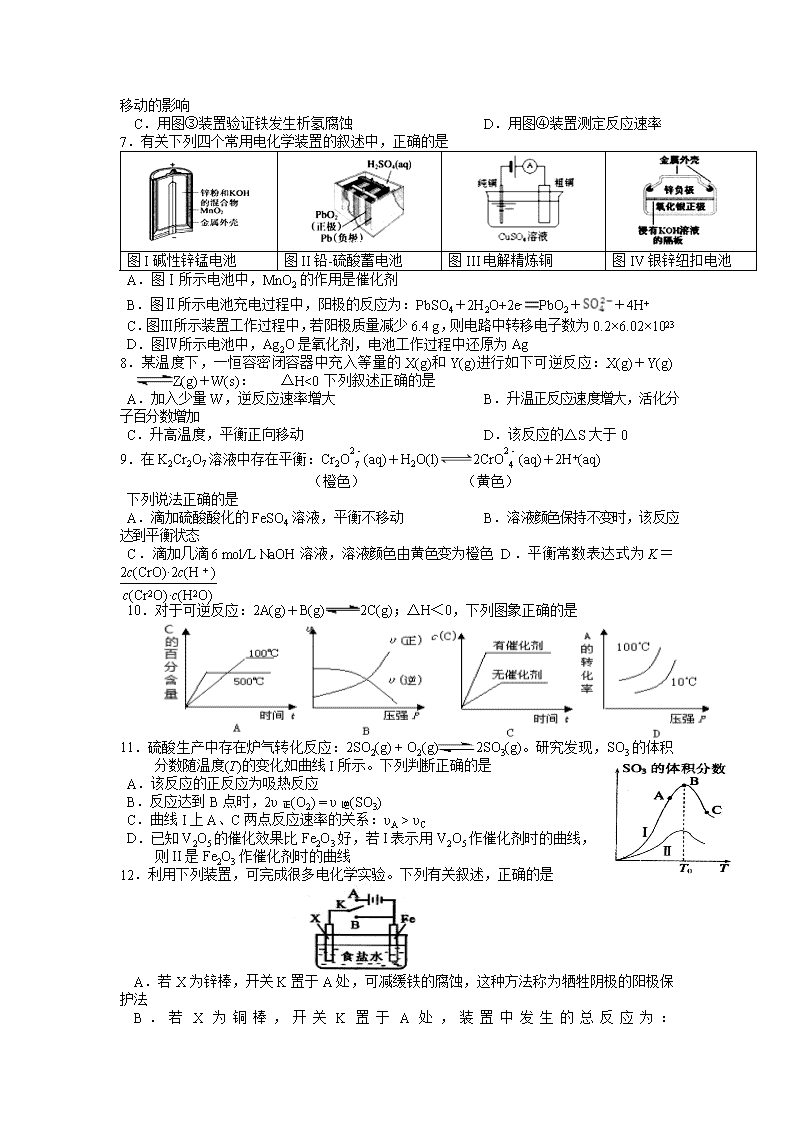
7.有关下列四个常用电化学装置的叙述中,正确的是
图I碱性锌锰电池
图II铅-硫酸蓄电池
图III电解精炼铜
图IV银锌纽扣电池
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池充电过程中,阳极的反应为:PbSO4+2H2O+2e-PbO2++4H+
C.图Ⅲ所示装置工作过程中,若阳极质量减少6.4 g,则电路中转移电子数为0.2×6.02×1023
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
8.某温度下,一恒容密闭容器中充入等量的X(g)和Y(g)进行如下可逆反应:X(g)+Y(g)Z(g)+W(s): △H<0下列叙述正确的是
A.加入少量W,逆反应速率增大 B.升温正反应速度增大,活化分子百分数增加
C.升高温度,平衡正向移动 D.该反应的△S大于0
9.在K2Cr2O7溶液中存在平衡:Cr2O(aq)+H2O(l)2CrO(aq)+2H+(aq)
(橙色) (黄色)
下列说法正确的是
A.滴加硫酸酸化的FeSO4溶液,平衡不移动 B.溶液颜色保持不变时,该反应达到平衡状态
C.滴加几滴6 mol/L NaOH溶液,溶液颜色由黄色变为橙色 D.平衡常数表达式为K=
10.对于可逆反应:2A(g)+B(g)2C(g);△H<0,下列图象正确的是
11.硫酸生产中存在炉气转化反应:2SO2(g) + O2(g)2SO3(g)。研究发现,SO3的体积分数随温度(T)的变化如曲线I所示。下列判断正确的是
A.该反应的正反应为吸热反应
B.反应达到B点时,2υ正(O2) = υ逆(SO3)
C.曲线I上A、C两点反应速率的关系:υA > υC
D.已知V2O5的催化效果比Fe2O3好,若I表示用V2O5作催化剂时的曲线,
则II是Fe2O3作催化剂时的曲线
12.利用下列装置,可完成很多电化学实验。下列有关叙述,正确的是
A.若X为锌棒,开关K置于A处,可减缓铁的腐蚀,这种方法称为牺牲阴极的阳极保护法
B.若X为铜棒,开关K置于A处,装置中发生的总反应为:2NaCl+2H2O2NaOH+Cl2+H2
C.若X为碳棒,开关K置于B处,向食盐水中滴入酚酞溶液可看到碳棒附近先变红
D.若X为锌棒,开关K置于B处,在铁棒附近滴入铁氰化钾溶液可看到溶液中有蓝色沉淀生成
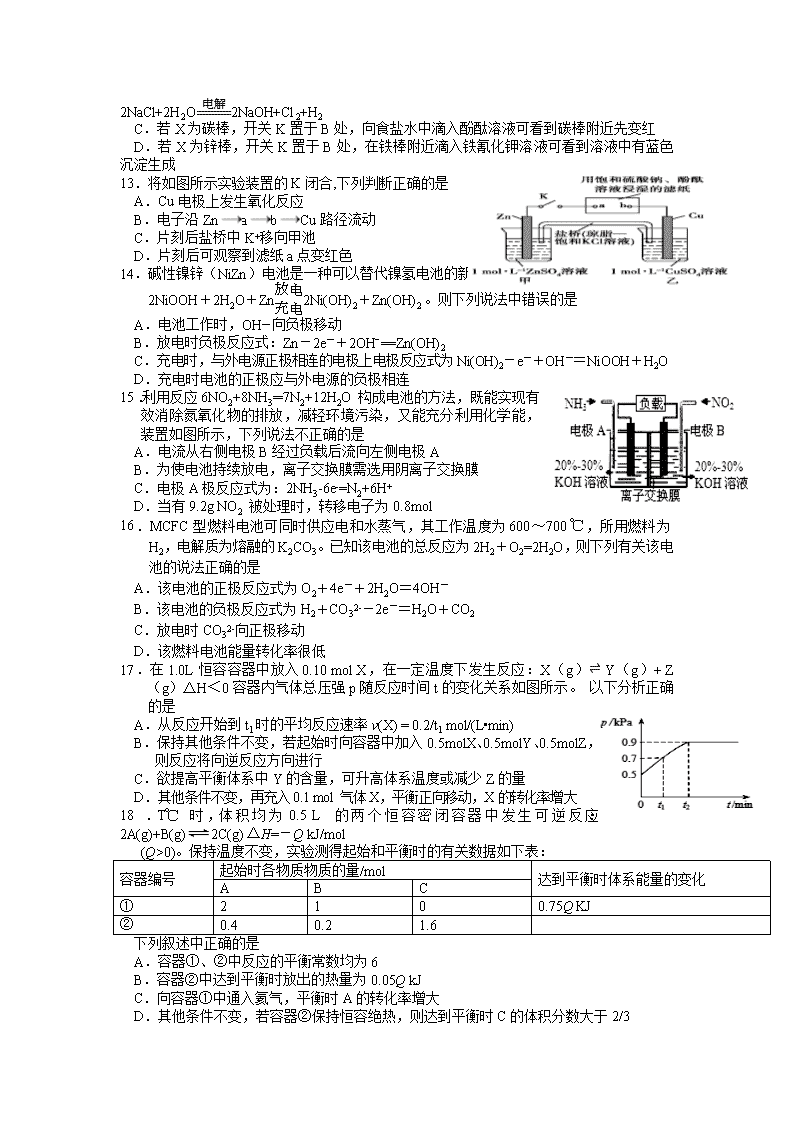
13.将如图所示实验装置的K闭合,下列判断正确的是
A.Cu电极上发生氧化反应
B.电子沿ZnabCu路径流动
C.片刻后盐桥中K+移向甲池
D.片刻后可观察到滤纸a点变红色
14.碱性镍锌(NiZn)电池是一种可以替代镍氢电池的新型电池,其总反应为:
2NiOOH+2H2O+Zn2Ni(OH)2+Zn(OH)2 。则下列说法中错误的是
A.电池工作时,OH―向负极移动
B.放电时负极反应式:Zn-2e-+2OHˉ==Zn(OH)2
C.充电时,与外电源正极相连的电极上电极反应式为Ni(OH)2-e-+OH-=NiOOH+H2O
D.充电时电池的正极应与外电源的负极相连
15.利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是
A.电流从右侧电极B经过负载后流向左侧电极A
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电极A极反应式为:2NH3-6e-=N2+6H+
D.当有9.2g NO2 被处理时,转移电子为0.8mol
16.MCFC型燃料电池可同时供应电和水蒸气,其工作温度为600~700 ℃,所用燃料为H2,电解质为熔融的K2CO3。已知该电池的总反应为2H2+O2=2H2O,则下列有关该电池的说法正确的是
A.该电池的正极反应式为O2+4e-+2H2O=4OH-
B.该电池的负极反应式为H2+CO32--2e-=H2O+CO2
C.放电时CO32-向正极移动
D.该燃料电池能量转化率很低
17.在1.0L恒容容器中放入0.10 mol X,在一定温度下发生反应:X(g)⇌ Y(g)+ Z(g)△H<0容器内气体总压强p随反应时间t的变化关系如图所示。 以下分析正确的是
A.从反应开始到t1时的平均反应速率v(X) = 0.2/t1 mol/(L•min)
B. 保持其他条件不变,若起始时向容器中加入0.5molX、0.5molY、0.5molZ,
则反应将向逆反应方向进行
C.欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量
D.其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大
18.T℃时,体积均为0.5 L的两个恒容密闭容器中发生可逆反应:2A(g)+B(g)2C(g) △H=-Q kJ/mol
(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如下表:
容器编号
起始时各物质物质的量/mol
达到平衡时体系能量的变化
A
B
C
①
2
1
0
0.75Q KJ
②
0.4
0.2
1.6
下列叙述中正确的是
A.容器①、②中反应的平衡常数均为6
B.容器②中达到平衡时放出的热量为0.05Q kJ
C.向容器①中通入氦气,平衡时A的转化率增大
D.其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数大于2/3
19.已知H﹣H键能为436kJ/mol,H﹣N键能为391kJ/mol,根据热化学方程式:
N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJ/mol,则N≡N键的键能是
A.945.6 kJ/mol B.431.4 kJ/mol C.227.4 kJ/mol D.1130.4 kJ/mol
20.200 mL K2SO4和CuSO4的混合溶液中c(SO42-)=0.5 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12 L气体(标准状况下)。假定电解后溶液体积仍为200 mL,下列说法不正确的是
A.电解得到Cu的质量为3.2 g B.上述电解过程中共转移电子0.2 mol
C.电解后的溶液中c(H+)=0.1 mol·L-1 D.原混合溶液中c(K+)=0.5mol·L-1
第ІІ卷 非选择题(共60分)
21.(14分)已知:A~F都是周期表中前四周期的元素,它们的原子序数依次增大.其中A、C原子的L 层有2个未成对电子.D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构.F3+的M层3d轨道电子为半充满状态.请根据以上信息,回答下列问题:
(1)A元素原子的核外电子排布图
(2)B元素形成的常见气体单质的电子式:
(3)C元素的原子核外共有 种不同运动状态的电子。
(4)D元素基态原子最外层电子所在能级的电子云形状为
(5)画出元素E的原子结构示意图
(6)F在周期表的位置: ,
F的基态原子的核外电子排布式:
22.(16分)如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的AgNO3溶液、NaCl溶液、x溶液,a、b、c、d电极均为石墨电极.接通电源,经过一段时间后,b电极质量增加.据此回答下列问题:
(1)电源的N端为 极;
(2)电极C上发生的电极反应式为
(3)甲池中的总反应离子方程式为
(4)电解一段时间后乙池的PH将 (填“增大”,“减小”或“不变”),可以加 使溶液恢复为原状态。
(5)当电路中有0.02mol电子通过时,a、b、c、d电极上产生的气体或固体的物质的量之比是
(6)若利用丙池实现铁上镀铜,则f电极材料应选择 ,f电极的电极反应式为
23.(18分)Ⅰ.
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于恒温恒容的容器中进行):2H2(g) + CO(g) CH3OH(g)
(1)判断反应达到平衡状态的依据是 (填序号)。
a.生成CH3OH的速率与消耗CO的速率相等
b.混合气体的密度不变
c.混合气体的平均相对分子质量不变
d.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
温度
250℃
300℃
350℃
K
2.041
0.270
0.012
该反应的平衡常数表达式K= ,△H 0(填“>”、“<”或“=”)。
(3)下图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的化学平衡常数A_____C,(填“>”、“=”或“<”)由状态B到状态A,可采用______的方法(填“升温”或“降温”)。
(4) 甲醇,氧气与氢氧化钾溶液可以设计成燃料电池,请写出该电池负极电极反应式____________。
Ⅱ.汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0; 某温度时在甲、乙、丙三个恒容密闭容器中,起始时按照右表进行投料,达到平衡状态时化学平衡常数K=16。
起始物质的量
甲
乙
丙
n(H2O)/mol
0.10
0.20
0.20
n(CO)/mol
0.10
0.10
0.20
(5)计算平衡时,甲容器中CO的转化率是 ;平衡时,比较容器中H2O的转化率:乙 甲(填“>”、“<”或“=”,下同);丙 甲。
24.(12分)污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要措施。已知在25℃,101kPa时:
N2(g)+3H2(g) === 2NH3(g) △H1=a kJ/mo1
2H2(g)+O2(g) === 2H2O(1) △H2=bkJ/mo1
N2(g) +O2(g) === 2NO(g) △H3= ckJ/mo1
(1)请写出用NH3脱除NO的热化学方程式 。
工业上还可以变“废”为“宝”,将雾霾里含有的SO2、NO等污染物转化为Na2S2O4(保险粉)和NH4NO3等化工用品,其生产流程如下:(提示HSO3—在溶液中显酸性)
(2)写出装置I中发生主要反应的离子方程式 。
(3)装置Ⅱ中在酸性环境中NO转变为NO3-的反应的离子方程式为 。
(4)装置Ⅲ制得Na2S2O4的同时还能让Ce4+再生,原理如下图所示。其阴极的电极反应式为 ,
当电路中通过0.2mol电子时电解槽右侧溶液质量增加了 g 。
(5)按上述流程处理含有amolSO2、bmolNO的雾霾(b>a),并制取Na2S2O4和NH4NO3。装置Ⅰ中SO2、装置Ⅱ中NO、装置Ⅲ中HSO3-和Ce3+、装置Ⅳ中NO2-全部转化,处理完毕后装置Ⅱ中Ce4+的剩余量与加入量相比没有变化,则至少需向装置Ⅳ中通入标准状况下的O2 L(用含a、b的代数式表示)。