- 406.50 KB
- 2021-06-19 发布
扬州中学2018-2019学年度第二学期期中考试
高二化学试卷 2019.4
说明:1.本试卷满分120分,考试时间100分钟。
2.请在答题纸上对应部分作答,否则答题无效。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Fe-56 Cu-64
第I卷(选择题,共40分)
一、单项选择题(本题包括10小题,每题2分,共20分。每小题只有一个选项符合题意)
1、诺贝尔化学奖曾授予致力于研究合成氨与催化剂表面积大小关系的德国科学家格哈德•埃特尔,表彰他在固体表面化学过程研究中作出的贡献。下列说法中正确的是
A.增大催化剂的表面积,能增大氨气的产率
B.增大催化剂的表面积,能加快合成氨的正反应速率、降低逆反应速率
C.采用正向催化剂时,反应的活化能降低,使反应明显加快
D.工业生产中,合成氨采用的压强越高,温度越低,越有利于提高经济效益
2、下列过程或现象与盐类水解无关的是
A.纯碱溶液去油污
B.小苏打溶液与AlCl3溶液混合产生气体和沉淀
C.浓的硫化钠溶液有臭味
D.加热稀醋酸溶液其pH 稍有减小
3、在下列溶液中,各组离子一定能够大量共存的是
A.滴入甲基橙试液显红色的溶液中:Mg2+、Al3+、Br-、SO42-
B.常温下水电离出的c( H+)= 1× 10-13 mol·L-1的溶液中:Na+、Ba2+、Cl—、CH3COO—
C.0.1 mol·L-1 (NH4)2CO3溶液中:K+、Na+、NO3-、OH-
D.c(SO32-)=0.1 mol·L-1的溶液中:Ca2+、MnO4-、SO42-、H+
4、已知碳酸钙的分解①CaCO3(s)==CaO(s)+CO2(g) △H1,仅在高温下自发;②氯酸钾的分解2KClO3(s)==2KCl(s)+3O2(g) △H2,在任何温度下都自发。下面有几组焓变数据,其中可能正确的是
A.△H1=-178.32kJ·mol-1 △H2=-78.3kJ·mol-1
B.△H1=178.32kJ·mol-1 △H2=-78.3kJ·mol-1
C.△H1=-178.32kJ·mol-1 △H2=78.3kJ·mol-1
D.△H1=178.32kJ·mol-1 △H2=78.3kJ·mol-1
5、下列有关说法正确的是
A.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
B.铁表面镀铜时,铜与电源的负极相连,而铁与电源的正极相连
C.某反应的平衡常数K300℃>K350℃,则该反应 △H<0
D.合成氨生产中将NH3液化分离,目的是加快正反应速率,提高H2的转化率
6、 COCl2俗名称作光气,是有毒气体。在一定条件下,可发生的化学反应为:
COCl2(g) CO(g)+Cl2(g) ΔH<0 下列有关说法不正确的是
A.在一定条件下,使用催化剂能加快反应速率
B.当反应达平衡时,恒温恒压条件下通入Ar,COCl2的转化率不变
C.单位时间内生成CO和消耗Cl2的物质的量比为1∶1时,反应达到平衡状态
D.平衡时,其他条件不变,升高温度可使该反应的平衡常数减小
7、下列生产、生活等实际应用,不能用勒夏特列原理解释的是
A.高温比常温有利于NH3的合成
B.冰镇的啤酒打开后泛起泡沫
C.Fe(SCN)3溶液中加入KSCN后颜色变深
D.氯水宜保存在低温、避光条件下
8、下列相关实验示意图不能达到实验目的的是
A.探究不同催化剂对H2O2分解速率影响 B.探究温度对2NO2N2O4平衡影响
C.验证Cr2O72—+H2O2CrO42—+2H+平衡状态变化 D.验证钠和水反应的热效应
9、“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e- === X + 2H+。下列说法中正确的是
A.电池内部H+由正极向负极移动
B.另一极的电极反应式为:O2 + 4e- + 2H2O === 4OH-
C.乙醇在正极发生反应,电子经过外电路流向负极
D.电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O
10、下列说法正确的是
A. 铜的金属活泼性比铁的弱,可在海轮外壳上镶入若干铜块以减缓其腐蚀
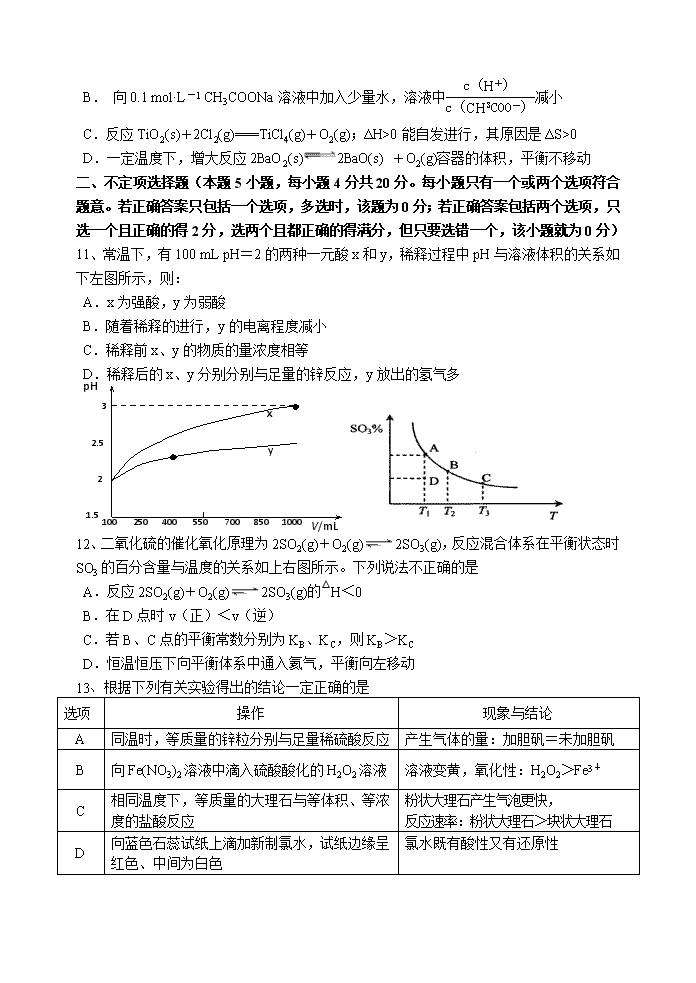
B. 向0.1 mol·L-1 CH3COONa溶液中加入少量水,溶液中减小
C.反应TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g);ΔH>0能自发进行,其原因是ΔS>0
D.一定温度下,增大反应2BaO2(s)2BaO(s) +O2(g)容器的体积,平衡不移动
二、不定项选择题(本题5小题,每小题4分共20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
11、常温下,有100 mL pH=2的两种一元酸x和y,稀释过程中pH与溶液体积的关系如下左图所示,则:
A.x为强酸,y为弱酸
B.随着稀释的进行,y的电离程度减小
C.稀释前x、y的物质的量浓度相等
pH
D.稀释后的x、y分别分别与足量的锌反应,y放出的氢气多
3
x
2.5
y
2
1.5
1000
850
700
550
400
250
100
V/mL
12、二氧化硫的催化氧化原理为2SO2(g)+O2(g)2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如上右图所示。下列说法不正确的是
A.反应2SO2(g)+O2(g)2SO3(g)的△H<0
B.在D点时v(正)<v(逆)
C.若B、C点的平衡常数分别为KB、KC,则KB>KC
D.恒温恒压下向平衡体系中通入氦气,平衡向左移动
13、根据下列有关实验得出的结论一定正确的是
选项
操作
现象与结论
A
同温时,等质量的锌粒分别与足量稀硫酸反应
产生气体的量:加胆矾=未加胆矾
B
向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液
溶液变黄,氧化性:H2O2>Fe3+
C
相同温度下,等质量的大理石与等体积、等浓
度的盐酸反应
粉状大理石产生气泡更快,
反应速率:粉状大理石>块状大理石
D
向蓝色石蕊试纸上滴加新制氯水,试纸边缘呈红色、中间为白色
氯水既有酸性又有还原性
14、常温下,用0.10 mol·L-1盐酸分别滴定20.00 mL浓度均为0.10 mol·L-1 CH3COONa溶液和NaCN溶液,所得滴定曲线如右图所示(忽略体积变化)。下列说法正确的是
A.溶液中阳离子的物质的量浓度之和:点②等于点③
B.点①所示溶液中:c(CN—)+ c(HCN)=2c(Cl—)
C.点②所示溶液中:
c(Na+)> c(Cl—)> c(CH3COO—)> c(CH3COOH)
D.点④所示溶液中:c(Na+)+ c(CH3COOH)+ c(H+)>0.10 mol·L-1
15、在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g)2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
容器
编号
温度/K
起始物质的量/mol
SO2
NO
NO2
S
Ⅰ
0.5
0.6
0
0
Ⅱ
T1
0.5
1
0.5
1
Ⅲ
T2
0.5
0.2
1
1
A.该反应的ΔH<0
B.T1时,该反应的平衡常数为1/16
C.容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比小于1:2
D.若T2