- 208.00 KB
- 2021-06-19 发布
2018-2019 学年山东省济宁市微山县第二中学高二上学期期中
考试化学试卷
第Ⅰ卷(选择题,共 54 分)
原子量:H:1 O:16 C:12 N:14 Na:23 Mg:24 Al:27 S:32
一、选择题(本题共 16 小题,每小题 3 分,共 48 分)
1.下列与化学反应能量变化相关的叙述正确的是 ( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH 不同
2.下列过程伴随的能量变化中,属于反应热的是( )
A.形成 1 mol H—Cl 键放出的能量
B.石墨转变成金刚石吸收的能量
C.1 mol O2 形成 2 mol O 原子吸收的能量
D.水蒸气变成液态水放出的能量
3. 下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指在一段时间内任何一种反应物物质的量的减少或任何一种生成物物
质的量的增加
B.化学反应速率为 0.8 mol·L-1·s-1,是指在 1 s 时某物质的浓度是 0.8 mol·L-1
C.对于任何化学反应来说,反应速率越快,反应现象越明显
D.化学反应速率可以衡量化学反应进行的快慢
4.2 mol A 与 2 mol B 混合于 2L 的密闭容器中,发生如下反应:2A(g)+3B(g) 2C(g)
+ zD(g)若 2 s 后,A 的转化率为 50%,测得 v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
A.v(C)=v(A)=0.2 mol·L-1·s-1
B.B 的转化率为 75%
C.z=3
D.反应前与 2 s 后容器的压强比为 4∶3
5. 把下列四种 X 溶液,分别加进四个盛有 10mL、2mol/L 的盐酸的烧杯中,并且均加水稀释
至 50mL,此时, X 和盐酸缓缓地进行反应,其中反应速率最快的是( )
A 10mL 2mol/L B 20mL 2mol/L C 10mL 4mol/L D 20mL 3mol/L
6. 下列关于压强对化学反应速率的影响的说法中不正确的是 ( )
A 对任何化学反应,增大压强都可以加快它们的反应速率
B 对于气体反应,增大压强相当于增大反应物浓度,所以反应速率加快
C 增大压强可以加快合成氨的反应速率
D 对于液态或固态反应物,由于压强对它们体积改变很小,可以认为压强与它们的反应速
率无关
7. 下列反应中,当其他条件不变时增大压强,化学反应速率加快的是( )
① N2 + O2 2NO2 ② Fe + CuSO4 = Cu + FeSO4
③ 2NH3 N2 + 3H2 ④ 2SO2 + O2 2SO3
A 只有① B ①②③ C ①③④ D 全部
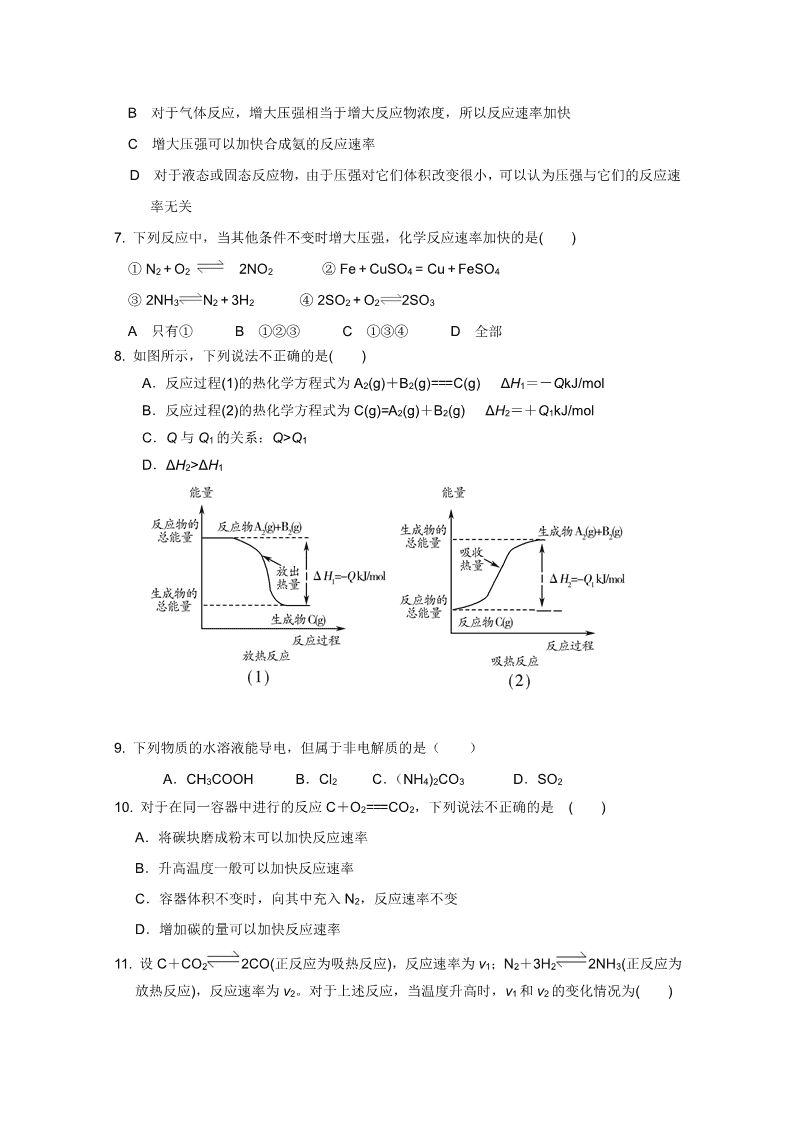
8. 如图所示,下列说法不正确的是( )
A.反应过程(1)的热化学方程式为 A2(g)+B2(g)===C(g) ΔH1=-QkJ/mol
B.反应过程(2)的热化学方程式为 C(g)=A2(g)+B2(g) ΔH2=+Q1kJ/mol
C.Q 与 Q1 的关系:Q>Q1
D.ΔH2>ΔH1
9. 下列物质的水溶液能导电,但属于非电解质的是( )
A.CH3COOH B.Cl2 C.(NH4)2CO3 D.SO2
10. 对于在同一容器中进行的反应 C+O2===CO2,下列说法不正确的是 ( )
A.将碳块磨成粉末可以加快反应速率
B.升高温度一般可以加快反应速率
C.容器体积不变时,向其中充入 N2,反应速率不变
D.增加碳的量可以加快反应速率
11. 设 C+CO2 2CO(正反应为吸热反应),反应速率为 v1;N2+3H2 2NH3(正反应为
放热反应),反应速率为 v2。对于上述反应,当温度升高时,v1 和 v2 的变化情况为( )
A.同时增大 B.同时减小
C.v1 增大,v2 减小 D.v1 减小,v2 增大
12. 在 25℃时,0.1 mol·L-1 的 HNO2、HCOOH、HCN、H2CO3 的溶液,它们的电离平衡常
数分别为 4.6×10-4mol2·L-2、1.8×10-4mol2·L-2、4.9×10-10mol2·L-2、K1=4.3×10-7mol2·L-2
和 K2=5.6×10-11mol2·L-2,其中氢离子浓度最小的是 ( )
A.HNO2 B.HCOOH C.HCN D.H2CO3
13.在 NH4Cl 溶液中,离子浓度大小排队正确的是( )
A. c(NH4
+
)> c(Cl-
)> c(OH-
)> c(H+
) B. c(Cl-
)> c(NH4
+
)> c(OH-
)> c(H+
)
C. c(Cl-)>c(NH4
+)> c(H+)> c(OH-) D. c(NH4
+)> c(Cl-)> c(H+)> c(OH-)
14.下列事实不能用化学平衡移动原理解释的是( )
A.用排饱和食盐水的方法收集 Cl2
B.加催化剂,使氮气和氢气在一定条件下转化为氨气
C.反应 CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应),达平衡后,
升高温度体系颜色变深
D.合成氨工业中采用高压条件
15.在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应 A(s)+
2B(g) C(g)+D(g)已达平衡的是( )
A. 混合气体的压强 B. 混合气体的密度
C. A 的物质的量浓度 D. 气体总物质的量
16.2 000 K 时,反应 CO(g)+1
2O2(g) CO2(g)的平衡常数为 K,则相同温度下反应
2CO2(g) 2CO(g)+O2(g)的平衡常数 K′为( )
A. 1
K B.K2 C. 1
K2 D.
1
K1
2
17.常温下,在 0.1mol/LHF 溶液中,水的离子积是( )
A. 1.0×10-14 B. 1.0×10-13 C. 1.32×10-14 D. 1.32×10-15
18.已知某可逆反应:mA(g)+nB(g) r C(g)在密闭
容器中进行。右图表示此反应在不同时间 t,温度 T 和压强 p
与反应物 B 在混合气体中的百分含量(B%)的关系曲线。由
曲线分析下列判断正确的是( )
A.T1>T2,p1>p2,m+n>r,正反应吸热
B.T1<T2,p1<p2,m+n>r,正反应放热
C.T1>T2,p1>p2,m+n<r,正反应放热
D.T1<T2,p1<p2,m+n<r,正反应吸热
第Ⅱ卷(共 46 分)
二、非选择题(共 46 分)
19.(每空 2 分,共 10 分) 在密闭容器里,通入 x mol H2 和 y mol I2(g),发生反应:
H2(g)+I2(g) 2HI(g),改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
(1)升高温度 ;
(2)加入催化剂 ; []
(3)充入更多的 H2 ;
(4)扩大容器的体积 ;
(5)容器容积不变,通入氖气 。
20. (每空 2 分,共 10 分)
(1)Na2CO3 溶液中滴加酚酞呈红色,原因是__________________________(用离子方程
式表示)。加热后颜色变__________,原因是_______________________________。若在
该 溶 液 中 滴 加 过 量 的 BaCl2 溶 液 , 发 生 反 应 的 离 子 方 程 式
_______________________________。
(2)现有 S2-、SO2-
3 、NH+
4 、Al3+、Na+、SO2-
4 、AlO-
2 、Fe3+、HCO-
3 、Cl-等离子,
在水溶液中,该离子水解呈碱性的是_________________。
21. (每空 2 分,共 12 分)
Ⅰ.在某一容积为 2 L 的密闭容器中,A、B、C、D 四种物质的物质的量 n(mol)随时间 t(min)
的变化曲线如下图所示:
完成下列问题:
(1)该反应的化学方程式为_____________________________________。
(2)前 2 min 用 A 的浓度变化表示的化学反应速率为________。
Ⅱ.一定温度下,将 3molA 气体和 1molB 气体通过一密闭容器中,发生如下反应:
3A(g)+B (g) xC(g)。
若容器体积固定为 2L,反应 1min 时测得剩余 1.8molA,C 的浓度为 0.4mol/L。请填写下
列空白:
(3)1min 内,B 的平均反应速率为_________;x_________;
(4)若反应经 2min 达到平衡,平衡时 C 的浓度_________0.8mol/L(填“大于”、“等于”
或“小于”);
(5)平衡混合物中,C 的体积分数为 22%,则 A 的转化率是_________;
22. (每空 2 分,共 14 分)
Ⅰ.(1)化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时
放出的能量不同所致。下图为 N2(g)和 O2(g)生成 NO(g)过程中的能量变化:
N2(g)和 O2(g)生成 NO(g)过程中的能量变化
①人们通常把拆开 1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化
学键的强弱,则 N≡N 的键能为________kJ/mol。
②由上图写出 N2(g)和 O2(g)生成 NO(g)的热化学方程式:___________________________
(2)①已知:C(石墨,s)+O2(g)===CO2(g) ΔH1=-393.5kJ/mol
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6kJ/mol
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599.2kJ/mol,
则由 C(石墨,s)和 H2(g)反应生成 1mol C2H2(g)时ΔH=________kJ/mol。
②火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把 0.4mol 液态肼和
0.8mol H2O2 混合反应,生成氮气和水蒸气,放出 256.7kJ 的热量(相当于 25℃、101 kPa
下测得的热量)。
反应的热化学方程式为 。
Ⅱ. 已知化学反应 N2+3H2=2NH3 的能量变化如图所示,
(3)1mol N 和 3mol H 生成 1mol NH3(g)是 -能量的过程(填“吸收”或“释放”)。
(4) 1
2 N2(g)+ 3
2 H2(g)=NH3(g); △H= ;
(5)N2(g)和 H2 生成 NH3(1)的热化学方程式为_______________________________。
18-19 学年上学期高二年级化学学科二学段试卷答案
一、选择题
题号 1 2 3 4 5 6 7 8
答案 C B D B D A C C
题号 9 10 11 12 13 14 15 16
答案 D D A B C B B C
题号 17 18
答案 A D
二、填空题
19. (每空 2 分,共 10 分)
(1)增大 (2)增大 (3)增大 (4)减小 (5)不变
20. (每空 2 分,共 10 分)
(1) CO32-+H2O HCO3-+OH- 深
水解吸热,升高温度使上述平衡向右移动,C(OH-)增大,故颜色加深。
Ba2++CO32-=BaCO3↓
(2)S2-、SO2-
3 、AlO
-
2 、HCO
-
3
21. (每空 2 分,共 12 分)
Ⅰ. (1) 4A+5B 6C+4D (2) 0.1 mol/(L·min)[]
Ⅱ. (3)0.2 mol/(L·min) x=2 (4)小于 (5)36.1%
22. (每空 2 分,共 14 分)
Ⅰ.(1) ①946
②N2(g)+O2(g)=2NO(g) ΔH=+180kJ/mol
(2) ①+226.8
②N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)
△
H=-641.75kJ/mol;
Ⅱ.(3)释放
(4)(a-b) kJ·mol-1
(5)N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-1