- 1.07 MB
- 2021-05-28 发布
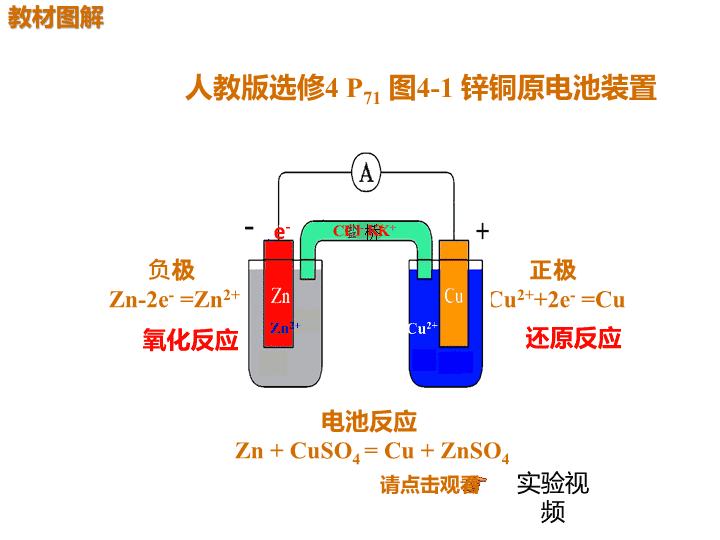
人教版选修4 P71 图4-1 锌铜原电池装置
负极
Zn-2e- =Zn2+
正极
Cu2++2e- =Cu
电池反应
Zn + CuSO4 = Cu + ZnSO4
氧化反应 还原反应
请点击观看 实验视
频
e-
e-
Zn2+ Cu2+
K+Cl- 桥K+Cl-
2.(溯源题)(2016·上海化学,8)图1是铜锌原电
池示意图。图2中,x轴表示实验时流入正极的电子的
物质的量,y轴表示 。
①铜棒的质量 ②c(Zn2+) ③c(H+) ③c
(SO42-)
③
不变 增加 减少
不变
3.用a、b、c、d四种金属按表中所示的装置进行实验,
下列叙述中正确的是( )
A .装置甲中的b金属是原电池的负极
B.装置乙中的c金属是原电池的阴极
C.装置丙中的d金属是原电池的正极
D.四种金属的活泼性顺序:d>a>b>c
D
试
题
备
选
— + +
解析 甲中a溶解说明a是负极,活泼性a>b,A错误;
原电池用正极或负极命名电极,B错误,由乙中现
象知活泼性b>c;丙中d是负极,活泼性d>a,C错误;
综上可知D正确。
(2017·广东粤西四校联考)铜锌原电池(如图)工
作时,下列叙述正确的是( )
A.一段时间后,铜棒上有红色物质析出
B.正极反应为:Zn-2e-===Zn2+
C.在外电路中,电流从负极流向正极
D.盐桥中的K+移向ZnSO4溶液
A
—
+
I
K+
解析 Cu为正极,电极反应为Cu2++2e-===Cu,
铜棒上有红色物质析出,A项正确,B项错误;在外
电路中,电流从正极流向负极,C项错误;CuSO4溶
液中c(Cu2+)降低,故盐桥中的K+移向CuSO4溶
液,D项错误。
【试题备选】
正、负极的判断方法
在设计原电池装置时,首先要书写出总氧
化还原反应的离子方程式,确定原电池的
正、负极,再把总反应的离子方程式拆写
成氧化反应(负极反应)和还原反应(正极反
应)
原电池设计程序
相关文档
- 八年级数学上册第1章分式1-1分式第2021-05-28 01:23:3823页
- 部编人教版语文六年级下册教学课件2021-05-28 01:22:2532页
- 人教版数学五年级下册教学课件-第32021-05-28 01:16:5931页
- 人教版小学二年级上册数学教学课件2021-05-28 01:16:2419页
- 苏教版数学小学四年级下册教学课件2021-05-28 01:14:5920页
- 人教版小学五年级上册数学教学课件2021-05-28 01:14:3517页
- 人教部编版语文 小学一年级下册教2021-05-28 01:04:508页
- 小学一年级作文教学课件动物联欢会2021-05-28 01:02:0210页
- 2020四年级语文下册第七单元23诺曼2021-05-28 00:59:5756页
- 部编版小学二年级下册语文教学课件2021-05-28 00:59:5616页