- 311.50 KB
- 2021-02-26 发布
- 1、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 2、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报QQ:3215808601
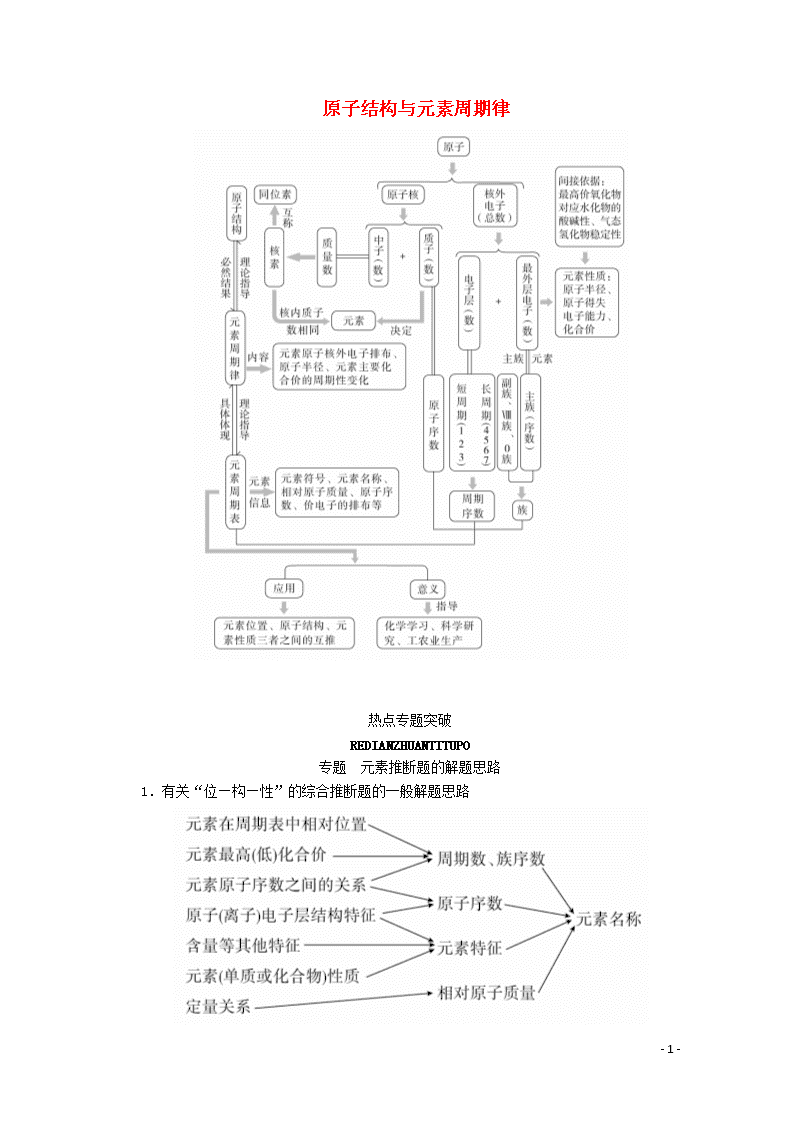
原子结构与元素周期律
专题 元素推断题的解题思路
1.有关“位—构—性”的综合推断题的一般解题思路
- 5 -
2.元素推断题的常见突破口
(1)微粒的电子层结构特征
(2)元素化合价特征
①根据元素化合价推断元素主族位置,最高正价=最外层电子数=主族序数(O、F除外);已知最低负价(或离子符号),则先根据最高正价=8-最低负价的绝对值,求出最高正价(H除外),再确定主族位置。
②最高正价与最低负价代数和为0的短周期元素有H、C、Si。
③最高正价与最低负价绝对值之差为2、4、6的短周期元素分别为N和P、S、Cl元素。
④最高正价是最低负价绝对值3倍的元素是S。
⑤最高正价不等于族序数(最外层电子数)的短周期元素有F、O。
(3)熟悉1~20号元素原子结构特点及其规律
①原子核中无中子的原子:H。
②最外层电子数等于次外层电子数的元素:Be、Ar。
③最外层电子数是次外层电子数2倍的元素:C;是次外层3倍的元素:O;是次外层4倍的元素:Ne。
④电子层数与最外层电子数相等的元素:H、Be、Al。
⑤电子总数为最外层电子数2倍的元素:Be。
⑥次外层电子数是最外层电子数2倍的元素:Li、Si。
⑦内层电子总数是最外层电子数2倍的元素:Li、P。
⑧电子层数是最外层电子数2倍的元素:Li、Ca。
⑨最外层电子数是电子层数2倍的元素:He、C、S。
⑩最外层电子数是电子层数3倍的元素:O。
(4)根据元素的含量、存在、用途及性质特征
①形成化合物种类最多的元素或单质是自然界硬度最大的物质或其最简单氢化物中氢的质量分数最大的元素是C(金刚石为天然存在的最硬单质;CH4是氢化物中含氢量最高的化合物)。
②空气中含量最多,与O元素可以形成两种以上气态化合物,气态氢化物水溶液呈碱性的元素或元素的气态氢化物与它的最高价氧化物的水化物起化合反应生成盐的元素是N(氨水显碱性,NH3+HNO3===NH4NO3)。
③地壳中含量最多的元素、氢化物沸点最高的元素、氢化物在通常情况下呈液态的元素是O。
④原子核内无中子的元素,阳离子核外无电子的元素、原子半径最小的元素、常温下单质气体密度最小的元素是H。
⑤其气态氢化物和其气态氧化物反应生成其单质和水的短周期元素可能是N或S;其气态氢化物与其最高价含氧酸能起氧化还原反应的元素是S。
⑥地壳中含量最多的金属元素、短周期中同周期的三种元素最高价氧化物对应水化物两两皆反应,则必定含有Al。
⑦最高价氧化物对应水化物酸性最强的元素是Cl。
⑧
- 5 -
只有负价不存在正价的卤族元素、不存在含氧酸的非金属元素、单质的氧化性最强(或阴离子还原性最弱)的元素、单质在暗处能与氢气剧烈化合的元素、气态氢化物最稳定的元素、其气态氢化物的水溶液可雕刻玻璃的元素、非金属性最强的元素是F。
⑨可以作半导体材料的短周期元素、其单质能与强碱溶液反应生成氢气的非金属元素是Si。
⑩其最高价氧化物或其最高价氧化物对应的水化物既能与强酸反应,又能与强碱反应的短周期元素是Be、Al。
⑪两种元素以原子个数比为2∶1和1∶1组成的化合物常温下为液态的元素为H和O。
⑫其单质常温下为液态的非金属元素为Br;常温下,其单质是有色气体的元素是F、Cl。
例1 A、B、C、D、E是五种短周期主族元素,它们的原子序数依次增大,其中A、D及B、E分别是同一主族元素,B、E两元素的质子数之和是A、D两元素质子数之和的2倍。则下列说法中正确的是( )
A.与A形成化合物的稳定性:C>B>E
B.形成简单离子的半径:E>D>B
C.单质B和D在常温下化合生成D2B2
D.C的最高价氧化物对应的水化物酸性最强
[解析] A、B、C、D、E是五种短周期主族元素,它们的原子序数依次增大,A、D及B、E分别是同主族元素,可以确定B、E分别位于2、3周期,由于B、E两元素质子数之和是A、D两元素质子数之和的2倍,确定A、D位于1、3周期,所以A为H、D为Na、B为O、E为S、C为F。与A形成氢化物的稳定性:HF>H2O>H2S,A正确;形成简单离子的半径:S2->O2->Na+,B错误;单质B和D在加热条件下化合生成Na2O2,C错误;F元素无正价,D错误。
[答案] A
例2 W、X、Y、Z是四种短周期元素,它们的核电荷数依次增大,四种元素的性质或原子结构的部分信息如表所示。
元素
元素性质或原子结构的部分信息
W
元素的离子核外无电子
X
地壳中含量最多的元素
Y
元素的离子半径在该周期中最小
Z
Z的单质是淡黄色固体
下列叙述不正确的是( )
A.W与Z形成的化合物在常温下为气体
B.Y的最高价氧化物对应的水化物不与NaOH溶液反应
C.X和Z形成的常见化合物能形成酸雨
D.简单氢化物的稳定性:X>Z
[解析] 根据题目信息,可知W、X、Y、Z分别为H、O、Al、S。H2
- 5 -
S在常温下为气体,A项正确;Al(OH)3可与NaOH溶液反应,B项错误;SO2能形成酸雨,C项正确;O的非金属性强于S,所以简单氢化物的稳定性:H2O>H2S,D项正确。
[答案] B
- 5 -
- 5 -