- 549.50 KB
- 2021-05-19 发布
- 1、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 2、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报QQ:3215808601
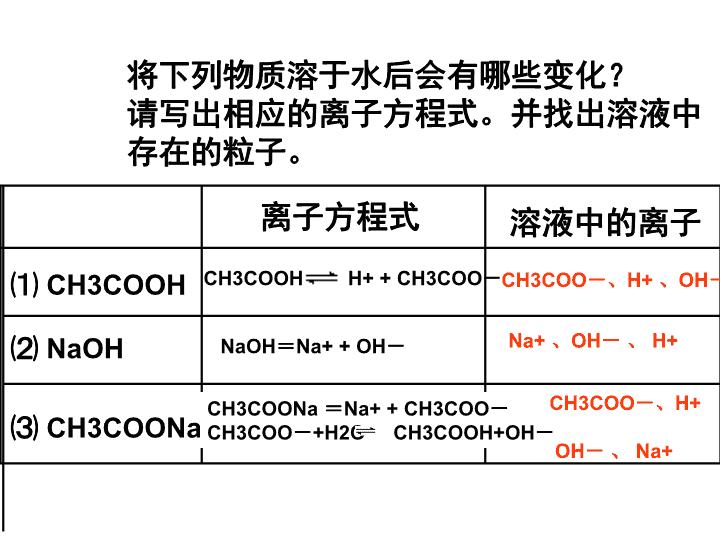
将下列物质溶于水后会有哪些变化?
请写出相应的离子方程式。并找出溶液中
存在的粒子。
⑴ CH3COOH
离子方程式 溶液中的离子
⑵ NaOH
⑶ CH3COONa
NaOH=Na+ + OH-
CH3COONa =Na+ + CH3COO-
CH3COO-+H2O CH3COOH+OH-
Na+ 、OH- 、 H+
CH3COO-、H+ 、OH-CH3COOH H+ + CH3COO-
CH3COO-、H+
OH- 、 Na+
电解质溶液中的离子来源是:
1、电解质的电离过程。
(包括溶质的电离和水的电离)
2、弱电解质离子的水解过程。
(包括弱酸根离子和弱碱阳离子)
电解质溶液中的离子来源是:
2、电解质的电离过程。
(包括溶质的电离和水的电离)
1、弱电解质离子的水解过程。
(包括弱酸根离子和弱碱阳离子)
向100 mL1 mol/L 的CH3COOH溶液中逐滴加入
1mol/L的NaOH溶液。随着NaOH的加入,溶液中的
离子浓度的大小关系是如何变化的?
互
相
讨
论
一
下
,
看
看
能
写
出
几
种
结
果
? 加入
NaOH溶
液的体积
溶液的
酸碱性
溶液中的
溶质
离子
种类
离子浓度大小
比较
向100 mL1 mol/L 的CH3COOH溶液中逐滴加入1mol/L的NaOH溶液
加入
NaOH
溶液的
体积
溶液
的酸
碱性
溶液中的溶质 离子种类 离子浓度大小比较
①0m
L
②
③
④
⑤
⑥
100mL
⑦
c(H+ )>c(CH3COO-)>c(OH-)
碱性
酸性 CH3COOH
CH3COONa
CH3COO-、H+
、OH-
CH3COO-、H+ 、
Na+ 、OH-
c(Na+)>c(CH3COO-)>c(OH-)
>c(H+)
单一
溶液
单一
溶液
1、要充分考虑弱酸(弱碱)的电离平衡和弱
离子的水解平衡,尤其不能漏掉水的电离。 。
2、弱电解质的电离是微弱的。只有很少量
的弱酸(弱碱)电离。
3、弱离子的水解是微弱的。只有少量的弱离子
水解。
加入
NaOH
溶液的
体积
溶液
的酸
碱性
溶液中的溶质 离子种类 离子浓度大小比较
①0mL
②0.5m
L
③一定
体积
④ 一定
体积
⑤一定
体积
⑥
100mL
⑦
500mL
c(H+ )>c(CH3COO-)>c(OH-)
碱性
中性
酸性
酸性
CH3COOH
CH3COOH
CH3COONa
CH3COOH
CH3COONa
CH3COONa
CH3COO-、H+
、OH-
CH3COO-、H+ 、
Na+ 、OH-
c(CH3COO-)>c(Na+)>c(H+)
>c(OH-)
c(CH3COO-)=c(Na+)>c(H+)
=c(OH-)
c(Na+)>c(CH3COO-)>c(OH-)
>c(H+)
碱性
c(CH3COO-)>c(H+)>c(Na+ )
>c(OH-)酸性
CH3COOH
CH3COONa
CH3COONa
NaOH
CH3COO-、H+ 、
Na+ 、OH-
CH3COO-、H+ 、
Na+ 、OH-
c(Na+)>c(OH-)>c(CH3COO-)
>c(H+)
1∶1
碱性 CH3COOH
CH3COONa
CH3COO-、H+ 、
Na+ 、OH-
CH3COO-、H+ 、
Na+ 、OH-
CH3COO-、H+ 、
Na+ 、OH-
c(Na+)>c(CH3COO-)>c(OH-)
>c(H+)
50mL
碱很少 碱很多
1、要充分考虑弱酸(弱碱)的电离平衡和弱
离子的水解平衡,尤其不能漏掉水的电离。 。
2、弱电解质的电离是微弱的。只有很少量
的弱酸(弱碱)电离。
3、弱离子的水解是微弱的。只有少量的弱离子
水解。
4、若同时存在弱电解质的电离和弱离子的水解
过程,则要考虑二者的相对强弱。分析时只考虑
相对较强的过程。
电荷守恒关系:
c(H+)+c(Na+ )=c(CH3COO-)+c(OH-)
c(CH3COO-)=c(Na+)>c(H+)=c(OH
-)
c(H+)>c(CH3COO-)>c(Na+)>c(OH
-)c(OH-)>c(Na+)>c(CH3COO-)>
c(H+)
pH=7:
溶
液
中
的
粒
子
浓
度
的
守
恒
关
系
有
哪
些
? c(Na+)=c(CH3COO-) + c(CH3COOH )
尝试一下,把电荷守恒式和物料守恒式加合一
下,看看得到什么?
c(OH-)=c(H+ ) +
c(CH3COOH)
CH3COONa 1、电荷守恒关系:
c(H+)+c(Na+ )=c(CH3COO-)+c(OH-)
2、物料守恒关系:
1、粒子浓度之间的守恒关系包括电荷守恒关系
(溶液是电中性的)和物料守恒关系(元素守
恒)。
2、电荷守恒式中的阴阳离子分列等号两边,特
别注意高价离子的系数;
3、出现分子必然是物料守恒式。
4、物料守恒式代入电荷守恒式后可得新的守恒
式。
NaHCO3
水溶液中
存在的粒
子之间的
关系不正
确的是:
Na+ 、 HCO3- 、 OH-、H2CO3 、 CO32- 、
H+
NaHCO3=Na+ +HCO3-
HCO3- + H2O H2CO3 + OH-
HCO3- CO3 2- + H+
H2O H+ +OH-
(主)
(次)
A、
c(Na+ )>c(HCO3-) >c(OH-) >c(CO32- )> c(H+)
B、
c(Na+ )+ c(H+)=c(HCO3-)+c(CO32- )+c(OH-)
C、
c(Na+ )=c(HCO3-)+c(CO32- )+c(H2CO3)
D、
c(OH-)=c(H+)+c(H2CO3) — c(CO32- )
不
同
溶
液
中
同
种
离
子
浓
度
的
比
较
:
1、有物质的量浓度相同的下列溶液:
①NH4Cl
②(NH4)2SO4
③(NH4)2CO3
④NH4HCO3
⑤NH4HSO4
⑥(NH4)2Fe(SO4)2
⑦CH3COONH4
c(NH4+)由大到小的顺序是: 。
⑥②③⑤①④⑦
不
同
溶
液
中
同
种
离
子
浓
度
的
比
较
:
2、温度相同、浓度均为0.2mol/L的溶液,
①(NH4)2SO4
②NaNO3
③NH4HSO4
④NH4Cl
Na2CO3
⑥ CH3COONa
⑦NaHCO3
它们的pH值由小到大的排列顺序是:
③①④②⑥⑦⑤
1、注意被比较离子的数量关系。
2、注意被比较离子的变化。
3、按影响因素分组讨论:
将盐分为抑制电离的、不影响电离的、不电
离的、不水解的、抑制水解的、水解的、促进
水解的几组,再在小组内按程度不同进行具体
比较。
按溶液的酸碱性将溶液先分为三组:酸性的、
中性的、碱性的。再在小组内程度不同进行具体
比较。
100 mL0.1mol/L醋酸与50 mL0.2mol/L氢氧化
钠溶液混合,在所得溶液中 ( )
A. c(Na+)>c(CH3COO )>c(OH )>c(H+)
B. c(Na+)>c(CH3COO )>c(H+)>c(OH )
C. c(Na+)>c(CH3COO )>c(H+)=c(OH )
D. c(Na+)=c(CH3COO )>c(OH )>c(H+)
A
将盐酸溶液和氨水等体积混合后溶液呈中性,
下列关系式中正确的是
A. c(Cl )>c(NH4+)>c(H+)>c(OH )
B. c(NH4+)>c(Cl )>c(H+)>c(OH )
C. c(Cl )=c(NH4+)>c(H+)=c(OH )
D. c(Cl )=c(NH4+)>c(H+)>c(OH )
注意: 氨水有剩余,所得溶液为NH4Cl和NH3·H2O的混
合溶液。
电荷守恒关系:
c( H+ ) + c(NH4+ ) = c(Cl-) + c(OH-)
C
在25℃时将pH=11 的NaOH 溶液与pH=3 的
CH3COOH溶液等体积混合后,下列关系式中
正确的是
A.c (Na+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)=c(CH3COO-)+c(OH一)
C.c (Na+) >c (CH3COO-)>c(OH-)>c(H+)
D.c (CH3COO-)>c(Na+)>c(H+)>c(OH-)
注意: CH3COOH有剩余,所得溶液为CH3COOH和
CH3COONa的混合溶液。
将等浓度的NH4Cl 和 NH3·H2O 稀溶液混合,
测得c(NH4+)>c(Cl—)。则下列关系式中正确
的是( )
A.c(H+)>c(OH—)
B.c(H+)<c(OH—)
C.c(NH4+)>c(NH3·H2O)
D.c(NH4+)<c( NH3·H2O)
物质的量浓度相同的下列溶液:①Na2CO3
②NaHCO3 ③H2CO3 ④(NH4)2CO3
⑤NH4HCO3 ,按c(CO3 2-)由小到大的顺序
是:
A、⑤<④<③<②<①
B、③<⑤<②<④<①
C、③<②<⑤<④<①
D、③<⑤<④<②<①
A组是基础巩固,所有同学必须完成。
B组是能力拔高,供同学选择使用。
C组是挑战自我,有兴趣的同学可以
尝试一下。
相关文档
- 二年级语文下册课文二语文园地二教2021-05-19 20:39:0921页
- 一年级上册语文教学课件-9 明天要2021-05-19 20:33:2735页
- 部编人教版语文 小学五年级下册教2021-05-19 20:10:3223页
- 部编人教版四年级语文上册《1 观潮2021-05-19 19:54:5960页
- 人教版一年级上册数学第七单元 认2021-05-19 19:53:4049页
- 冀教版五年级数学上册第五单元四则2021-05-19 19:53:2910页
- 苏教版数学小学四年级下册教学课件2021-05-19 19:40:5715页
- 部编版五年级上册语文第15课《小岛2021-05-19 19:36:0848页
- 西师大版数学一年级下册教学课件-2021-05-19 19:29:389页
- 人教版PEP小学五年级下册英语教学2021-05-19 19:29:2616页