- 518.00 KB
- 2021-05-12 发布
- 1、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 2、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报QQ:3215808601
安徽省肥东县高级中学2020届高三5月调研考试理科综合
7.短周期主族元素X、Y、Z、W、Q的原子序数依次增加。已知,离子化合物甲是由X、Y、Z、W四种元素组成的,其中,阴阳离子个数比为1∶1,阳离子是一种5核10电子微粒;Q元素原子半径是短周期主族元素中最大的;乙为上述某种元素的最高价氧化物对应的水化物;甲与乙的浓溶液反应生成丙、丁、戊三种物质,其中丁在常温下为气体。下列说法正确的是( )
A. 甲中既含离子键,又含共价键 B. 丙和戊的混合物一定显酸性
C. 丁一定能使湿润的红色石蕊试纸变蓝 D. 原子半径:X<Y<Z<W
8.设阿伏加德罗常数的数值为NA。下列说法正确的是( )
A. 1 L 1 mol·L-1的NaHSO3溶液中含有的离子数为3NA
B. 5.6g乙烯和环丙烷的混合物中含C—H键数目为0.8NA
C. 常温常压下,22.4L的37Cl2中所含的中子数为40NA
D. 硝酸与铜反应生成0.1mol NOx时,转移电子数为0.2NA
9.天然气因含有少量H2S等气体开采应用受限。T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是( )
A. 该脱硫过程需要不断添加Fe2(SO4)3溶液
B. 脱硫过程O2间接氧化H2S
C. 亚铁是血红蛋白重要组成成分,FeSO4可用于治疗缺铁性贫血
D. 《华阳国志》记载“取井火煮之,一斛水得五斗盐”,我国古代已利用天然气煮盐
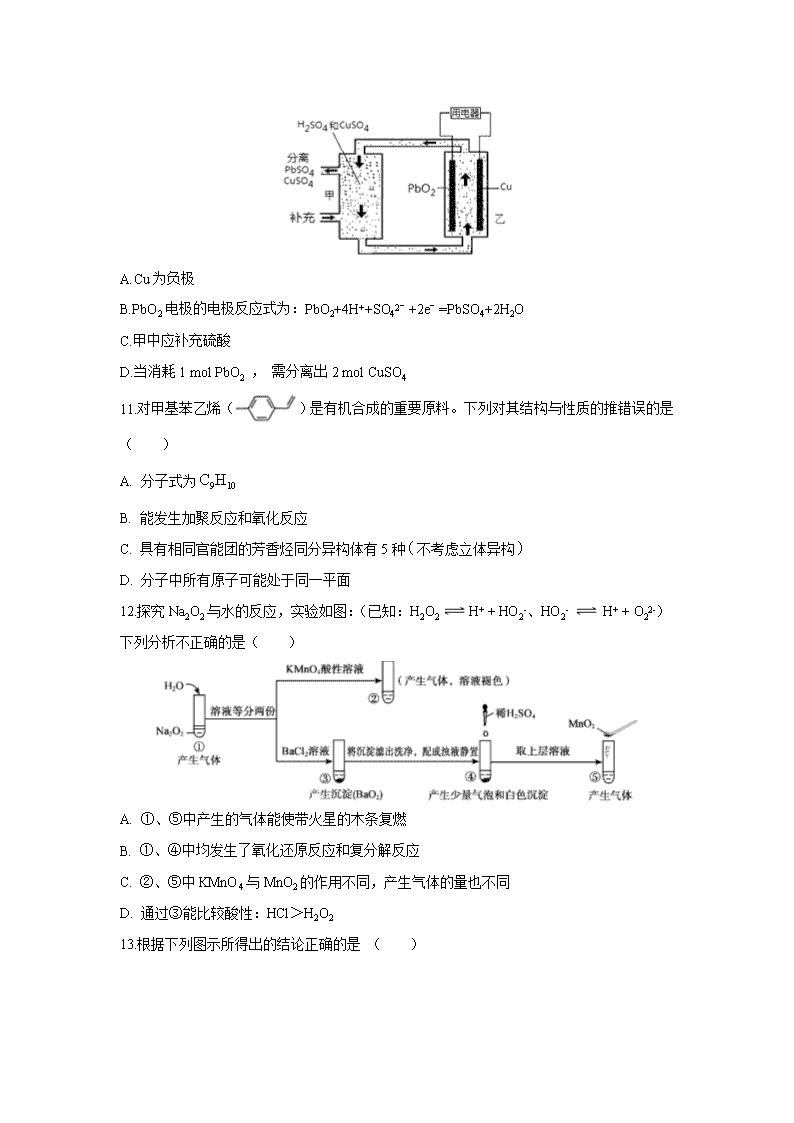
10.流动电池可以在电池外部调节电解质溶液,从而维持电池内部电解质溶液浓度稳定,原理如图.下列说法错误的是( )
A.Cu为负极
B.PbO2电极的电极反应式为:PbO2+4H++SO42﹣+2e﹣=PbSO4+2H2O
C.甲中应补充硫酸
D.当消耗1 mol PbO2 , 需分离出2 mol CuSO4
11.对甲基苯乙烯()是有机合成的重要原料。下列对其结构与性质的推错误的是( )
A. 分子式为
B. 能发生加聚反应和氧化反应
C. 具有相同官能团的芳香烃同分异构体有5种不考虑立体异构
D. 分子中所有原子可能处于同一平面
12.探究Na2O2与水的反应,实验如图:(已知:H2O2 H+ + HO2-、HO2- H+ + O22-)下列分析不正确的是( )
A. ①、⑤中产生的气体能使带火星的木条复燃
B. ①、④中均发生了氧化还原反应和复分解反应
C. ②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D. 通过③能比较酸性:HCl>H2O2
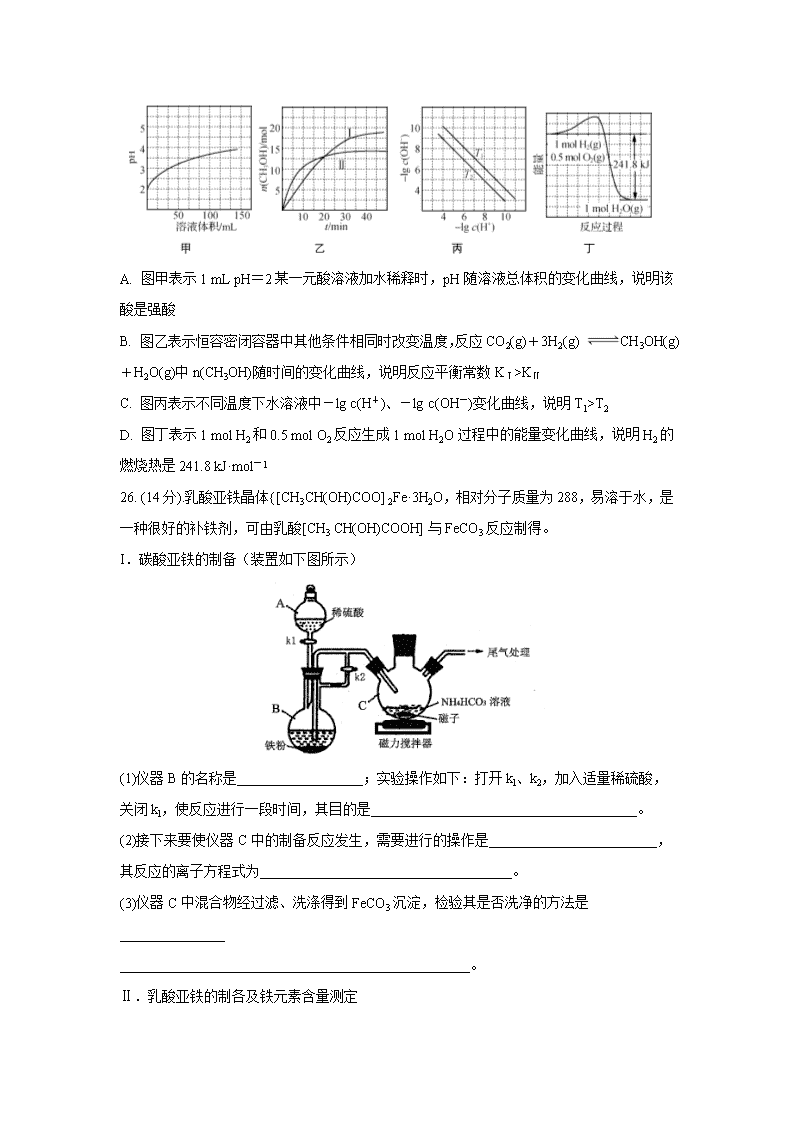
13.根据下列图示所得出的结论正确的是 ( )
A. 图甲表示1 mL pH=2某一元酸溶液加水稀释时,pH随溶液总体积的变化曲线,说明该酸是强酸
B. 图乙表示恒容密闭容器中其他条件相同时改变温度,反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)中n(CH3OH)随时间的变化曲线,说明反应平衡常数KⅠ>KⅡ
C. 图丙表示不同温度下水溶液中-lg c(H+)、-lg c(OH-)变化曲线,说明T1>T2
D. 图丁表示1 mol H2和0.5 mol O2反应生成1 mol H2O过程中的能量变化曲线,说明H2的燃烧热是241.8 kJ·mol-1
26. (14分).乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O,相对分子质量为288,易溶于水,是一种很好的补铁剂,可由乳酸[CH3 CH(OH)COOH]与FeCO3反应制得。
I.碳酸亚铁的制备(装置如下图所示)
(1)仪器B的名称是__________________;实验操作如下:打开kl、k2,加入适量稀硫酸,关闭kl,使反应进行一段时间,其目的是______________________________________。
(2)接下来要使仪器C中的制备反应发生,需要进行的操作是________________________,其反应的离子方程式为____________________________________。
(3)仪器C中混合物经过滤、洗涤得到FeCO3沉淀,检验其是否洗净的方法是_______________
__________________________________________________。
Ⅱ.乳酸亚铁的制各及铁元素含量测定
(4)向纯净FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应,经过滤,在_____________________的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。
(5)两位同学分别用不同的方案进行铁元素含量测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度。在操作均正确的前提下,所得纯度总是大于l00%,其原因可能是 _____________________________________。
②乙同学经查阅资料后改用碘量法测定铁元素的含量计算样品纯度。称取3.000g样品,灼烧完全灰化,加足量盐酸溶解,取所有可溶物配成l00mL溶液。吸取25.00 rnL该溶液加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0. 100 mol·L-1硫代硫酸钠溶液滴定(已知:I2+2S2O32-=S4O62-+2I-),当溶液____________________________________,即为滴定终点;平行滴定3次,硫代硫酸钠溶液的平均用量为24. 80 mL,则样品纯度为_______%(保留1位小数)。
27. (14分)将H2S转化为可再利用的资源是能源研究领域的重要课题。
(1)H2S的转化
Ⅰ
克劳斯法
Ⅱ
铁盐氧化法
Ⅲ
光分解法
①反应Ⅰ的化学方程式是_____________________________________。
② 反应Ⅱ:____+ 1 H2S == ____Fe2+ + ____S↓ + ____(将反应补充完整)。
③ 反应Ⅲ体现了H2S的稳定性弱于H2O。结合原子结构解释二者稳定性差异的原因:______________________________________________。
(2)反应Ⅲ硫的产率低,反应Ⅱ的原子利用率低。我国科研人员设想将两个反应耦合,实现由H2S高效产生S和H2,电子转移过程如图。
过程甲、乙中,氧化剂分别是_______________。
(3)按照设计,科研人员研究如下。
① 首先研究过程乙是否可行,装置如图。经检验,n极区产生了Fe3+,p极产生了H2。n极区产生Fe3+的可能原因:
ⅰ.Fe2+ - e- = Fe3+
ⅱ.2H2O -4e-=O2 +4H+,_______________________________(写离子方程式)。经确认,ⅰ是产生Fe3+的原因。过程乙可行。
② 光照产生Fe3+后,向n极区注入H2S溶液,有S生成,持续产生电流,p极产生H2。研究S产生的原因,设计如下实验方案:_____________________________________________。 经确认,S是由Fe3+氧化H2S所得,H2S不能直接放电。过程甲可行。
(4)综上,反应Ⅱ、Ⅲ能耦合,同时能高效产生H2和S,其工作原理如图。
进一步研究发现,除了Fe3+/Fe2+ 外,I3-/I- 也能实现如图所示循环过程。结合化学用语,说明I3-/I- 能够使S源源不断产生的原因 _________________________________________。
28. (15分)氨气和氯气是重要的工业原料,某兴趣小组设计了相关实验探究它们的某些性质。
实验一:认识喷泉实验的原理,并测定电离平衡常数K(NH3·H2O)。
(1)使图中装置Ⅱ产生喷泉的实验操作是_____________________________________。
(2)喷泉实验结束后,发现三颈烧瓶中未充满水(假如装置的气密性良好),原因是______。用___________(填仪器名称)量取25.00 mL喷泉实验后的氨水至锥形瓶中,用0.0500 mol·L-1的盐酸测定氨水的浓度,滴定曲线如图所示。下列关于该滴定实验的说法中正确的是__________(填字母)。
A.应选择甲基橙作为指示剂
B.当pH=7.0时,氨水与盐酸恰好中和
C.酸式滴定管未用盐酸润洗会导致测定结果偏低
D.当pH=11.0时,K(NH3·H2O)约为2.2×10-5
实验二:拟用如下装置设计实验来探究纯净、干燥的氯气与氨气的反应。
(3)A中所发生反应的化学方程式为__________________________________。
(4)上图中的装置连接顺序为①_________②_________③_________(用大写字母表示)。若按照正确顺序连接实验装置后,则整套实验装置存在的主要缺点是_______________________。
(5)写出F装置中的反应的一种工业用途:___________________________________。
(6)反应完成后,F装置中底部有固体物质生成。请利用该固体物质设计一个实验方案证明NH3·H2O为弱碱(其余实验用品自选):___________________________________。
35. [化学-选修3:物质结构与性质] (15分)
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有__________个。
②LiBH4由Li+和BH4-构成,BH4-的空间构型是__________,B原子的杂化轨道类型是_____。
③某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/kJ·mol-1
I2/kJ·mol-1
I3/kJ·mol-1
I4/kJ·mol-1
I5/kJ·mol-1
738
1451
7733
10540
13630
M是_______(填元素符号),判断理由为_________________________________。
(2)铜晶体中铜原子的堆积方式如下左图所示,铜晶体中原子的堆积模型属于____________。
(3)A原子的价电子排布式为3s23p5,铜与A 形成化合物的晶胞如上右图所示(黑点代表铜原子)。
①该晶体的化学式为______________。
②该化合物难溶于水但易溶于氨水,其原因是_______________________________ ,此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为____________。
③己知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,己知该晶体中Cu原子和A原子之间的最短距离为体对角线的1/4,则该晶体中Cu原子和A原子之间的最短距离为________pm。
36. [化学-选修5:有机化学基础] (15分)
盐酸金刚烷胺是一种治疗和预防病毒性感染的药物,可用于抑制病毒穿入宿主细胞,从结构上看是一种对称的三环状胺,可以利用环戊二烯(CPD)来制备合成,流程图如下:
(1)下列关于X和金刚烷说法正确的是_________
A.金刚烷和X互为同分异构体,均可以发生氧化反应和取代反应
B.金刚烷和X均可以使溴水褪色
C.金刚烷和X均具有与芳香烃相似的化学性质
D.金刚烷和X均不存在手性碳原子
(2)反应①的反应类型为____________,反应②的条件为________________。
(3)有机物Y的一氯代物的同分异构体的数目为___________,写出Y与氢氧化钠的乙醇溶液反应的化学方程式___________________________________。
(4)有机物Z是一种重要的有机氮肥,在核磁共振氢谱谱图中只有一个峰,写出Z与浓硫酸反应的化学方程式___________________________________。
(5)CPD可以与Br2的CC14溶液反应,写出其所有可能产物的结构简式_______________。
(6)参照上述流程图,并用流程图中出现的试剂和为原料合成,
设计其合成路线_________。
【参考答案】
7
8
10
11
12
13
A
B
D
D
D
B
7.A
【解析】短周期主族元素X、Y、Z、W、Q的原子序数依次增加。离子化合物甲是由X、Y、Z、W四种元素组成的,其中阴阳离子个数比为1∶1,阳离子是一种5核10电子微粒,该阳离子为NH4+,则X为H元素;Q元素原子半径是短周期主族元素中最大的,则Q为Na元素,因此Y、Z、W均为第二周期元素,阴离子组成元素的原子序数小于Na,则阴离子为碳酸氢根离子,则甲为NH4HCO3,因此Y为C元素、Z为N元素、W为O元素;乙为上述某种元素的最高价氧化物对应的水化物;甲与乙的浓溶液反应生成丙、丁、戊三种物质,则乙为氢氧化钠或硝酸,与碳酸氢铵反应生成氨气,碳酸钠和水或硝酸铵、二氧化碳和水,其中丁在常温下为气体,则丁为氨气或二氧化碳,据此分析解答。根据上述分析,X为H元素,Y为C元素,Z为N元素,W为O元素,Q为Na元素,甲为NH4HCO3,乙为NaOH或硝酸,丁为氨气或二氧化碳,丙、戊为碳酸钠或硝酸铵和水。
A.甲为NH4HCO3,属于离子化合物,含有离子键,铵根离子、HCO3-中还含有共价键,故A正确;
B.丙和戊的混合物可能为碳酸钠溶液或硝酸铵溶液,碳酸钠水解后溶液显碱性,故B错误;
C.丁可能为二氧化碳,二氧化碳不能使湿润的红色石蕊试纸变蓝,故C错误;
D.同一周期,从左到右,原子半径逐渐减小,同一主族,从上到下,原子半径逐渐增大,原子半径:X<W<Z<Y,故D错误;答案选A。
8.B
【解析】A. HSO3-属于弱酸酸式阴离子,在溶液中既存在水解平衡又存在电离平衡,1 L 1 mol·L-1的NaHSO3溶液中含有的离子数不是3NA,故A错误;B. 乙烯和环丙烷的最简式为CH2,5.6g的混合物中含CH2物质的量为0.4mol,所以含C—H键数目为0.8NA,故B正确;C. 标准状况下,22.4L的37Cl2中所含的中子数为40NA,常温常压下中子数不为40NA,故C错误;D.NOx可能是NO或NO2, 根据得失电子守恒可得,生成0.1mol NOx转移电子数介于0.10.3 mol之间,故D错误;答案:B。
9.A
【解析】A.T.F菌在酸性溶液中可实现天然气的催化脱硫,Fe2(SO4)3
氧化硫化氢,自身被还原成硫酸亚铁(相应反应为2Fe3++H2S=2Fe2++S↓+2H+),硫酸亚铁被氧气氧化成硫酸铁(相应反应为4Fe2++O2+4H+=4Fe3++2H2O),根据反应可知,该脱硫过程不需要不断添加Fe2(SO4)3溶液,A错误;
B.脱硫过程:Fe2(SO4)3氧化硫化氢,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,脱硫过程O2间接氧化H2S,B正确;
C.亚铁是血红蛋白的重要组成成分,起着向人体组织传送O2的作用,若缺铁就可能出现缺铁性贫血,FeSO4可用于治疗缺铁性贫血,C正确;
D.天然气主要成分为甲烷,甲烷燃烧放出热量,《华阳国志》记载“取井火煮之,一斛水得五斗盐”,我国古代已利用天然气煮盐,D正确;故合理选项是A。
10.D
【解析】A.根据电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O,则铜失电子发生氧化反应为负极,故A正确;
B.PbO2得电子发生还原反应为正极,反应式为:PbO2+4H++SO42﹣+2e﹣═PbSO4+2H2O,故B正确;
C.由电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O,则调节电解质溶液的方法是补充H2SO4 , 故C正确;
D.电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O,当消耗1 mol PbO2 , 需分离出1mol CuSO4 , 故D错误;故选D.
11.D
【解析】对甲基苯乙烯()含有甲基、苯环和碳碳双键,具有苯、乙烯的结构特点和性质。
A项、对甲基苯乙烯()含有9个碳和10个氢,分子式为C9H10,故A正确;
B项、含有碳碳双键,可发生加聚反应和氧化反应,故B正确;
C项、含有两个支链时,有邻间对三种结构,含有一个支链时:支链为-CH=CH-CH3、-CH2CH=CH2、-C(CH3)=CH2,除了本身,一共有5种同分异构体,故C正确;
D项、含有苯环和碳碳双键,都为平面形结构,处于同一平面,分中含有-CH3,甲基为四面体结构,所以分子中所有原子不可能处于同一平面,故D错误。
故选D。
12.D
【解析】根据实验探究可以看出,试管①过氧化钠与水反应生成氢氧化钠与氧气,试管②中高锰酸钾具有氧化性,产生气体,溶液褪色,则体现了过氧化氢的还原性;试管③中过氧化氢与氯化钡发复分解反应生成过氧化钡沉淀与稀盐酸,试管④中过氧化钡再与稀硫酸反应生成过氧化氢与硫酸钡沉淀,试管⑤中探究过氧化氢在二氧化锰催化剂作用下分解生成水和氧气,据此分析作答。
A. 试管①中过氧化钠与水反应最终生成氢氧化钠与氧气,试管⑤中过氧化氢在二氧化锰催化剂作用下分解生成水和氧气,因此产生的气体均能是带火星的木条复燃,A项正确;
B. ①中的反应机理可以认为过氧化钠与水反应生成过氧化氢与氢氧化钠,过氧化氢分解生成水和氧气,发生的反应为复分解与氧化还原反应,④中过氧化钡再与稀硫酸反应生成过氧化氢与硫酸钡沉淀,过氧化氢分解产生了氧气,因此两个试管中均发生了氧化还原反应和复分解反应,B项正确;
C. ②中KMnO4与过氧化氢反应生成氧气,KMnO4体现氧化性,而⑤中MnO2则起催化作用,两个试管中产生氧气的量均由过氧化氢的量决定,因溶液是等分的,所以产生气体的量相同,C项正确;
D. 根据已知条件可以看出过氧化氢属于二元弱酸,而盐酸属于一元强酸。试管③因为生成了过氧化钡沉淀,不是可溶性的盐溶液,则不能证明盐酸与过氧化氢的酸性强弱,D项错误;答案选D。
13.B
【解析】A. 图甲表示1 mL pH=2某一元酸溶液加水稀释时,pH随溶液总体积的变化曲线,当体积为100mL时,溶液体积增大100倍,pH<4,说明存在电离平衡,则该酸是弱酸,选项A错误;
B、根据图中信息可知曲线Ⅱ反应速率快,温度较高,升高温度,平衡时n(CH3OH)较小,则平衡向逆反应方向移动,平衡常数KⅠ>KⅡ,选项B正确;
C. 升高温度促进水的电离,c(H+)、c(OH-)增大,-lg c(H+)、-lg c(OH-)减小,图丙表示不同温度下水溶液中-lg c(H+)、-lg c(OH-)变化曲线,说明T1O,得电子能力S