- 254.00 KB
- 2021-05-21 发布
山西省晋中市和诚中学2019-2020学年高二下学期4月月考试题
考试时间:90分钟 满分:100分
一、 选择题(每个3分,共48分)
1.某元素基态原子的电子排布式为[Ar]3d74s2,它在元素周期表中的位置是( )
A.第3周期ⅡB族 B.第4周期ⅡB族
C.第4周期ⅦB族 D.第4周期Ⅷ族
2.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z原子的最外层电子数是内层电子总数的3倍。下列有关叙述正确的是( )
A.Y原子的价层电子排布式为3s23p5 B.稳定性:Y的氢化物>Z的氢化物
C.第一电离能:Y<Z D.X、Y两元素形成的化合物为离子化合物
3.设X、Y、Z代表元素周期表中前4周期中的三种元素,已知X+和Y-具有相同的电子层结构;Z的原子核内质子数比Y的原子核内质子数少9;Y和Z可形成含4个原子核、42个电子的负一价阴离子。下列说法不正确的是( )
A.Z的简单氢化物分子中含有10个电子
B.Y的气态氢化物分子中含有18个电子
C.Z与元素X形成的化合物X2Z中离子都达到稳定结构
D.Y、Z组成的化合物属于离子化合物
4.有五种元素、、、、。元素为主族元素,原子的层上有两个未成对电子且无空轨道;原子的价电子排布式为;Z原子的电子层的亚层上有一个空轨道;原子的电子层的亚层上只有一对成对电子;原子的电子层上轨道半充满。下列叙述不正确的是( )
A.元素和可形成化合物
B. 与的最高价氧化物对应的水化物,前者的酸性比后者强
C. 和结合生成的化合物为离子化合物
D.是由极性键构成的非极性分子
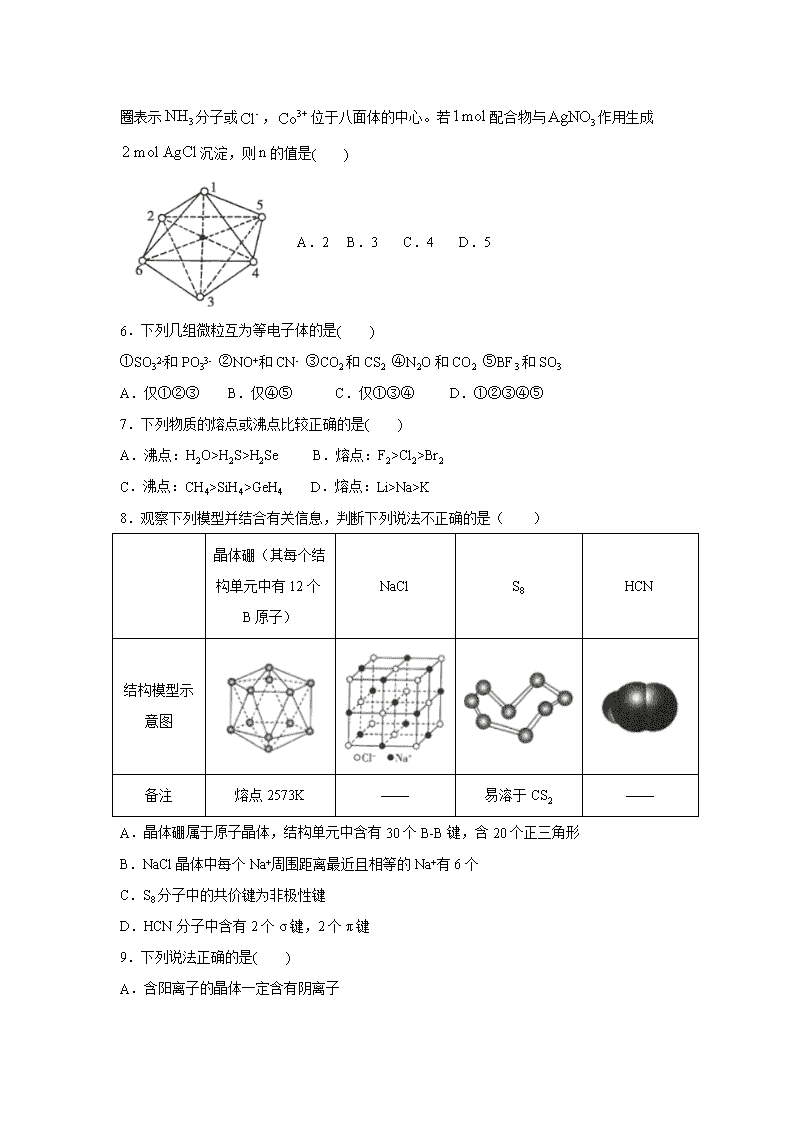
5.的八面体配合物
中配离子的空间构型如图所示,其中数字处的小圆圈表示分子或,位于八面体的中心。若配合物与作用生成沉淀,则的值是( )
A.2 B.3 C.4 D.5
6.下列几组微粒互为等电子体的是( )
①SO32-和PO33- ②NO+和CN- ③CO2和CS2 ④N2O和CO2 ⑤BF3和SO3
A.仅①②③ B.仅④⑤ C.仅①③④ D.①②③④⑤
7.下列物质的熔点或沸点比较正确的是( )
A.沸点:H2O>H2S>H2Se B.熔点:F2>Cl2>Br2
C.沸点:CH4>SiH4>GeH4 D.熔点:Li>Na>K
8.观察下列模型并结合有关信息,判断下列说法不正确的是( )
晶体硼(其每个结构单元中有12个B原子)
NaCl
S8
HCN
结构模型示意图
备注
熔点2573K
——
易溶于CS2
——
A.晶体硼属于原子晶体,结构单元中含有30个B-B键,含20个正三角形
B.NaCl晶体中每个Na+周围距离最近且相等的Na+有6个
C.S8分子中的共价键为非极性键
D.HCN分子中含有2个σ键,2个π键
9.下列说法正确的是( )
A.含阳离子的晶体一定含有阴离子
B.沸点由高到底的顺序:HF>HI>HBr>HCl
C.含有共价键的晶体一定具有高的熔沸点及硬度
D.空间利用率面心立方最密堆积>六方最密堆积>体心立方密堆积
10.有关晶体的下列说法中正确的是( )
A.晶体中分子间作用力越大,分子越稳定 B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂 D.氯化钠熔化时离子键未被破坏
11.甲、乙两容器都在进行A→B的反应,甲容器内每分钟减少4mol A,乙容器内每分钟减少2mol A,则甲容器内的反应速率与乙容器内的反应速率相比( )
A.甲快 B.甲慢 C.相等 D.无法判断快慢
12.下列说法正确的是( )
①氢键是一种化学键 ②由非金属元素组成的化合物可能是离子化合物 ③离子键只是阳离子、阴离子的相互吸引 ④气体单质分子中一定含有共价键 ⑤由不同种元素组成的多原子分子中,一定只存在极性共价键 ⑥离子化合物中可能有共价键 ⑦共价化合物中可能有离子键
A.②⑥ B.①②③ C.②④⑤ D.②④⑤⑥
13.硼和镁形成的化合物可刷新金属化合物超导温度的最高记录。下图是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下面还各有一个镁原子;6个硼原子位于棱柱的侧棱上,则该化合物的化学式可表示为( )
A.Mg3B2 B.MgB2 C.Mg2B3 D.Mg2B
14.若ABn的中心原子A上没有未用于形成共价键的孤电子对,运用价层电子对互斥理论,下列说法正确的是( )
A.若n=2,则分子的空间构型为V形
B.若n=3,则分子的空间构型为三角锥形
C.若n=4,则分子的空间构型为正四面体形
D.以上说法都不正确
15.正硼酸(H3BO3
)是一种片层状结构白色晶体,有与石墨相似的层状结构,受热易分解,层内的H3BO3分子通过氢键相连(如图所示),则下列有关说法中不正确的( )
A.正硼酸晶体属于分子晶体
B.正硼酸分子的稳定性与氢键无关
C.1molH3BO3晶体中含有3mol氢键
D.B原子杂化轨道的类型sp2,层间的H3BO3分子通过共价键相连
16.下列说法不正确的是( )
A.CS2中所含所有原子的最外层电子数均为8
B.沸点: CH4O>C O>N>C Na的半径小,形成的金属键键能大,熔点高
18.sp3 60º As>Se>Ge PH3 三角锥形 < S 原子半径小于P原子半径故 S-Cl 键要比 P-Cl 键短 GaAs
19.3d104s1 Cr 光谱分析 减弱 金属键 HCOOH、CH3OH存在氢键,且HCOOH中氢键更强,HCHO分子间存在范德华力,氢键比范德华力更强 HCHO CH4中C原子采取sp3杂化,HCHO中C原子采取sp2杂化 六方最密堆积
20.3d104s2 O>Cl V形 sp3 ClO3- SO32- 分子 分子间作用力(范德华力)和共价键 CaTiO3