- 624.68 KB
- 2021-05-20 发布
高考理科综合(化学部分)模拟试题
可能用到的相对原子质量: H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 Cl-35.5
K-39 Fe-56 Cu-64 Mo-96
7.《本草纲目》记载了烧酒的制造工艺: “凡酸坏之酒,皆可蒸烧 ”, “以烧酒复烧二次 ⋯⋯ 价值
数倍也 ”。其方法与分离下列物质的实验方法原理上相同的是
A.甲苯和水 B.硝酸钾和氯化钠
C.乙酸乙酯和乙酸 D.食盐水和泥沙
8.设 NA 为阿伏伽德罗常数的值,下列说法正确的是
A.1mol Mg 在空气中完全燃烧生成 MgO 和 Mg3N2,转移的电子数为 NA
B.14g 分子式为 CnH2n 的链烃中含有的 C-H 键的数目为 2NA
C.室温时, 1.0 L pH=13 的 Ba(OH)2 溶液中含有 OH-的数目为 0.2NA
D.Fe与水蒸气反应生成 22.4L 氢气,转移电子数为 2NA
9.电浮选凝聚法是工业上采用的一种污水处理方法, 即保持污水的 pH 在 5.0-6.0 之间, 通过电解
生成 Fe(OH)3 胶体。 Fe(OH)3胶体具有吸附作用, 可吸附污物而使其沉淀下来, 起到净水的作用,
其原理如图所示。下列说法正确的是
A.石墨电极上发生氧化反应
B.根据图示,物质 A 为 CO2
C.为增强污水的导电能力,可向污水中加入适量乙醇
D.甲烷燃料电池中 CO32-向空气一极移动
10.从薄荷中提取的薄荷醇可制成医药。薄荷醇的结构简式如下图,下列说法正确的是
A.薄荷醇分子式为 C10H20O,它是环己醇的同系物
B.薄荷醇的分子中至少有 12 个原子处于同一平面上
C.薄荷醇在 Cu 或 Ag 做催化剂、加热条件下能被 O2 氧化为醛
D.在一定条件下,薄荷醇能发生取代反应、消去反应和聚合反应
11.X、Y、Z、M、W 为五种短周期主族元素, X、 Y、Z 是原子序数依次递增的同周期元素,且最
外层电子数之和为 15;X 与 Z 可形成 XZ2 分子; Y 与 M 形成的气态化合物溶于水后溶液呈碱性;
W 的质子数是 X、Y、Z、M 四种元素质子数之和的 1/2。下列说法正确的是
A.简单的离子半径: W>Z>Y>X
B.五种元素中只有 X 存在同素异形体
C.W 和 M 形成的化合物是离子化合物
D.工业上采用电解 W 和 Z 形成的化合物制备 W 单质
12.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项 实验 现象 结论
A 向 KI 溶液中加入 CCl4,振荡后
静置
液体分层,下两层呈紫红色 碘易溶于 CCl4,难溶于水
B 向某溶液中滴加 BaCl2 溶液,随
后加稀硝酸酸化
溶液中产生白色沉淀, 加稀硝酸
不溶解
原溶液中一定含有 SO42-
C 将西硫酸酸化的 H2O2 溶液滴入
Fe(NO3)2溶液中
溶液变黄色 氧化性: H2O2 比 Fe3+强
D 向含有酚酞的 Na2CO3溶液中加
入少量的 BaCl2固体
溶液红色变浅 证明 Na2CO3溶液中存在水解平
衡
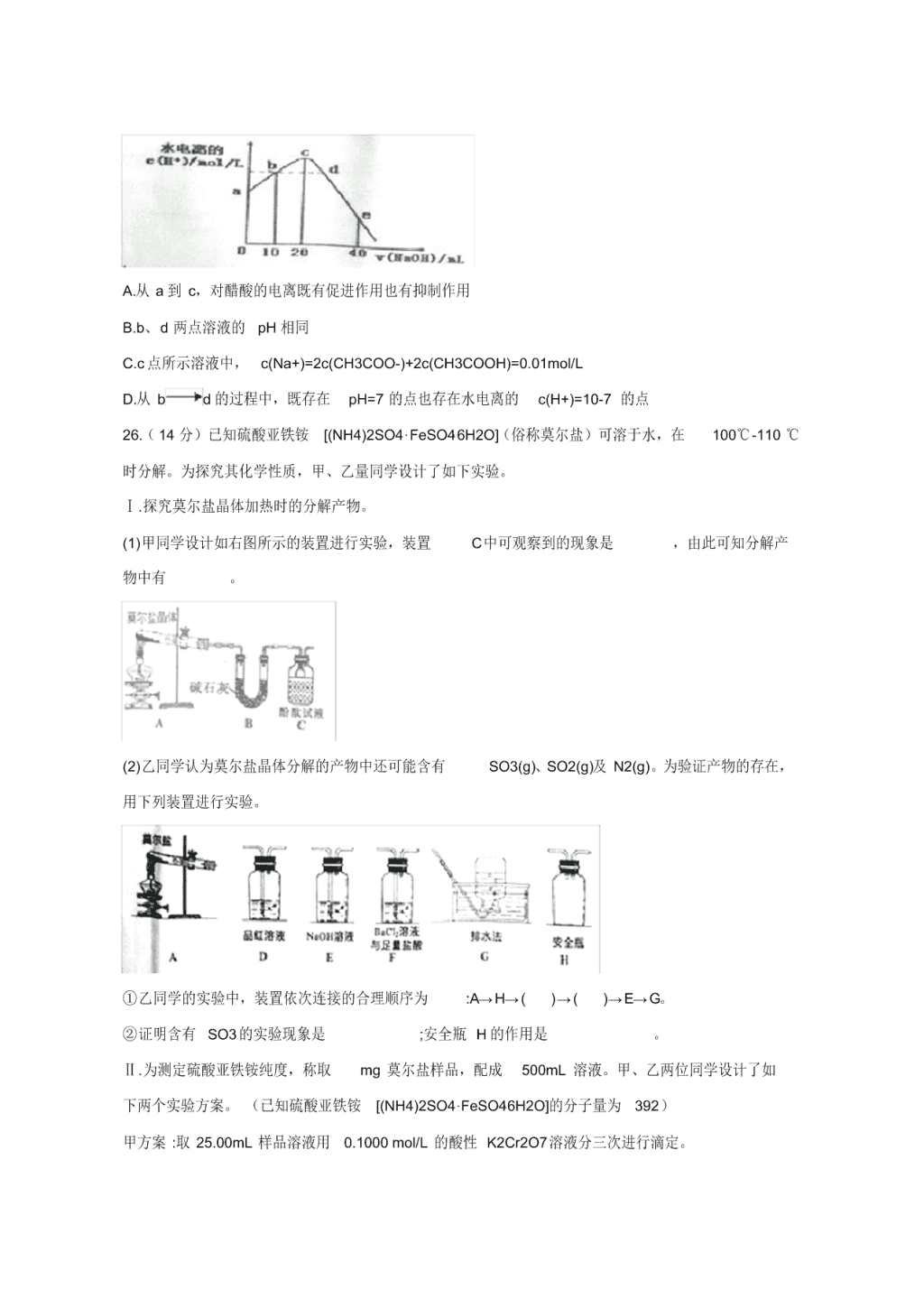
13.常温下,向 20mL 0.1mol/L CH3COOH溶液中逐滴加入 0.01mol/L 的 NaOH溶液,溶液中水所电
离出的 c(H+)随加入 NaOH溶液的体积变化示意图如下,下列说法正确的是
A.从 a 到 c,对醋酸的电离既有促进作用也有抑制作用
B.b、d 两点溶液的 pH 相同
C.c 点所示溶液中, c(Na+)=2c(CH3COO-)+2c(CH3COOH)=0.01mol/L
D.从 b d 的过程中,既存在 pH=7 的点也存在水电离的 c(H+)=10-7 的点
26.( 14 分)已知硫酸亚铁铵 [(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐)可溶于水,在 100℃-110 ℃
时分解。为探究其化学性质,甲、乙量同学设计了如下实验。
Ⅰ.探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如右图所示的装置进行实验,装置 C中可观察到的现象是 ,由此可知分解产
物中有 。
(2)乙同学认为莫尔盐晶体分解的产物中还可能含有 SO3(g)、SO2(g)及 N2(g)。为验证产物的存在,
用下列装置进行实验。
①乙同学的实验中,装置依次连接的合理顺序为 :A→H→( )→( )→E→G。
②证明含有 SO3的实验现象是 ;安全瓶 H 的作用是 。
Ⅱ.为测定硫酸亚铁铵纯度,称取 mg 莫尔盐样品,配成 500mL 溶液。甲、乙两位同学设计了如
下两个实验方案。 (已知硫酸亚铁铵 [(NH4)2SO4·FeSO4·6H2O]的分子量为 392)
甲方案 :取 25.00mL 样品溶液用 0.1000 mol/L 的酸性 K2Cr2O7溶液分三次进行滴定。
乙方案 :(通过 NH4+ 测定 )实验设计装置如下图所示。取 25.00 mL 样品溶液进行该实验。
请回答 :
(1)甲方案中的离子方程式为 : 。
(2)乙方案中量气管中最佳试剂是 。
a.水 b.饱和 NaHCO3溶液 c.CCl4
(3)乙方案中收集完气体并恢复至室温,读数前应进行的操作是 。
27.(14 分)乙醛酸( OHC-COOH)是合成名贵香料的原料之一。
I.由乙二醛催化氧化制乙醛酸的反应如下: 2OHC-CHO(g)+O2(g) 2OHC-COOH(g)△H
(1)已知反应中相关的化学键键能数据如表 1:
化学键 O=O C-O O-H C-H
键能( KJ/mol) 498 351 465 413
计算上述反应的 △H= kJ·mol-1 。
(2)一定条件下, 按照 投料比进行上述反应, 乙二醛的平衡转化率 (a)和催化剂催化
效率随温度变化如图 1 所示。
①该反应在 A 点放出的热量 (填“>”、 “=”或 “v(B),你认为此结论是否正确,简述理由。
③图中 A 点时,乙醛酸的体积分数为 。
④为提高乙二醛的平衡转化率,除改变投料比、温度外,还可以采取的措施有 (列举
一条 )。
Ⅱ.利用惰性电极电解饱和乙二酸和稀硫酸溶液也可以制备乙醛酸,原理如右图所示。
(1)图中的离子交换膜为 (填“阳”或 “阴”)膜。
(2)稀硫酸的作用为 。
(3)生成乙醛酸的电极反应式为 。
28.( 15 分)钼 (Mo) 是一种过度金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体
(Na2MoO4?2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是
不溶于水的 MoS2)制备钼酸钠及制备金属钼的主要流程图如图所示:
(1)Na2MoO4·2H2O中钼元素的化合价是 ,结晶得到的钼酸钠晶体时粗产品,要得到纯
净的钼酸钠晶体,下一步需要进行的操作是 (填名称) 。
(2)焙烧过程中钼精矿发生的主要反应的化学方程式为 MoS2+O2 MoO3+SO2(未配平 ),该反
应中氧化产物是 __________( 填化学式 );若反应中生成 36.0gMoO3,反应中转移电子的数目
为 。
(3)尾气中含有 SO2需要处理,下列不能用作吸收剂的是 (填序号) 。
a.Ca(OH)2 b.HNO3 c.Na2CO3
(4)加入 Na2CO3 溶液时发生反应的化学方程式为 。能提高该反应速率的措施有
(填序号) 。
a.将粗产品粉碎 b.降低碳酸钠溶液的浓度 c.适当升高温度
(5)利用铝热反应也可回收金属钼,写出 MoO3 发生铝热反应的化学方程式 。
(6)已知钼酸钠溶液中 c(MoO42-)=0.40mol ?L-1 , c(CO32-)=0.52mol?L-1 ,由钼酸钠溶液制备钼
酸钠晶体时,需加入 Ba(OH)2 固体以除去 CO32-,当 BaMoO4 开始沉淀时, CO32-的去除率
为 。[已知: Ksp(BaMoO4)=4.0×10-8, 忽略溶液的体积变化 ]
35.【化学 —— 选修 3:物质结构与性质】 (15 分)
钛的化合物如 TiO2、 Ti(NO3)4、TiCl4、Ti(BH4)2 等均有着广泛用途。
(1)写出 Ti 的基态原子的外围电子排布式 。
(2)TiCl4 熔点是 -25 ℃,沸点 136.4℃,可溶于苯或 CCl4,该晶体属于 晶体; BH4-中 B
原子的杂化类型为 ;
(3)在 TiO2 催化作用下,可将 CN-氧化成 CNO-,进而得到 N2。与 CNO-互为等电子体的分
子化学式为 。
(4)Ti3+可以形成两种不同的配合物: [Ti(H2O)6]Cl3(紫色),[TiCl(H2O)5]Cl2?H2O(绿色) ,两
者配位数 (填 “相同 ”或 “不同 ”),绿色晶体中配体是 。
(5)TiO2 难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状
聚合形式的阳离子,其结构形式如图 1,化学式为 。
(6)金属钛内部原子的堆积方式是面心立方堆积方式,如图 2。若该晶胞的密度为 ρg/cm3,阿
伏加德罗常数为 NA,则该晶胞的边长为 ______________cm。
36.【化学 —— 选修 5:有机化学基础】 (15 分)
苯酚是一种重要的化工原料,以苯酚为主要起始原料,经下列反应可制得香料 M 和高分子化合
物 N。(部分产物及反应条件已略去)
(1)有机物 B 的名称是 。
(2)已知 C 的分子式为 C5H12O,C 能与金属 Na 反应, C 的一氯代物有 2 种. C 的结构简式
是 .
(3)B 与 C 反应的反应类型是 由 D 生成 N 的反应类型是 。
(4)由苯酚生成 D 的化学方程式是 。
(5)F 是分子量比 B 大 14 的同系物,则 F的分子式是 ,F 有多种同分异构体,符合下
列条件的同分异构体有 种。
①属于芳香族化合物;
②遇 FeCl3溶液显紫色,且能发生水解反应;
③苯环上有两个取代基,且苯环上的一溴代物只有两种。
(6)已知: ,写出以苯酚、乙醇和 CH2ClCOOH
为原料制备 的合成路线流程图(无机试剂任用) 。
合成路线流程图示例如下:
一、选择题(每小题 6 分,共 42 分)
7 8 9 10 11 12 13
C B B A C D D
二、非选择题
26.(14 分)
I.(1)溶液变红( 1 分) NH3(1 分)
(2)①FDE (2分 ) ② F中出现白色沉淀( 1 分) 防倒吸( 1 分)
II.(1)Cr2O7 2-+ 6Fe2++14H+ =2Cr3++ 6Fe3++ 7H2O (2 分)
(2)c (2 分)
(3)上下移动量气管(滴定管) ,使左右两边液面相平( 2 分)
(4)175V/m*100% 或 (2 分 )
27.(14 分)
I.(1)-308 (2 分)
(2)①>( 1 分)
②不正确( 1 分) 温度越高, 催化效率越高, 化学反应速率越快, 而 A 点的温度低、 催化效率高,
B 点的温度高、催化效率低,所以无法比较速率大小( 2 分)
③50%( 2 分)
④增大压强或及时分离出乙醛酸( 1 分)
II.(1)阳( 1 分)
(2)提供 H+,作电解质溶液( 2 分)
(3)HOOC-COOH + 2H+ + 2e- = OHC-COOH + H2O( 2 分)
28.(15 分 )
(1)+6(1 分) 重结晶( 1 分) (2)MoO3、SO2(2 分) 3.5NA(2 分)
(3)b(1 分) ( 4)MoO3+Na2CO3=Na2MoO4+CO2↑(2 分) ac(2 分)
(5)4Al+2MoO3 2Mo+2Al2O3(2 分)
(6)95%(2 分)
35.(15 分,无特殊说明,每空 2 分)
(1)3d24s2( 2 分)
(2)分子晶体( 1 分);sp3(1 分);
(3)CO2(或 N2O、CS2、BeCl2等合理均可给分,写成离子的不得分 )( 2 分)
(4)相同( 2 分); Cl﹣、 H2O ( 2 分)
(5) [TiO]n2n+ (2 分)
(6) (3 分)(列式正确即得分)
36 .( 共 15 分 )( 1 ) 邻 羟 基 苯 甲 酸 ( 2 分 ) ( 2 )
(2 分)
(3)取代反应、 缩聚反应(每空 1 分)
( 4 )
(2 分)
( 5 ) C8H8O3 3(每空 2 分)
(6)
(3 分,
写对一步得 1 分)