- 771.90 KB
- 2021-05-20 发布
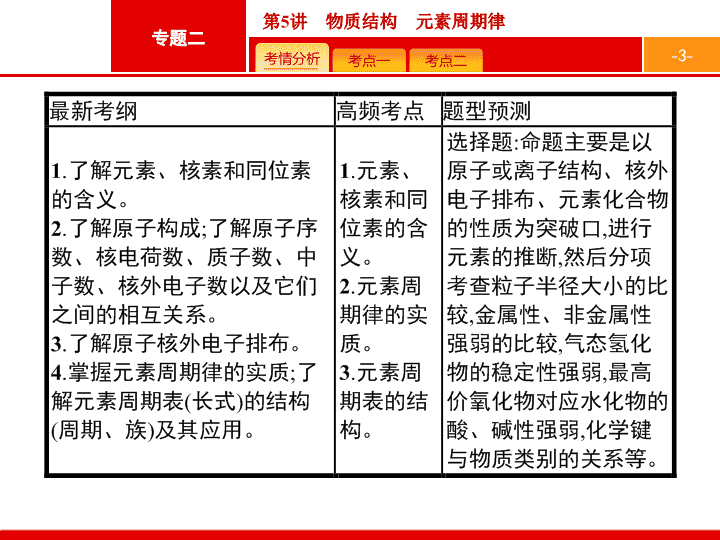
专题二 化学基本理论
第
5
讲 物质结构 元素周期律
-
3
-
-
4
-
-
5
-
精要排查
真题示例
知能提升
对点演练
原子结构及化学键
1
.
判断正误
,
正确的划
“
√
”,
错误的划
“×”
。
(3)
同位素的化学性质基本相同
,
其物理性质不一定相同
(
√
)
(4)
两种原子
,
若核外电子排布相同
,
则一定属于同种元素
(
√
)
(5)
不存在质子数和电子数完全相同的阳离子和阴离子
(
√
)
(6)
化学变化中一定存在化学键的断裂和形成
,
物理变化中一定不存在化学键的断裂和形成
(
×
)
(7)
在离子化合物里
,
只存在离子键
,
没有共价键
(
×
)
(8)
非极性键只存在于双原子的单质分子
(
如
Cl
2
)
中
(
×
)
-
6
-
精要排查
真题示例
知能提升
对点演练
2
.(1)
质量数
=
质子数
+
中子数
。
(2)
质子数
=
阳离子的核外电子数
+
(
填
“+”
或
“-”,
下同
)
阳离子所带电荷数。
(3)
质子数
=
阴离子的核外电子数
-
阴离子所带电荷数。
3
.
用
“
同素异形体
”“
同位素
”“
同系物
”
或
“
同分异构体
”
填空。
(2)O
2
、
O
3
——
同素异形体
。
(3)CH
3
CH
3
、
CH
3
CH
2
CH
3
——
同系物
。
(4)
正戊烷、新戊烷
——
同分异构体
。
-
7
-
精要排查
真题示例
知能提升
对点演练
4
.
指出下列物质中含有的化学键类型。
(1)Na
2
O
2
离子键、共价键
;(2)AlCl
3
共价键
;
(3)NH
4
Cl
离子键、共价键
;(4)NaH
离子键
;(5)NH
3
·H
2
O
共价键
。
-
8
-
精要排查
真题示例
知能提升
对点演练
1
.(2018
课标
Ⅲ
,8,6
分
)
下列叙述正确的是
(
)
A.24 g
镁与
27 g
铝中
,
含有相同的质子数
B.
同等质量的氧气和臭氧中
,
电子数相同
C.1 mol
重水与
1 mol
水中
,
中子数比为
2
∶
1
D.1 mol
乙烷和
1 mol
乙烯中
,
化学键数相同
答案
解析
解析
关闭
24 g
镁和
27 g
铝的物质的量都是
1 mol,
分别含有
12
N
A
、
13
N
A
个质子
,A
项错误
;
氧气和臭氧是同素异形体
,
两种分子均由氧原子构成
,
故同等质量氧气和臭氧所含原子数相同
,
则电子数也相同
,B
项正确
;
重水和水分子中的中子数分别是
10
、
8,
相同物质的量的重水和水所含的中子数之比为
5
∶
4,C
项错误
;
乙烷分子中有
7
个化学键
,
乙烯分子中有
5
个化学键
,D
项错误。
答案
解析
关闭
B
-
9
-
精要排查
真题示例
知能提升
对点演练
2
.(2017
北京
,7,6
分
)2016
年
IUPAC
命名
117
号元素为
Ts(
中文名
“ ”,
tián
),Ts
的原子核外最外层电子数是
7
。下列说法不正确的是
(
)
A.Ts
是第七周期第
ⅦA
族元素
B.Ts
的同位素原子具有相同的电子数
C.Ts
在同族元素中非金属性最弱
答案
解析
解析
关闭
答案
解析
关闭
-
10
-
精要排查
真题示例
知能提升
对点演练
3
.(2017
课标
Ⅱ
,9,6
分
)a
、
b
、
c
、
d
为原子序数依次增大的短周期主族元素
,a
原子核外电子总数与
b
原子次外层的电子数相同
;c
所在周期数与族数相同
;d
与
a
同族。下列叙述正确的是
(
)
A.
原子半径
:d>c>b>a
B.4
种元素中
b
的金属性最强
C.c
的氧化物的水化物是强碱
D.d
单质的氧化性比
a
单质的氧化性强
答案
解析
解析
关闭
由于都是主族元素
,
故
a
原子核外电子总数只能是
8,a
为氧元素
;a
、
b
、
c
、
d
为短周期元素
,
原子序数依次增大
,c
所在周期序数与族序数相同
,c
为
Al,
则
b
为
Na
或
Mg
元素
;d
与
a
同族
,
则
d
为硫元素。
A
项
,
同周期主族元素
,
从左到右原子半径逐渐减小
,
电子层数越多
,
原子半径越大
,
故原子半径
:Na(
或
Mg)>Al>S>O,A
项错误
;4
种元素中
Na(
或
Mg)
的金属性最强
,B
项正确
;
铝的氧化物对应的水化物是两性氢氧化物
,C
项错误
;D
项
,S
的氧化性弱于
O
2
,D
项错误。
答案
解析
关闭
B
-
11
-
精要排查
真题示例
知能提升
对点演练
名师揭密
原子结构、离子结构是物质结构的核心内容
,
同样也是高考的重要考点。相关的题目主要是以原子
(
或离子
)
结构、核外电子排布、元素化合物的性质为突破口
,
进行元素的推断
,
然后判断或解决相关的问题
,
主要题型为选择题。复习该部分内容要注意识记重要定义
,
掌握常用规律
,
从而提高解题能力
;
同时要重视知识迁移和化学用语的规范使用。
-
12
-
精要排查
真题示例
知能提升
对点演练
1
.
原子或离子中各微粒间的数量关系
(1)
对于原子
:
质子数
=
核电荷数
=
核外电子数
=
原子序数。
(2)
质量数
=
质子数
+
中子数。
(3)
质子数
=
阳离子的核外电子数
+
阳离子所带正电荷数。
(4)
质子数
=
阴离子的核外电子数
-
阴离子所带负电荷数。
2
.
元素、核素、同位素之间的关系
-
13
-
精要排查
真题示例
知能提升
对点演练
3
.
化学键与物质类别的关系
(1)
只含非极性共价键的物质
:
某些非金属元素组成的单质
(
稀有气体除外
),
如
I
2
、
N
2
、
P
4
、金刚石、晶体硅等。
(2)
只含有极性共价键的物质
:
一般是不同非金属元素组成的共价化合物
,
如
HCl
、
NH
3
、
SiO
2
、
CS
2
等。
(3)
既有极性键又有非极性键的物质
,
如
H
2
O
2
、
C
2
H
4
、
CH
3
CH
3
、
C
6
H
6
等。
(4)
只含有离子键的物质
:
活泼非金属元素与活泼金属元素形成的化合物
,
如
Na
2
S
、
CsCl
、
K
2
O
、
NaH
等。
(5)
既有离子键又有非极性共价键的物质。如
Na
2
O
2
、
CaC
2
等。
(6)
由极性共价键构成但又不是强电解质的物质
,
如
HF
等。
-
14
-
精要排查
真题示例
知能提升
对点演练
题组一
原子结构及微粒间关系
1
.(2018
黑龙江大庆实验中学月考
)
下列说法正确的是
(
)
A.
由
H
、
D
、
T
与
16
O
、
17
O
、
18
O
相互结合为水
,
可得水分子
18
种
,
其中相对分子质量不同的水分子种数为
8
种
B.H
2
、
D
2
、
T
2
互为同素异形体
C.H
2
、
D
2
、
T
2
在相同条件下的密度之比为
1
∶
2
∶
3
D.
氕、氘发生核聚变成为其他元素
,
属于化学变化
答案
解析
解析
关闭
H
、
D
、
T
组合为
H
2
、
D
2
、
T
2
、
HD
、
HT
、
DT
共
6
种
,
16
O
、
17
O
、
18
O
共
3
种
,
所以构成的水分子共有
6×3=18
种
,
相对分子质量介于
18~24
之间
,
共有
7
种
,A
项错误
;H
2
、
D
2
、
T
2
均为氢气单质
,
属于同一种物质
,B
项错误
;H
2
、
D
2
、
T
2
在相同条件下的密度比等于气体的相对分子质量之比
,
即
H
2
、
D
2
、
T
2
的密度之比为
2
∶
4
∶
6=1
∶
2
∶
3,C
项正确
;
氕、氘发生核聚变成为其他元素
,
此过程属于核反应
,
不是化学变化
,D
项错误。
答案
解析
关闭
C
-
15
-
精要排查
真题示例
知能提升
对点演练
题组二
核外电子排布的规律及应用
2
.(2018
辽宁鞍山第一中学模拟
)X
、
Y
、
Z
、
W
、
R
是
5
种短周期元素
,
其原子序数依次增大。
X
是元素周期表中原子半径最小的元素
,Y
原子最外层电子数是次外层电子数的
3
倍
,Z
、
W
、
R
处于同一周期
,R
与
Y
处于同一族
,Z
、
W
原子的核外电子数之和与
Y
、
R
原子的核外电子数之和相等。下列说法正确的是
(
)
A.
元素
Y
、
Z
、
W
形成的简单离子具有相同的电子层结构
,
其半径依次增大
B.
元素
Y
、
R
分别与元素
X
形成的简单化合物的稳定性
:X
m
Y
强于
X
m
R
C.
元素
Z
、
Y
形成的
1 mol
化合物中含有的分子数约为
1.806×10
24
D.
元素
Z
、
R
的最高价氧化物的水化物之间相互反应生成的盐溶液呈中性或碱性
答案
解析
解析
关闭
X
是周期表中原子半径最小的元素
,
应为氢元素
,Y
原子最外层电子数是次外层电子数的
3
倍
,
应为氧元素
;
根据
R
与
Y
处于同一族
,
则
R
为硫元素
,Z
、
W
原子的核外电子数之和与
Y
、
R
原子的核外电子数之和相等
,
则
Z
、
W
原子的核外电子数之和为
8+16=24,
又因为
Z
、
W
、
R
处于同一周期
,
应为第三周期
,Z
、
W
分别为
Na
和
Al
。
Y
、
Z
、
W
具有相同电子层结构的离子
(O
2-
、
Na
+
、
Al
3+
),
根据核外电子排布相同的离子
,
半径随着核电荷数的增加而减小
,
故
A
项错误
;
元素
Y
、
R
分别与元素
X
形成的化合物是氢化物
,
因为
Y(O)
和
R(S)
的非金属性强弱
:Y>R,
所以对应的氢化物的稳定性
:H
2
O>H
2
S,
故
B
项正确
;Y
为氧
,Z
为钠
,
元素
Z
、
Y
形成的化合物均为离子化合物
,
不存在分子
,
故
C
项错误
;
元素
Z
、
R
的最高价氧化物的水化物之间相互反应生成的盐溶液可能呈酸性
,
例如硫酸氢钠水溶液显酸性
,D
项错误。
答案
解析
关闭
B
-
16
-
精要排查
真题示例
知能提升
对点演练
题组三
物质类别与微粒间的相互作用
3
.(2018
河南豫西名校联考
)
下列说法正确的是
(
)
①
离子化合物中一定含离子键
,
也可能含共价键
②
共价化合物中可能含离子键
③
含金属元素的化合物不一定是离子化合物
④
由非金属元素组成的化合物一定是共价化合物
⑤
构成单质分子的粒子不一定存在共价键
⑥
不同元素组成的多原子分子里的化学键一定是极性键
⑦
有化学键断裂的变化属于化学变化
A.
①③⑤
B.
②④⑥
C.
①③④
D.
③⑤⑦
答案
解析
解析
关闭
①离子化合物一定含离子键
,
也可能含极性键或非极性键
,
如
NaOH
中含离子键和
O—H
极性键
,
过氧化钠中含离子键和
O—O
非极性键
,
①正确
;
②共价化合物一定含共价键
,
一定不含离子键
,
含离子键的一定为离子化合物
,
②错误
;
③含金属元素的化合物不一定是离子化合物
,
如氯化铝为共价化合物
,
③正确
;
④由非金属元素组成的化合物不一定是共价化合物
,
如铵盐为离子化合物
,
④错误
;
⑤由分子组成的物质中不一定存在共价键
,
如稀有气体中不含化学键
,
⑤正确
;
不同元素组成的多原子分子里的化学键
,
若为同种元素之间形成的是非极性共价键
,
不同元素之间形成的是极性共价键
,
⑥错误
;
⑦有旧化学键断裂和新化学键形成的变化属于化学变化
,
有化学键断裂的变化不一定属于化学变化
,
如
HCl
溶于水
,H—Cl
键断裂
,
属于物理变化
,
⑦错误
;
综上所述符合题意的是①③⑤
,A
项正确。
答案
解析
关闭
A
-
17
-
精要排查
真题示例
知能提升
对点演练
元素周期律
元素周期表
1
.
判断正误
,
正确的划
“
√
”,
错误的划
“×”
。
(1)
主族元素的最高正价一定等于族序数
(
×
)
(2)
元素的非金属性越强
,
其氧化物对应水化物的酸性就越强
(
×
)
(3)
失电子难的原子得电子的能力一定强
(
×
)
(4)
得失电子数多的原子
,
得失电子的能力一定强
(
×
)
(5)
第
ⅦA
族元素的非金属性是同周期元素中最强的
(
√
)
(6)
同周期的主族元素中
,
Ⅶ
A
族元素的原子半径最小
(
√
)
(7)
Ⅵ
A
族元素的原子
,
其半径越大
,
气态氢化物越稳定
(
×
)
(8)
元素周期表中从
Ⅲ
B
族到
Ⅱ
B
族十个纵列的元素都是金属元素
(
√
)
-
18
-
精要排查
真题示例
知能提升
对点演练
(9)
第
Ⅰ
A
族元素的金属性一定比第
Ⅱ
A
族元素的金属性强
(
×
)
-
19
-
精要排查
真题示例
知能提升
对点演练
2
.(1)
形成化合物最多的元素是
C
(
填元素符号
,
下同
),
地壳中含量最多的元素是
O
。
(2)116
号元素在周期表中的位置是
第七周期
Ⅵ
A
族
。
(3)
同周期中
(
稀有气体除外
)
左边元素的原子半径比右边元素的原子半径
大
,
同主族中下边元素的原子半径比上边元素的原子半径大。
(4)
主族元素最高正化合价数
=
最外层电子数
=
主族序数
(
O
、
F
除外
)
。
(5)
最高正价
+|
最低负价
|=
8
(F
、
O
除外
)
。
-
20
-
精要排查
真题示例
知能提升
对点演练
1
.(2018
天津
,2,6
分
)
下列有关物质性质的比较
,
结论正确的是
(
)
A.
溶解度
:Na
2
CO
3
P,
则氢化物的稳定性
:HCl>PH
3
,B
项错误
;
由于
C
2
H
5
OH
分子间形成氢键
,
因此沸点
:C
2
H
5
SHBe ,
因此碱性
:LiOH>Be(OH)
2
,D
项错误。
答案
解析
关闭
C
-
21
-
精要排查
真题示例
知能提升
对点演练
2
.(2018
课标
Ⅰ
,12,6
分
)
主族元素
W
、
X
、
Y
、
Z
的原子序数依次增加
,
且均不大于
20
。
W
、
X
、
Z
最外层电子数之和为
10;W
与
Y
同族
;W
与
Z
形成的化合物可与浓硫酸反应
,
其生成物可腐蚀玻璃。下列说法正确的是
(
)
A.
常温常压下
X
的单质为气态
B.Z
的氢化物为离子化合物
C.Y
和
Z
形成的化合物的水溶液呈碱性
D.W
与
Y
具有相同的最高化合价
答案
解析
解析
关闭
根据
“W
与
Z
形成的化合物可与浓硫酸反应
,
其生成物可腐蚀玻璃
”
可知
,
该生成物为
HF,
则结合
“W
与
Y
同族
”
及
“W
、
X
、
Z
最外层电子数之和为
10”
可推知
,W
为氟元素
,X
为钠元素
,Y
为氯元素
,Z
为钙元素。常温常压下
,
金属钠为固态
,A
项错误
;CaH
2
为离子化合物
,B
项正确
;CaCl
2
为强酸强碱盐
,
其溶液呈中性
,C
项错误
;F
无正价
,
而
Cl
的最高价为
+7
价
,D
项错误。
答案
解析
关闭
B
-
22
-
精要排查
真题示例
知能提升
对点演练
3
.(2017
课标
Ⅲ
,12,6
分
)
短周期元素
W
、
X
、
Y
和
Z
在周期表中的相对位置如表所示
,
这四种元素原子的最外层电子数之和为
21
。下列关系正确的是
(
)
A.
氢化物沸点
:WW
C.
化合物熔点
:Y
2
X
3
r
(Na
+
)
“
二看
”
核电荷数
:
当电子层数相同时
,
核电荷数越大
,
半径越小。
例如
:
r
(Na)>
r
(Mg)>
r
(Al)>
r
(Si)>
r
(P)>
r
(S)>
r
(Cl)
r
(O
2-
)>
r
(F
-
)>
r
(Na
+
)>
r
(Mg
2+
)>
r
(Al
3
+
)
-
26
-
精要排查
真题示例
知能提升
对点演练
“
三看
”
核外电子数
:
当电子层数和核电荷数均相同时
,
核外电子数越多
,
半径越大。
例如
:
r
(Cl
-
)>
r
(Cl)
r
(Fe
2+
)>
r
(Fe
3+
)
-
27
-
精要排查
真题示例
知能提升
对点演练
3
.
元素金属性、非金属性的多方面
比较
-
28
-
精要排查
真题示例
知能提升
对点演练
-
29
-
精要排查
真题示例
知能提升
对点演练
题组一
元素周期表结构
1
.(2018
山西太原第五中学阶段检测
)
下列有关元素周期表的说法正确的是
(
)
A.
原子序数之差为
2
的两种元素不可能位于同一主族
B.
若
D
-
核外有
36
个电子
,
则元素
D
位于第四周期第
ⅦA
族
C.
第三、四周期同主族元素的原子序数一定相差
8
D.
位于同一周期的甲、乙两种元素
,
甲位于第
Ⅰ
A
族
,
原子序数为
x
,
乙位于第
Ⅲ
A
族
,
乙的原子序数一定为
x
+2
答案
解析
解析
关闭
原子序数之差为
2
的两种元素可能位于同一主族
,
例如
H
和
Li,A
项错误
;
若
D
-
核外有
36
个电子
,
则元素
D
是
Br,
位于元素周期表中第四周期第
ⅦA
族
,B
项正确
;
第三、四周期同主族元素的原子序数不一定相差
8,
也可能相差
18,
例如
Cl
与
Br
原子序数相差
18,C
项错误
;
位于同一周期的甲、乙两种元素
,
甲位于第Ⅰ
A
族
,
原子序数为
x
,
乙位于第Ⅲ
A
族
,
乙的原子序数不一定为
x
+2,
例如第四周期中相应的两种元素的原子序数相差
12,D
项错误。
答案
解析
关闭
B
-
30
-
精要排查
真题示例
知能提升
对点演练
题组二
元素周期律及其应用
2
.(2018
福建永春县第一中学高三联考
)X
、
Y
均为元素周期表中
ⅦA
族中的两种元素。下列叙述中
,
能够说明
X
的原子得电子能力比
Y
强的是
(
)
A.
原子的电子层数
:X>Y
B.
对应的简单离子的还原性
:X>Y
C.
气态氢化物的稳定性
:X>Y
D.
氧化物对应水化物的酸性
:X>Y
答案
解析
解析
关闭
X
原子的电子层数比
Y
原子的电子层数多
,
因为是同主族元素
,
则
Y
的非金属性强
,
故
A
项错误
;
元素的非金属性越强
,
对应的简单离子的还原性越弱
,
则对应的简单离子的还原性
:X>Y,
则
Y
的非金属性强
,
故
B
项错误
;X
的气态氢化物比
Y
的气态氢化物稳定
,
则
X
的非金属性强
,
故
C
项正确
;
比较非金属性的强弱
,
应比较对应元素最高价氧化物的水化物的酸性
,
故
D
项错误。
答案
解析
关闭
C
-
31
-
精要排查
真题示例
知能提升
对点演练
题组三
元素
“
位、构、性
”
关系的综合推断
3
.(2018
皖江名校联盟联考
)X
、
Y
、
Z
、
W
、
R
是原子序数依次增大的五种短周期元素。
X
原子的最外层电子数为最内层电子数的
2
倍。
Y
与
X
是同周期元素
,XY
2
可用于灭
火。简单阳离子
Z
+
、
W
2+
具有相同的电子层结构。
R
是同周期中原子半径最小的主族元素。下列有关说法正确的是
(
)
A.XY
2
中各原子都达到
8
电子稳定结构
B.Z
、
W
分别与
Y
形成的常见化合物均为碱性氧化物
C.Y
、
Z
、
R
三种元素形成的化合物一定能发生水解反应
D.
离子半径的大小顺序为
:Z
+
>W
2+
>Y
2-
答案
解析
解析
关闭
根据题意
,X
、
Y
、
Z
、
W
、
R
分别是
C
、
O
、
Na
、
Mg
、
Cl
。
XY
2
为
CO
2
,
各原子都达到
8
电子稳定结构
,A
项正确
;Na
、
Mg
分别与
O
形成的常见化合物有氧化钠、过氧化钠、氧化镁
,
其中过氧化钠不是碱性氧化物
,B
项错误
;Na
、
O
、
Cl
三种元素可以形成化合物
NaClO
、
NaClO
2
、
NaClO
3
、
NaClO
4
,
其中
NaClO
3
、
NaClO
4
是强酸强碱盐
,
不能发生水解反应
,C
项错误
;
电子层结构相同的离子
,
核电荷数越大离子半径越小
,
故离子半径
:O
2-
>Na
+
>Mg
2+
,D
项错误。
答案
解析
关闭
A
-
32
-
精要排查
真题示例
知能提升
对点演练
4
.(2018
山东济宁高三期末
)
短周期元素
X
、
Y
、
Z
、
W
、
Q
在元素周期表中的相对位置如图所示。下列说法不正确的是
(
)
A.
离子半径的大小顺序为
:
r
(W
2-
)>
r
(Q
-
)>
r
(Y
2-
)>
r
(Z
3+
)
B.
元素
W
的最高价氧化物对应水化物的酸性比
Q
的强
C.
元素
X
的氢化物与
Q
的氢化物化合生成的产物中既含共价键又含离子键
D.X
、
Z
、
W
、
Q
四种元素的最高价氧化物对应水化物均能与强碱反应
答案
解析
解析
关闭
电子层数越多半径越大
,
电子层数相同时
,
质子数越多半径越小
,
则离子半径的大小顺序为
r
(W
2-
)>
r
(Q
-
)>
r
(Y
2-
)>
r
(Z
3+
),
故
A
项正确
;
同周期从左到右元素非金属性增强
,
最高价氧化物对应水化物的酸性增强
,
元素
Q
的最高价氧化物对应水化物的酸性比
W
的强
,
故
B
项错误
;
元素
X
的氢化物是氨气
,Q
的氢化物是氯化氢
,
二者化合生成的产物是氯化铵
,
氯化铵中既含共价键又含离子键
,
故
C
项正确
;X
、
Z
、
W
、
Q
四种元素的最高价氧化物对应的水化物分别是硝酸、氢氧化铝、硫酸、高氯酸
,
均能与强碱反应
,
故
D
项正确。
答案
解析
关闭
B