- 258.50 KB
- 2021-05-20 发布
专题四 氧化还原反应
学习目标:
1、理解氧化还原反应的基本概念,了解本质是电子转移。
2、理解氧化还原反应规律及应用。
3、掌握常见氧化还原反应的配平和相关计算。
学习重难点:
1、 氧化还原反应规律及应用
2、 常见氧化还原反应的配平和相关计算
自主学习
【知识梳理】
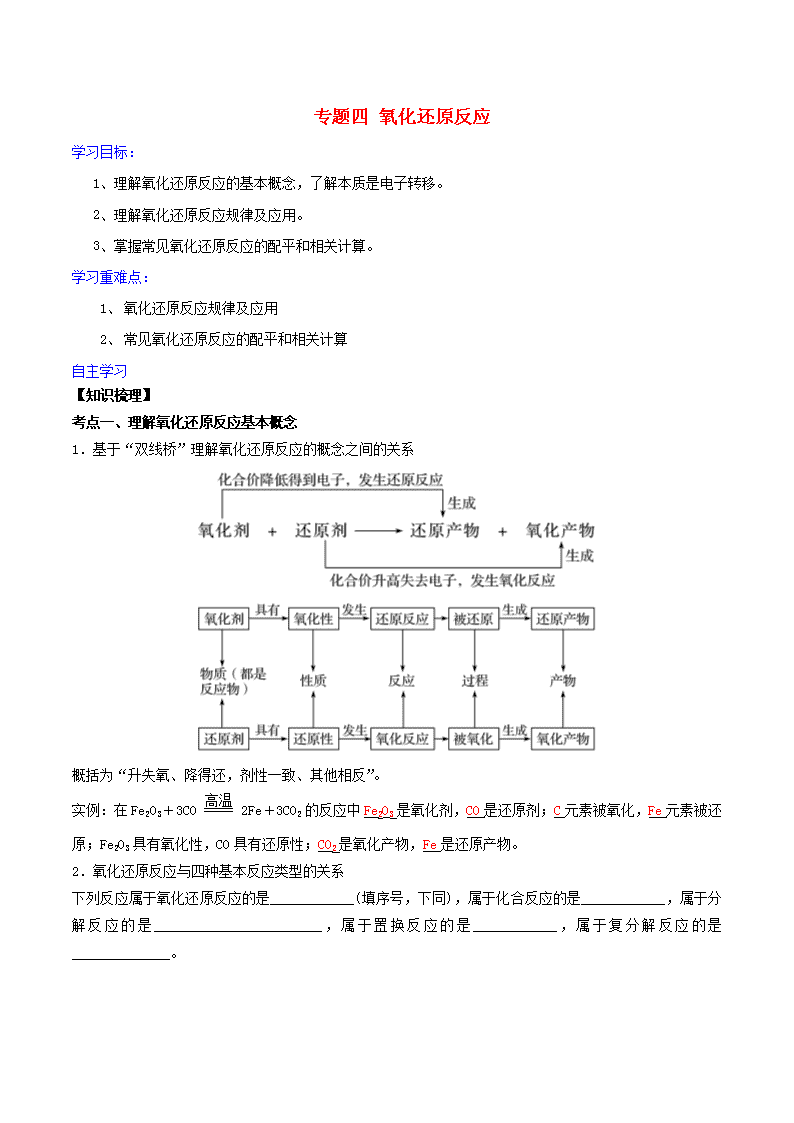
考点一、理解氧化还原反应基本概念
1.基于“双线桥”理解氧化还原反应的概念之间的关系
概括为“升失氧、降得还,剂性一致、其他相反”。
实例:在Fe2O3+3CO2Fe+3CO2的反应中Fe2O3是氧化剂,CO是还原剂;C元素被氧化,Fe元素被还原;Fe2O3具有氧化性,CO具有还原性;CO2是氧化产物,Fe是还原产物。
2.氧化还原反应与四种基本反应类型的关系
下列反应属于氧化还原反应的是____________(填序号,下同),属于化合反应的是____________,属于分解反应的是________________________,属于置换反应的是____________,属于复分解反应的是______________。
①Cu2S+O22Cu+SO2
②3O22O3
③Fe2O3+3CO2Fe+3CO2
④2Na+2H2O===2NaOH+H2↑
⑤CaCO3CaO+CO2↑
⑥2H2O22H2O+O2↑
⑦SO3+H2O===H2SO4
⑧2Fe+3Cl22FeCl3
⑨H2SO4+2NaOH===Na2SO4+2H2O
⑩NaH+H2O===NaOH+H2↑
⑪IBr+H2O===HIO+HBr
【答案】①③④⑥⑧⑩ ⑦⑧ ⑤⑥ ①④ ⑨⑪
正误辨析
正误判断,正确的打“√”,错误的打“×”
(1)有单质参加或有单质生成的化学反应一定是氧化还原反应( )
(2)某元素从游离态变为化合态,该元素一定被氧化( )
(3)非金属阴离子只具有还原性,金属阳离子只具有氧化性( )
(4)H2O作为还原剂时,产物中一般有O2生成( )
(5)无单质参加的化合反应一定不是氧化还原反应( )
(6)氧化还原反应中的反应物,不是氧化剂就是还原剂( )
【答案】(1)× (2)× (3)× (4)√ (5)× (6)×
【题组集训】
题组一 正确理解氧化还原反应
1.下列说法正确的是( )
A.氧化还原反应的本质是元素的化合价发生变化
B.还原剂是一种能够得到电子的物质
C.物质所含元素化合价升高的反应是还原反应
D.氧化反应和还原反应是同时发生的
【答案】D
【解析】氧化还原反应的本质是电子的转移;还原剂是一种能够失去电子的物质;物质所含元素化合价升高的反应是氧化反应。
题组二 电子转移方向和数目的表示方法及应用
2.下列标明电子转移的方向和数目的化学方程式中,正确的是④⑤;属于歧化反应的是②,属于归中反应的是③,属于部分氧化还原反应的是③④⑤。
3.下列反应中,水作氧化剂的是( )
A.C+H2OCO+H2
B.H2+CuOCu+H2O
C.Cl2+H2OHCl+HClO
D.SO3+H2O===H2SO4
【答案】A
【解析】B项,H2还原CuO,H2作还原剂,H2O是氧化产物;C项,Cl2和H2O反应,Cl2既是氧化剂又是还原剂;D项,SO3和H2O反应不是氧化还原反应。
4.ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO42ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
A.CO2是氧化产物
B.H2C2O4在反应中被氧化
C.CO2的氧化性强于KClO3的氧化性
D.ClO2作水处理剂时,利用了其强氧化性
【答案】C
【反思归纳】
走好关键第一步——正确标出元素化合价
正确分析氧化还原反应中电子转移的数目,其前提是确定物质中各元素(特别是变价元素)的化合价。基本方法是先标出熟悉元素的化合价,再根据化合物中正、负化合价的代数和为零的原则求解其他元素的化合价。常见元素的化合价可以借助化合价口诀来记忆:一价氢、钾、钠、氟、氯、溴、碘、银;二价氧、钙、钡、镁、锌;三铝、四硅、五价磷;说变价也不难,二三铁、二四碳、二四六硫都齐全;铜、汞二价最常见。
近几年高考中一些特殊物质中元素化合价判断
CuFeS2 Cu+2 Fe+2 S-2 K2FeO4 Fe+6
Li2NH N-3 LiNH2 N-3 AlN N-3
Na2S2O3 S+2 MO M+5 C2O C+3
HCN C+2 N-3 CuH Cu+1 H-1
FeO Fe+(8-n) Si3N4 Si+4 N-3
考点二、氧化性、还原性强弱比较
【知识梳理】
1.氧化性、还原性的判断
(1)氧化性是指得电子的性质(或能力);还原性是指失电子的性质(或能力)。
(2)氧化性、还原性的强弱取决于得、失电子的难易程度,与得、失电子数目的多少无关。如:Na-e-===Na+,Al-3e-===Al3+,但根据金属活动性顺序表,Na比Al活泼,更易失去电子,所以Na比Al的还原性强。
从元素的价态考虑:最高价态——只有氧化性,如:Fe3+、H2SO4、KMnO4等;最低价态——只有还原性,如:金属单质、Cl-、S2-等;中间价态——既有氧化性又有还原性,如:Fe2+、S、Cl2等。
2.氧化性、还原性强弱的比较方法
(1)根据化学方程式判断
氧化剂(氧化性)+还原剂(还原性)===还原产物+氧化产物
氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
(2)根据反应条件和产物价态高低进行判断
①与同一物质反应,一般越易进行,则其氧化性或还原性就越强
。如Na与冷水剧烈反应,Mg与热水反应,Al与水加热反应也不明显,所以还原性:Na>Mg>Al;非金属单质F2、Cl2、Br2、I2与H2反应,F2与H2暗处剧烈反应并爆炸,Cl2与H2光照剧烈反应并爆炸,Br2与H2加热到500 ℃才能发生反应,I2与H2在不断加热的条件下才缓慢发生反应,且为可逆反应,故氧化性:F2>Cl2>Br2>I2。
②当不同的氧化剂作用于同一还原剂时,如果氧化产物价态相同,可根据反应条件的高低进行判断:一般条件越低,氧化剂的氧化性越强,如:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,由上述反应条件的不同,可判断氧化性:KMnO4>MnO2。
当不同氧化剂作用于同一还原剂时,如果氧化产物价态不相同,可根据氧化产物的价态高低进行判断:氧化产物的价态越高,则氧化剂的氧化性越强,如:2Fe+3Cl22FeCl3,Fe+SFeS,则氧化性:Cl2>S。
正误辨析
正误判断,正确的打“√”,错误的打“×”
(1)反应2Fe3++Fe===3Fe2+,说明金属阳离子还原产物不一定是金属单质( )
(2)反应2Fe3++Cu===2Fe2++Cu2+,说明还原性Cu>Fe2+( )
(3)反应Cu+H2SO4通电,CuSO4+H2↑,说明还原性:Cu>H2( )
(4)反应2MnO+10Cl-+16H+===2Mn2++5Cl2↑+8H2O,说明盐酸不能作高锰酸钾的酸化剂( )
【答案】(1)√ (2)√ (3)× (4)√
【题组集训】
题组一 正确理解氧化性、还原性强弱
1.下列说法正确的是( )
A.含有最高价元素的化合物一定具有强氧化性
B.强氧化剂与强还原剂混合不一定能发生氧化还原反应
C.阳离子只有氧化性,阴离子只有还原性
D.元素的非金属性越强,其氧化性越强,相应单质越活泼
【答案】B
【解析】强氧化剂与强还原剂发生反应需要一定的条件,如:H2和O2发生反应需要点燃或光照。
2.在氧化还原反应中,下列各组物质均可用作氧化剂的是( )
A.F-、I-、S2- B.Fe3+、MnO、NO
C.ClO、Mg D.Cl2、Fe3+、Al
【答案】B
题组二 依据方程式判断氧化性、还原性强弱
3.已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+===Fe3++Ce3+
Sn2++2Fe3+===2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )
A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ce3+
【答案】A
【解析】在氧化还原反应中还原剂的还原性比还原产物的还原性强。由方程式可知,还原性:Fe2+ >Ce3+;Sn2+>Fe2+。
4.铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:①Tl3++2Ag===Tl++2Ag+,②Ag++Fe2+===Ag+Fe3+,③Fe+2Fe3+===3Fe2+,下列离子氧化性比较顺序正确的是( )
A.Tl3+>Fe3+>Ag+ B.Fe3+>Ag+>Tl3+
C.Tl+>Ag+>Fe2+ D.Tl3+>Ag+>Fe3+
【答案】D
【解析】在氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性。
题组三 依据氧化性、还原性强弱判断氧化还原反应能否发生
5.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A.3Cl2+6FeI2===2FeCl3+4FeI3
B.Cl2+FeI2===FeCl2+I2
C.Co2O3+6HCl(浓)===2CoCl2+Cl2↑+3H2O
D.2Fe3++2I-===2Fe2++I2
【答案】A
【解析】根据氧化还原反应中,氧化性:氧化剂>氧化产物,可判断B中氧化性:Cl2>I2;C中氧化性:Co2O3>Cl2;D中氧化性:Fe3+>I2,这些结论与题给信息一致。对于A,由于I-的还原性强于Fe2+,所以Cl2应先氧化I-,而不应先氧化Fe2+。
6.已知I-、Fe2+、SO2和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Fe2+<H2O2<I-<SO2,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O===2Fe2++SO+4H+
B.I2+SO2+2H2O===H2SO4+2HI
C.H2O2+H2SO4===SO2↑+O2↑+2H2O
D.2Fe3++H2O2===2Fe2++O2↑+2H+
【答案】B
【解析】A项,还原性:SO2>Fe2+,符合题意;B项,还原性:SO2>I-,符合题意;C项,还原性:H2O2
>SO2,与题意矛盾;D项,还原性:H2O2>Fe2+,符合题意。
题组四 外界条件影响物质的氧化性、还原性
7.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与FeCl3溶液 ⑤Cl2和NaOH溶液 ⑥Fe和HNO3溶液 ⑦Fe和H2SO4溶液 ⑧Na和O2
(1)由于浓度不同而发生不同氧化还原反应的是_________________________________。
(2)由于温度不同而发生不同氧化还原反应的是________________________________。
(3)氧化还原反应不受浓度、温度影响的是__________。
【答案】(1)①③⑥⑦ (2)⑤⑥⑦⑧ (3)②④
【解析】⑥Fe和浓HNO3常温下钝化,加热继续反应,Fe和稀HNO3反应,HNO3被还原成NO。⑦Fe和浓H2SO4常温下钝化,加热继续反应,Fe和稀H2SO4反应生成FeSO4和H2。
【方法指导】
根据影响因素判断氧化性、还原性强弱的方法
(1) 浓度:同一种物质浓度越大,氧化性(或还原性)越强。
如氧化性:浓H2SO4>稀H2SO4,浓HNO3>稀HNO3,还原性:浓HCl>稀HCl。
(2)温度:同一种物质,温度越高其氧化性越强。如:热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。
(3)酸碱性:同一种物质,所处环境酸(碱)性越强其氧化性(还原性)越强。
如:酸性条件:2MnO+6H++5SO===2Mn2++5SO+3H2O
中性条件:2MnO+H2O+3SO===2MnO2↓+3SO+2OH-
碱性条件:2MnO+2OH-+SO===2MnO+SO+H2O
其氧化性为KMnO4(酸性)>KMnO4(中性)>KMnO4(碱性)。
考点三、氧化还原反应的“四条”规律
【知识梳理】
1.反应先后规律的思维模型
同一氧化剂与含多种还原剂(物质的量浓度相同)的溶液反应时,首先被氧化的是还原性最强的物质;
同一还原剂与含多种氧化剂(物质的量浓度相同)的溶液反应时,首先被还原的是氧化性最强的物质。
2.价态归中规律思维模型
含不同价态的同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价―→中间价”,而不会出现交叉现象。简记为“两相靠,不相交”。
例如,不同价态硫之间可以发生的氧化还原反应:
注意 ⑤中不会出现H2S转化为SO2而H2SO4转化为S的情况。
3.歧化反应规律思维模型
“中间价高价+低价”。
具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应,
如:Cl2+2NaOH===NaCl+NaClO+H2O。
4.守恒规律的思维模型
氧化还原反应的实质是反应过程中发生了电子转移,而氧化剂得电子总数(或元素化合价降低总数)必然等于还原剂失电子总数(或元素化合价升高总数),即得失电子守恒。基于这种思想,可以对氧化还原反应进行配平和计算。
【题组集训】
题组一 先后规律的应用
1.已知氧化性Br2>Fe3+。向含溶液a mol的FeBr2溶液中通入b mol Cl2,充分反应。下列说法不正确的是( )
A.离子的还原性强弱:Fe2+>Br->Cl-
B.当a≥2b时,发生的离子反应:
2Fe2++Cl2===2Fe3++2Cl-
C.当a=b时,反应后的离子浓度:c(Fe3+)∶c(Br-)∶c(Cl-)=1∶2∶2
D.当3a≤2b时,发生的离子反应:
2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
【答案】C
【解析】本题考查离子反应和氧化还原反应等知识。这是一道能力要求较高的试题,是一道难得的好题,命题者严格把握了“学考”对离子反应内容的要求,巧妙设计从与反应物的量有关的离子反应入手,考查离子共存问题。所以解答这道题时,不需要从反应物FeBr2和Cl2的量分析入手书写与量有关的离子反应方程式来解题,只要依据题干给予的信息:氧化性Br2>Fe3+,就可判断出还原性Fe2+>Br->Cl-,当a=b时,发生的离子反应2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-,利用原子守恒可知,反应后的溶液中c(Fe3+)∶c(Br-)∶c(Cl-)=1∶1∶2。
2.用FeCl3溶液腐蚀印刷电路板上的铜,所得溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是( )
A.若无固体剩余,则溶液中一定有Fe3+
B.若有固体存在,则溶液中一定有Fe2+
C.若溶液中有Cu2+,则一定没有固体析出
D.若溶液中有Fe2+,则一定有Cu析出
【答案】B
【解析】本题考查铁及其化合物的性质。FeCl3溶液腐蚀印刷电路板上铜的反应为2FeCl3+Cu===2FeCl2+CuCl2,所得的溶液中存在FeCl2和CuCl2,还可能有过量的FeCl3溶液,加入铁粉充分反应后,A项,若无固体剩余,说明原溶液中含有Fe3+,反应后不一定还含有;B项,不管固体是铁粉还是铜粉,溶液中一定含有Fe2+;C项,若溶液中有Cu2+,可能有部分铜固体析出;D项,若溶液中有Fe2+,不一定有Cu析出。
题组二 歧化、归中规律的应用
3.氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),化学方程式为CaH2+2H2O===Ca(OH)2+2H2↑,其中水的作用( )
A.既不是氧化剂也不是还原剂
B.是氧化剂
C.是还原剂
D.既是氧化剂又是还原剂
【答案】B
【解析】CaH2→H2的过程中,H元素的化合价由-1→0,化合价升高,故CaH2为还原剂,而H2O→H2的过程中,H元素的化合价由+1→0,化合价降低,故H2O为氧化剂。
4.在反应4P+3KOH+3H2O===3KH2PO2+PH3中,单质P( )
A.被氧化
B.被还原
C.一部分被氧化,一部分被还原
D.既未被氧化又未被还原
【答案】C
【解析】→KH2O2,→H3,故单质P一部分被氧化,一部分被还原。
题组三 守恒规律的应用
(一)利用守恒配平
类型一 正向配平类
5.(1)____HCl(浓)+____MnO2____Cl2↑+____MnCl2+____H2O
(2)____Cu+____HNO3(稀)===____Cu(NO3)2+____NO↑+____H2O
(3)____KI+____KIO3+____H2SO4===____I2+____K2SO4+____H2O
(4)____MnO+____H++____Cl-===____Mn2++____Cl2↑+____H2O
【答案】(1)4 1 1 1 2 (2)3 8 3 2 4
(3)5 1 3 3 3 3 (4)2 16 10 2 5 8
类型二 逆向配平类
6.(1)____S+____KOH===____K2S+____K2SO3+____H2O
(2)____P4+____KOH+____H2O===____K3PO4+____PH3
【答案】(1)3 6 2 1 3 (2)2 9 3 3 5
(二)利用守恒规律计算
7.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1∶16,则x的值为( )
A.2 B.3 C.4 D.5
【答案】D
【解析】本题考查在氧化还原反应中利用得失电子守恒进行相关的计算。
Na2―→xNa2O4 NaO―→Na
得关系式·x=16×2,x=5。
【反思归纳】
1.配平步骤
(1)标好价:正确标出反应前后化合价有变化的元素的化合价。
(2)列变化:列出元素化合价升高和降低的数值。
(3)求总数:求元素化合价升高和降低的总数,确定氧化剂、还原剂、氧化产物、还原产物的化学计量数。
(4)配化学计量数:用观察法配平其他各物质的化学计量数。
(5)细检查:利用“守恒”三原则(即质量守恒、得失电子守恒、电荷守恒),逐项检查配平的方程式是否正确。
2.守恒法解题的思维流程
(1)找出氧化剂、还原剂及相应的还原产物和氧化产物。
(2)找准一个原子或离子得失电子数(注意化学式中粒子的个数)。
(3)根据题中物质的物质的量和得失电子守恒列出等式:
a×be-=a′×b′e-
a、a′指变价原子个数(物质的量)。
b、b′指元素的化合价变化数。