- 439.50 KB
- 2021-05-19 发布
课时1 物质的分类、转化与分散系
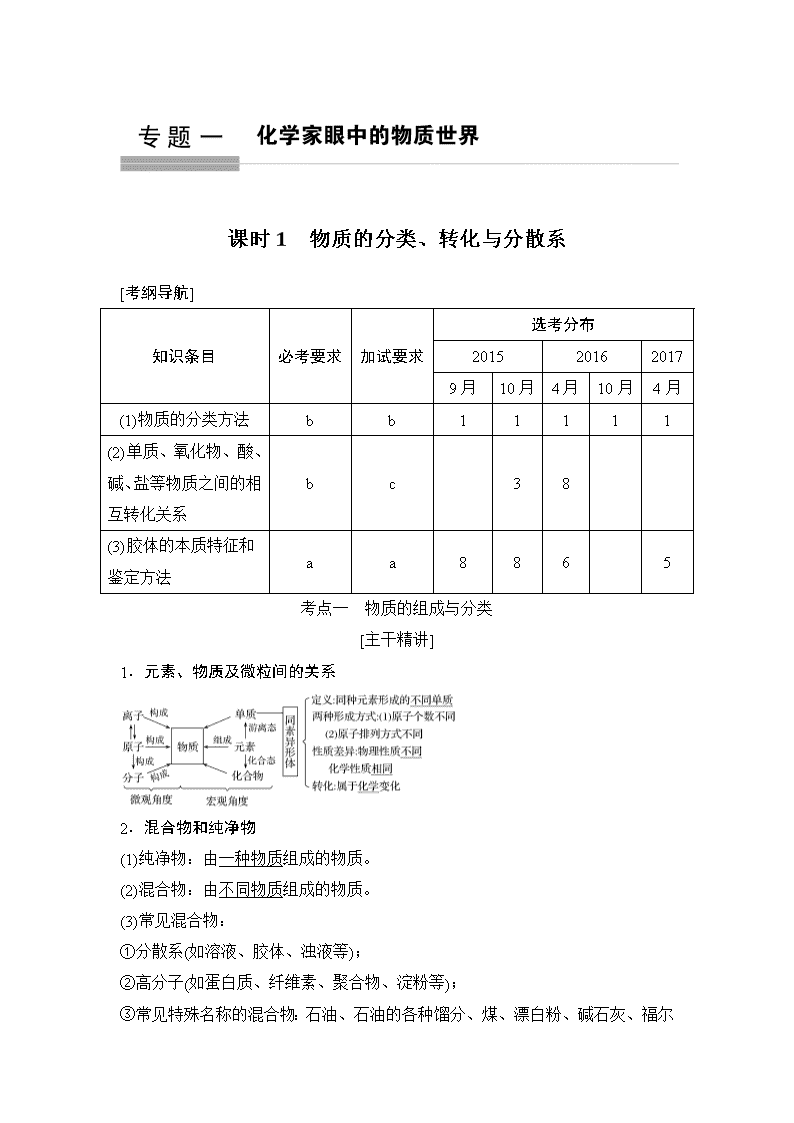
[考纲导航]
知识条目
必考要求
加试要求
选考分布
2015
2016
2017
9月
10月
4月
10月
4月
(1)物质的分类方法
b
b
1
1
1
1
1
(2)单质、氧化物、酸、碱、盐等物质之间的相互转化关系
b
c
3
8
(3)胶体的本质特征和鉴定方法
a
a
8
8
6
5
考点一 物质的组成与分类
[主干精讲]
1.元素、物质及微粒间的关系
2.混合物和纯净物
(1)纯净物:由一种物质组成的物质。
(2)混合物:由不同物质组成的物质。
(3)常见混合物:
①分散系(如溶液、胶体、浊液等);
②高分子(如蛋白质、纤维素、聚合物、淀粉等);
③常见特殊名称的混合物:石油、石油的各种馏分、煤、漂白粉、碱石灰、福尔马林、油脂、天然气、水煤气、铝热剂、氨水、氯水、王水等。
3.酸、碱、盐、氧化物的概念
(1)酸:在水溶液中电离出的阳离子全部为H+的化合物称为酸。
(2)碱:在水溶液中电离出的阴离子全部为OH-的化合物称为碱。
(3)盐:由金属阳离子或NH和酸根阴离子组成的化合物称为盐。
(4)氧化物:由两种元素组成且其中一种元素为氧的化合物称为氧化物,如CO2、CaO、NO、Na2O2等。
①碱性氧化物:能与酸反应生成盐和水的氧化物。如CaO、Na2O、Fe2O3、CuO等。
②酸性氧化物:能与碱反应生成盐和水的氧化物。如SO3、SO2、CO2、SiO2等。
③两性氧化物:既能与酸又能与碱反应生成盐和水的氧化物。
4.常见物质的分类
5.分散系
(1)概念
一种或几种物质(称为分散质)分散到另一种物质(称为分散剂)中形成的混合体系。
(2)分类
按照分散质粒子的大小
(3)三种分散系比较
分散系
溶液
胶体
浊液
分散质微粒
直径大小
<1 nm
1~100 nm
>100 nm
分散质微粒
成分
离子或小分子
大分子或离子
集合体
巨大分子或
离子集合体
外观特征
均一、透明
均一、透明或
半透明
不均一、不透明
稳定性
稳定,静置
无沉淀
较稳定
不稳定,静置
有沉淀或分层
分散质能否
透过滤纸
能
能
不能
分类
饱和溶液、
不饱和溶液
固溶胶、液溶
胶、气溶胶
悬浊液、乳浊液
实例
食盐水、蔗糖
溶液
Fe(OH)3胶体
泥水
(4)胶体的性质和制法
①丁达尔效应:光束通过胶体,形成光路的现象。
②胶体的凝聚作用:明矾溶于水能形成胶体,使水中悬浮的固体颗粒凝聚而一块沉降,用于净水。
③氢氧化铁胶体的制法:将饱和FeCl3溶液滴入沸水中,继续煮沸,得到红褐色的胶体,化学方程式为FeCl3+3H2OFe(OH)3(胶体)+3HCl。
[典例剖析]
【例1】 (2017·4月浙江选考)下列属于盐的是( )
A.NaCl B.KOH C.HNO3 D.CO2
解析 NaCl为盐,KOH为碱,HNO3为酸,CO2为酸性氧化物。
答案 A
【例2】 分类是学习和研究化学的一种常用的科学方法。下列分类合理的是( )
①根据酸分子中含有H原子个数不同,将酸分为一元酸、二元酸等 ②碱性氧化物一定是金属氧化物 ③根据丁达尔现象可将分散系分为胶体、溶液和浊液 ④SiO2是酸性氧化物,能与NaOH溶液反应 ⑤根据反应的热效应将化学反应分为放热反应和吸热反应
A.②③ B.②④⑤
C.①②④ D.②③④⑤
解析 ①中根据酸分子电离时能产生氢离子的个数将酸分为一元酸、二元酸等,所以错误。②中碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,所以正确。③中将分散系分为胶体、溶液和浊液的分类标准是分散质粒子直径的大小,所以错误。④中SiO2属于酸性氧化物,酸性氧化物能与碱反应,所以正确。⑤中放出热量的反应是放热反应,反之,是吸热反应,所以正确。
答案 B
【例3】 (原创题)将烧杯中25 mL蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色。结合Fe(OH)3胶体的制备回答下列问题:
(1)煮沸至溶液呈红褐色,能否继续加热?
_____________________________________________________________________
(2)为什么要向沸水中逐滴加入FeCl3饱和溶液?
_____________________________________________________________________
(3)在制备Fe(OH)3胶体的过程中能否用玻璃棒不断搅拌?
_____________________________________________________________________
(4)往1 mol/L FeCl3溶液中加入1 mol/L NaOH溶液,能否制得Fe(OH)3胶体?
_____________________________________________________________________
(5)用什么方法证明已经制得了Fe(OH)3胶体?
_____________________________________________________________________
解析 为了防止Fe(OH)3胶体聚沉,溶液呈红褐色后不能继续加热;也不能一次性加入大量FeCl3饱和溶液;在制备过程中不能用玻璃棒不断搅拌;制备胶体必须控制胶粒在1~100 nm之间,若用FeCl3和NaOH溶液反应,制得的是Fe(OH)3
沉淀;利用可见光照射制备的胶体,根据侧面观察是否产生光亮的通路判断是否成功制备胶体。
答案 (1)不能继续加热 (2)一次性加入大量FeCl3溶液使胶体聚沉 (3)不能 (4)不能制得胶体 (5)利用可见光照射所制得的胶体,侧面观察是否有光亮的通路
[考点精练]
1.(2017·杭州七县联考)生产生活中离不开各类化学物质,下列物质中属于盐类的是( )
A.烧碱 B.水晶 C.胆矾 D.金刚石
解析 A.烧碱是氢氧化钠属于碱,故A错误;B.水晶是二氧化硅晶体属于酸性氧化物,故B错误;C.胆矾(五水硫酸铜)是由铜离子和硫酸根、结晶水结合的化合物,属于盐,故C正确;D.金刚石仅含一种元素是碳的单质,故D错误。
答案 C
2.(2017·宁波宁海高一期中)下列说法中正确的是( )
A.酸根离子中不可能含有金属元素
B.酸性氧化物在一定条件下,都可以与碱反应生成盐和水
C.一种元素可能有多种氧化物,但是同种化合价只对应一种氧化物
D.还原产物只有还原性,氧化产物只有氧化性
解析 MnO和AlO中都含有金属元素,A错误;酸性氧化物在一定条件下,都可以与碱反应生成盐和水,B正确;一种元素可能有多种氧化物,同种化合价也可以有几种氧化物,如NO2、N2O4,C错误;氧化性还原性和物质中元素化合价变化有关,还原产物可以有还原性或氧化性,氧化产物可以有氧化性或还原性,D错误。
答案 B
3.(2017·杭州长河高中高三月考)分类是化学学习和研究中的常用手段。下列分类依据和结论都正确的是( )
A.NaF、MgO、CaCl2均由活泼金属和活泼非金属作用形成,都是离子化合物
B.HCl、H2SO4、HNO3均具有氧化性,都是氧化性酸
C.Na2O、HCl、BaSO4、浓硝酸都是纯净物
D.H2O、HCOOH、Cu(NH3)4SO4中均含有氧,都是氧化物
解析 A.依据物质结构分析,NaF、MgO、CaCl2均由活泼金属和活泼非金属作用形成,都是离子化合物,故A正确;B.酸有氧化性是氢离子的氧化性,但不是氧化性酸,氧化性酸是酸根离子中心原子得到电子表现出的氧化性,HCl、H2SO4、HNO3均具有氧化性,HCl是非氧化性酸,浓H2SO4、HNO3都是氧化性酸,故B错误;C.同一种物质组成的为纯净物,Na2O、HCl、BaSO4都是纯净物,浓硝酸是硝酸的溶液属于混合物,故C错误;D.H2O是氧化物,HCOOH、Cu(NH3)4SO4中均含有氧,但不符合氧化物概念,不是氧化物,故D错误。
答案 A
4.(2016·浙江省艾青中学高一上期中) “纳米材料”是粒子直径为1~100 nm的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸 ⑥静置后,会析出黑色沉淀
A.①④⑥ B.②③④ C.②③⑤ D.①③④⑥
解析 由于是均匀地分散在蒸馏水中,且分散质粒子直径在1~100 nm范围内,故该分散系属于胶体,具有胶体的特征。
答案 B
【归纳总结】
(1)化学物质有“名不符实”的现象:冰水混合物实际上是纯净物;纯净的盐酸是混合物;高分子化合物是混合物等。
(2)只含一种元素或者组成元素质量比恒定的物质不一定是纯净物,如O2与O3组成的混合物中只有一种元素;C2H4与C3H6组成的混合物中碳氢元素的质量比总是恒定的。
(3)若氧化物与酸(碱)反应生成盐和水以外的物质,则该氧化物不是碱(酸)性氧化物,如Na2O2;碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,如Mn2O7为酸性氧化物,Al2O3为两性氧化物,Na2O2为过氧化物。
(4)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱(如SiO2、Fe2O3)。两性氧化物与酸、碱反应且均生成盐和水,SiO2能与HF反应但没有生成盐,SiO2是酸性氧化物,不是两性氧化物。
(5)酸性氧化物都是对应酸的酸酐,但酸酐不一定都是酸性氧化物,如乙酸酐[(CH3CO)2O]。
(6)酸(或碱)的水溶液一定呈酸(或碱)性,但呈酸(或碱)性的溶液不一定是酸或碱。
(7)金属元素的化合价只有正价,但不一定只存在阳离子,也可以形成阴离子,如MnO、AlO,非金属元素也可以形成阳离子,如NH。考点二 物质的性质与转化
[主干精讲]
1.物质的性质和变化
根据是否有新物质生成判断物理变化和化学变化,根据是否是在化学变化中表现出来的性质判断物理性质和化学性质。二者之间的关系和常见表现如下:
2.常见物质之间的转化关系
(1)金属及其化合物间的转化
(2)非金属及其化合物间的转化
―→―→
(3)元素的不同价态的代表物间的转化关系。如:
写出上述反应的化学方程式:
①2H2S+O2===2S↓+2H2O
②SO2+2H2S===3S↓+2H2O
③2SO2+O2 2SO3
④Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
[典例剖析]
【例1】 (2016·浙江省宁波市九所重点校高一期末)下列物质不能通过化合反应制得的是( )
A.FeCl2 B.Mg3N2
C.Fe(OH)3 D.BaSO4
解析 A项,Fe与氯化铁反应生成氯化亚铁,为化合反应,故A不选;B项,Mg与氮气反应生成氮化镁,为化合反应,故B不选;C项,氢氧化亚铁、氧气、水反应生成氢氧化铁,为化合反应,故C不选;D项,硫酸钡可利用复分解反应得到,不能利用化合反应生成硫酸钡,故D选。
答案 D
【例2】 (2017·金华外国语学校,10月)实现下列转化的反应方程式中,正确的是( )
A.H2SO3→H2SO4:2H2SO3+O2===2H2SO4
B.Fe→Fe3+:2Fe+6H+===2Fe3++3H2↑
C.Br-→Br2:2Br-+I2===Br2+2I-
D.Cu→CuSO4:Cu+2H2SO4(稀)===CuSO4+SO2↑+2H2O
解析 A.H2SO3→H2SO4,亚硫酸被氧气氧化生成硫酸,反应的化学方程式2H2SO3+O2===2H2SO4,故A正确;B.Fe→Fe3+,铁和稀酸反应生成亚铁离子和氢气,实现转化反应的化学方程式2Fe+3Cl22FeCl3,故B错误;C.Br-→Br2,溴单质氧化性大于碘单质,碘单质不能氧化溴离子,实现转化的离子方程式为2Br-+Cl2===Br2+2Cl-,故C错误;D.Cu→CuSO4,铜和稀硫酸不能发生反应,实现转化反应的化学方程式Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,故D错误。
答案 A
[考点精练]
1.(2017·温州平阳二中模拟)下列颜色变化不属于因为化学反应而产生的是( )
A.无色试剂瓶中的浓硝酸呈黄色
B.久置的KI溶液呈黄色
C.铁离子用KSCN溶液检验时呈血红色
D.在普通玻璃导管口点燃纯净氢气时,火焰呈黄色
解析 A.无色试剂瓶中的浓硝酸呈黄色,是因为浓硝酸见光或加热易分解,生成的二氧化氮气体溶解在硝酸中使溶液变黄色,故A错误; B.久置的KI溶液呈黄色,是因为溶液中的碘离子被氧化为单质碘溶解在溶液中造成的,故B错误;C.铁离子与KSCN反应有新物质生成,故C错误;D.普通玻璃导管口点燃纯净氢气时,火焰呈黄色,是因为玻璃中有钠元素,点燃时发出钠元素的焰色反应黄色,是物理变化,故D正确。
答案 D
2.(2017·高复学校高三月考)化学反应经常伴随着颜色变化,下列关于颜色的叙述正确的是( )
①鸡蛋白溶液遇浓硝酸—黄色 ②淀粉溶液遇碘离子—蓝色 ③溴化银见光分解—白色 ④热的氧化铜遇乙醇—红色 ⑤新制氯水久置后—无色 ⑥过氧化钠在空气中久置—淡黄色 ⑦Fe3+离子遇苯酚—紫色 ⑧石蕊试液中通二氧化硫气体—无色
A.①②③⑧ B.①④⑤⑦
C.②③④⑥ D.④⑤⑦⑧
解析 ①蛋白质遇浓硝酸显黄色,故正确;②淀粉溶液遇单质碘显蓝色,故错误;③溴化银见光分解生成的金属银不是白色,而是黑色,故错误;④热的氧化铜遇乙醇发生反应,生成红色的金属铜,故正确;⑤新制氯水久置后成为盐酸溶液,呈无色,故正确;⑥过氧化钠是淡黄色的固体,在空气中久置成为碳酸钠,变为白色,故错误;⑦Fe3+离子遇苯酚发生显色反应,溶液显紫色,故正确;⑧石蕊试液中通二氧化硫气体,溶液变红,故错误。
答案 B
3.(2017·瑞安高三四校联考)下列物质的转化在给定条件下能实现的是( )
①NaAlO2(aq)AlCl3Al
②NH3NOHNO3
③NaCl(饱和)NaHCO3Na2CO3
④FeS2SO3H2SO4
A.②③ B.①④ C.②④ D.③④
解析 不能通过电解氯化铝制得铝,①错误;②③均能按照转化关系反应;④煅烧FeS2只能得到SO2,④错误,选项A符合题意。
答案 A
4.(2016·绍兴一中高一期中)中学常见物质A、B、C、D存在下图转化关系(部分生成物和反应条件略去)。下列物质中符合转化关系的A的个数为( )
①金属钠 ②硫单质 ③NH3 ④Na2CO3 ⑤AlCl3溶液 ⑥单质铁
A.3 B.4 C.5 D.6
解析 当A为金属钠时,D可以为O2,此时B、C分别为Na2O、Na2O2,符合转化关系;当A为硫单质时,D可以为O2,此时B、C分别为SO2、SO3,符合转化关系;当A为NH3时,D可以为O2,此时B、C分别为NO、NO2,符合转化关系;当A为Na2CO3时,D可以为HCl,此时B、C分别为NaHCO3、CO2(NaCl),符合转化关系;当A为AlCl3溶液时,D可以为NaOH,此时B、C分别为Al(OH)3、NaAlO2,符合转化关系;当A为单质铁时,D可以为HNO3,此时B、C分别为Fe(NO3)2、Fe(NO3)3,符合转化关系。本题选D。
答案 D
【归纳总结】
常考物质间的转化关系
1.中学常见物质A、B、C、D存在下图转化关系(部分生成物和反应条件略去)。
ABC。
则A可以分别是Cl2、S、Na、NH3、AlCl3、Na2CO3。
2.甲、乙、丙、丁是中学化学常见的物质,且甲、乙、丙均含有同一种元素。甲、乙、丙、丁之间的转化关系如右图所示,则乙可能是Al(OH)3或CO或Na2CO3。
3.NaCl(饱和)NaHCO3Na2CO3
4.已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),若A是铁,则E可能为稀硝酸;若A是CuO,E是碳,则B为CO;若A是NaOH溶液,E是CO2,则B为NaHCO3。
5.MgCl2溶液Mg(OH)2Mg(NO3)2溶液Mg(NO3)·6H2O
6.AlAl2O3Al2(SO4)3溶液Al2(SO4)3
7.FeFeSO4(aq)Fe(OH)2Fe2O3
8.CuCuOCuSO4溶液CuSO4·5H2O
9.能实现单质氧化物酸或碱盐直接转化的元素是硫,不是硅、氮、铁。
10.NH3NOHNO3
11.海水母液粗溴
Br2
12.CH3CHOCH3COOHCH3COOCH3
课后限时训练
(时间:45分钟)
一、选择题
1.(2017·余姚中学高三期中)下列属于碱性氧化物的是( )
A.SiO2 B.Na2O C.Na2O2 D.NaOH
解析 A.SiO2能够与氢氧化钠反应,属于酸性氧化物,错误;B.Na2O能够与酸反应生成盐和水,与水反应生成氢氧化钠,是碱性氧化物,正确;C.Na2O2能够与水反应生成氢氧化钠和氧气,属于过氧化物,错误;D.NaOH属于碱,错误;故选B。
答案 B
2.(2017·杭州七县联考)下列关于Fe(OH)3胶体的说法中,不正确的是( )
A.分散质粒子直径在10-9~10-7 m之间
B.是一种纯净物
C.具有丁达尔效应
D.具有净水作用
解析 A.胶体中分散质的微粒直径在10-9~10-7 m之间,即1 nm~100 nm,故A正确;B.胶体是分散系,是混合物,故B错误;C.胶体具有丁达尔效应,故C正确;D.胶体表面积较大,能吸附水中悬浮的杂质,故D正确。
答案 B
3.(2017·杭州七县联考)下列分类标准和分类结果不对应的是( )
选项
分类标准
分类结果
A
根据化学反应中有无单质参加或生成
氧化还原反应和非氧化还原反应
B
根据化学反应中有无离子参加或生成
离子反应和非离子反应
C
根据混合物中分散质粒子直径的大小
胶体、溶液和浊液
D
根据无机化合物的组成和性质特点
酸、碱、盐、氧化物等
解析 A.化学反应依据反应前后有无元素化合价的变化分为氧化还原
反应和非氧化还原反应,故A错误;B.化学反应根据有无离子参加或生成分为离子反应和非离子反应,故B正确;C.依据分散质微粒直径大小将分散系分为溶液、胶体、浊液,故C正确;D.根据物质的组成和性质,可以将无机化合物分为酸、碱、盐、氧化物等,故D正确。
答案 A
4.[2017·嘉兴一中高二(下)期末]能产生“丁达尔效应”的是( )
A.泥水 B.淀粉溶液
C.氯化铁溶液 D.稀硫酸
解析 A.泥水是悬浊液,分散质微粒直径大于100 nm,没有丁达尔效应,故A错误;B.淀粉溶液是胶体,分散质微粒直径在1~100 nm之间,对光能产生散射,产生丁达尔效应,故B正确;C.氯化铁溶液是溶液,分散质微粒直径小于100 nm,没有丁达尔效应,故C错误;D.稀硫酸是溶液,分散质微粒直径小于100 nm,没有丁达尔效应,故D错误。
答案 B
5.[2017·金华市义乌中学高三(上)月考]下列说法正确的是( )
①电解质溶液导电属于化学变化 ②碱性氧化物都是金属氧化物 ③FeCl2、Fe(OH)3、Fe3O4都能通过化合反应来制取 ④Na2O2不是碱性氧化物
A.②③④ B.①④
C.①②③④ D.②③
解析 ①电解质溶液导电是阴阳离子在两个电极发生氧化还原反应,电解质溶液导电属于化学变化,故①正确;②碱性氧化物是和酸反应生成盐和水的氧化物,碱性氧化物都是金属氧化物,故②正确;③氯化亚铁可以由铁和氯化铁化合反应生成,氢氧化铁可以用氢氧化亚铁、氧气和水化合反应生成,四氧化三铁可以由铁在氧气中燃烧化合生成,故③正确;④碱性氧化物是和酸反应生成盐和水的氧化物,过氧化钠与酸反应生成盐、水和氧气,所以属于过氧化物,故④正确。
答案 C
6.(2017·武义一中高三模拟)能实现下列物质间直接转化的元素是( )
单质氧化物酸或碱盐
A.硅 B.硫 C.铜 D.铁
解析 SiO2、CuO、Fe2O3等与水不反应,所以A、C、D不正确。
答案 B
7.下列关于氧化物分类的说法正确的组合为( )
①非金属氧化物一定是酸性氧化物 ②酸性氧化物不一定是非金属氧化物 ③SiO2是两性氧化物 ④碱性氧化物一定是金属氧化物 ⑤Na2O和Na2O2均能与H2O反应生成NaOH,故两者都是碱性氧化物 ⑥能与酸反应生成盐和水的氧化物一定是碱性氧化物 ⑦能与碱反应生成盐和水的氧化物一定是酸性氧化物
A.①③⑤⑥⑦ B.②④
C.②④⑤ D.②④⑥⑦
解析 NO、CO是不成盐氧化物,①错误;SiO2是酸性氧化物,③错误;Na2O2与H2O反应除生成NaOH外,还生成O2,不是碱性氧化物,⑤错误;Al2O3是两性氧化物,⑥⑦错误。
答案 B
8.(2016·温州市10月)若两物质恰好完全发生化学反应,下列各项中,反应前后肯定不发生变化的是( )
①电子总数 ②原子总数 ③分子总数 ④物质的种类
⑤物质的总质量
A.只有④⑤ B.只有②⑤
C.只有①②③⑤ D.只有①②⑤
解析 根据质量守恒定律的内容:在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和。再根据其意义:元素的种类、原子的数目、电子数目、原子的种类在反应前后不变。
答案 D
9.下列说法中正确的是( )
A.由不同原子组成的纯净物一定是化合物
B.非金属氧化物一定是酸性氧化物
C.含金属元素的离子一定都是阳离子
D.胆矾是纯净物,水泥是混合物
解析
A项,如HD(D为氢的同位素)是由不同原子组成的纯净物,但它属于单质,A项错误;B项,如CO为非金属氧化物,但它不是酸性氧化物;C项,如MnO含金属元素Mn,但它是阴离子。
答案 D
10.下列属于碱性氧化物的是( )
A.Na2O2 B.Fe3O4 C.CaO D.MnO(OH)
解析 Na2O2为过氧化物;Fe3O4是特殊氧化物;MnO(OH)不是氧化物。故C正确。
答案 C
11.(2017·浙江1月学考)下列过程中,属于化学变化的是( )
A.用加热法分离泥沙中的碘单质
B.用蒸馏法制取蒸馏水
C.干冰升华
D.铁锅生锈
解析 铁锅生锈过程中部分铁变成了铁锈,有新物质生成,属于化学变化。
答案 D
12.(2016·浙江省镇海中学高一月考)现有氮及其化合物的转化关系如下图,则下列说法不正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.氮气可在足量的氧气中通过一步反应生成NO2
D.上述所有反应都是氧化还原反应
解析 A项,根据工业上制备硝酸的路径:合成氨→NH3的催化氧化→NO转化为NO2→NO2和H2O反应获得硝酸,所以路线①②③是工业生产硝酸的主要途径,A正确;B项,N2和O2在雷电作用下生成NO,NO会迅速被O2氧化为NO2,NO2和H2O反应获得硝酸,即路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径,B正确;C项,N2和O2的反应只能一步到NO,NO被空气中的O2
氧化即可转化为NO2,两步转化反应的条件不一样,C错误;D项,上述过程的合成氨、NH3的催化氧化、N2转化为NO、NO转化为NO2、NO2和H2O反应中都有元素化合价发生变化,都属于氧化还原反应,D正确。
答案 C
13.(2016·嘉兴一中高一上期中)实验室里有4个药品橱,已经存放以下物品:
药品橱
甲橱
乙橱
丙橱
丁橱
药品
盐酸,硫酸
氢氧化钠,氢氧化钙
红磷,硫
铜,锌
实验室新购进一些碘,应该将这些碘放在( )
A.甲橱 B.乙橱 C.丙橱 D.丁橱
解析 根据题意可知甲橱中的药品为酸类,乙橱中的药品为碱类,丙橱中的药品为非金属单质类,丁橱中的药品为金属单质类,单质碘属于非金属单质类,故放在丙橱中。
答案 C
14.(2016·浙江省余杭区高二上期末)利用辉铜矿冶炼铜时发生的主要反应为Cu2S+O22Cu+SO2,该反应属于( )
A.分解反应 B.复分解反应
C.置换反应 D.化合反应
解析 根据四种基本反应类型的定义,该反应有单质参加,有单质生成,属于置换反应,答案选C。
答案 C
15.下列事实与胶体性质无关的是( )
A.由肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B.水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染
C.明矾可用作净水剂
D.臭氧、Cl2均可用于水的消毒净化
答案 D
二、非选择题
16.(2015·衢州模拟)下列10种物质:①水 ②空气 ③铁 ④二氧化碳 ⑤硫酸 ⑥熟石灰[Ca(OH)2] ⑦胆矾(CuSO4·5H2O) ⑧NaOH溶液 ⑨
碱式碳酸铜[Cu2(OH)2CO3] ⑩硫酸氢钠(NaHSO4)
(1)属于混合物的是________。
(2)属于氧化物的是________。
(3)属于碱的是________。
(4)属于酸的是________。
(5)属于盐的是________。(以上空格填物质的序号)
答案 (1)②⑧ (2)①④ (3)⑥ (4)⑤ (5)⑦⑨⑩
17.(2017·浙江省横店高中高三期末)汽车尾气是造成大气污染的主要原因之一,在汽车排气管上安装“催化转换器”使汽车的尾气转换成无毒气体是目前最有效的手段之一。如果用表示碳原子,用○表示氧原子,用表示氮原子,如图为气体转换的微观过程。请你根据图示回答下列问题:
(1)A、B、C三种物质可以归为一类的依据是______________________________
____________________________________________________________________。
(2)将C归为化合物,将D归为单质的理由是_______________________________
____________________________________________________________________。
(3)用化学反应方程式表示为________________________________________。
化学变化过程中消耗的A物质和生成的C物质的质量比为________。
(4)从微观的角度去描述你获得的关于化学变化的有关信息(答出一条即可)__________________________________________________________________ ____________________________________________________________________。
解析 (1)根据图示可知A、B、C、D分别是NO、CO、CO2和N2,NO、CO、CO2都属于氧化物,都含有氧元素。(2)二氧化碳是由不同种元素组成的分子,属于化合物,而氮气是由同种元素组成的分子,属于单质。(3)根据图示直接写出化学方程式即可。(4)根据质量守恒定律,在化学变化过程中原子的种类、数目、质量没有发生改变,元素的种类和质量也没有发生改变,只有物质的种类和分子的种类发生了改变。
答案 (1)都由两种元素组成且都含有氧元素
(2)二氧化碳是由不同种元素组成的分子,而氮气是由同种元素组成的分子
(3)2CO+2NON2+2CO2 15∶22
(4)化学变化中原子的种类、数目、质量没有发生改变(其他合理答案也可)
18.在Fe(OH)3胶体中,逐滴加入HI稀溶液,会出现一系列变化。
(1)先出现红褐色沉淀,原因是___________________________________________
_________________________________________________________________________________________________________________________________________。
(2)随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式___________________
_____________________________________________________________________。
(3)最后溶液颜色加深,原因是___________________________________________
____________________________________________________________________,
此反应的离子方程式是_________________________________________________
____________________________________________________________________。
(4)若用稀盐酸代替HI稀溶液,能出现上述哪些相同的变化现象?
____________________________________________________________________。
解析 (1)加入电解质后,Fe(OH)3胶体发生聚沉。(2)随后沉淀溶解,溶液呈黄色,这是氢氧化铁被HI溶解所致,此反应的离子方程式为:Fe(OH)3+3H+===Fe3++3H2O。(3)Fe3+和I-发生氧化还原反应,生成的I2所致,离子反应为:2Fe3++2I-===I2+2Fe2+。(4)HI既有酸性又有强还原性,I-能使Fe(OH)3胶粒聚沉,H+使其溶解,生成的Fe3+又能氧化I-成I2,而HCl只能使其聚沉然后溶解。
答案 (1)加入电解质后,使胶体聚沉
(2)Fe(OH)3+3H+===Fe3++3H2O
(3)有I2生成 2Fe3++2I-===2Fe2++I2
(4)先出现红褐色沉淀,随后沉淀溶解,溶液呈黄色
19.(2016·杭州市余杭区高三期末)Ⅰ.实验室里常用的干燥剂有:①浓硫酸(98%),②无水氯化钙,③变色硅胶[硅胶的主要成分是二氧化硅,在其中掺入少量的无水氯化钴(CoCl2)作指示剂。无水氯化钴呈蓝色,吸水后变为CoCl2·6H2O呈粉红色],④五氧化二磷,⑤碱石灰(主要成分是氢氧化钠、氧化钙,
制法:把生石灰加到浓的烧碱溶液中,再加强热蒸干),等等。
(1)写出制取干燥剂碱石灰过程中有关反应的化学方程式:___________________
____________________________________________________________________。
(2)上述物质中,属于纯净物的是________。
A.①②④ B.②④ C.①②④⑤ D.全部
(3)上述干燥剂中,不宜用于干燥氯化氢气体的是________,可用来干燥氨气的是__________________________________________________________________。
Ⅱ.固体物质A的化学式为NH5,它的所有原子核外电子的最外层都符合相应的稀有气体原子核外电子的最外层结构。该物质稍微加热就分解成两种气体。
(1)A物质中的氢元素的化合价为________。
(2)A的电子式为_______________________________________________________
____________________________________________________________________。
(3)A分解的化学方程式为_______________________________________________
____________________________________________________________________,该反应________(填“是”或“不是”)氧化还原反应。
(4)A溶于水后溶液呈________(填“酸性”、“碱性”或“中性”),化学方程式为___________________________________________________________________
____________________________________________________________________。
解析 Ⅰ.(1)制取碱石灰过程中发生的反应为CaO+H2O===Ca(OH)2。(2)在所列的常用干燥剂中无水氯化钙和五氧化二磷为纯净物。(3)碱石灰为碱性干燥剂,不能用于干燥HCl气体;浓H2SO4、P2O5为酸性干燥剂,不能用来干燥氨气,无水氯化钙能跟NH3形成络合物,也不能用于干燥氨气。
Ⅱ. (1)固体物质A(NH5)为离子化合物,化学式可写成NH4H,其中氢元素呈两种价态:+1价和-1价。(2)NH5的电子式为。
(3)NH5分解为两种气体的化学方程式为NH4HH2↑+NH3↑
,在反应中氢元素化合价有变化,该反应是氧化还原反应。(4)NH5溶于水生成NH3·H2O,溶液呈碱性:NH4H+H2O===NH3·H2O+H2↑。
答案 Ⅰ.(1)CaO+H2O===Ca(OH)2 (2)B
(3)⑤ ⑤
Ⅱ.(1)+1、-1 (2)
(3)NH4HH2↑+NH3↑ 是 (4)碱性 NH4H+H2O===NH3·H2O+H2↑
相关文档
- 2021届高考化学一轮复习化学平衡图2021-05-19 19:12:5411页
- 2020届高考化学一轮复习化学常用计2021-05-19 14:15:469页
- 2020届高考化学一轮复习化学能与热2021-05-13 01:09:447页
- 山西专用高考化学一轮复习化学反应2021-05-12 22:14:3911页
- 2021届高考化学一轮复习化学平衡及2021-05-12 21:58:3215页
- 2020届高考化学一轮复习化学平衡常2021-05-12 21:52:1611页
- 2021届高考化学一轮复习化学实验仪2021-05-12 19:45:389页
- 2021届高考化学一轮复习化学反应速2021-05-12 13:06:549页
- 化学反应及其能量高考化学一轮复习2021-05-12 12:14:174页
- 2021届高考化学一轮复习化学实验的2021-05-12 01:46:3512页