- 213.50 KB
- 2021-05-13 发布
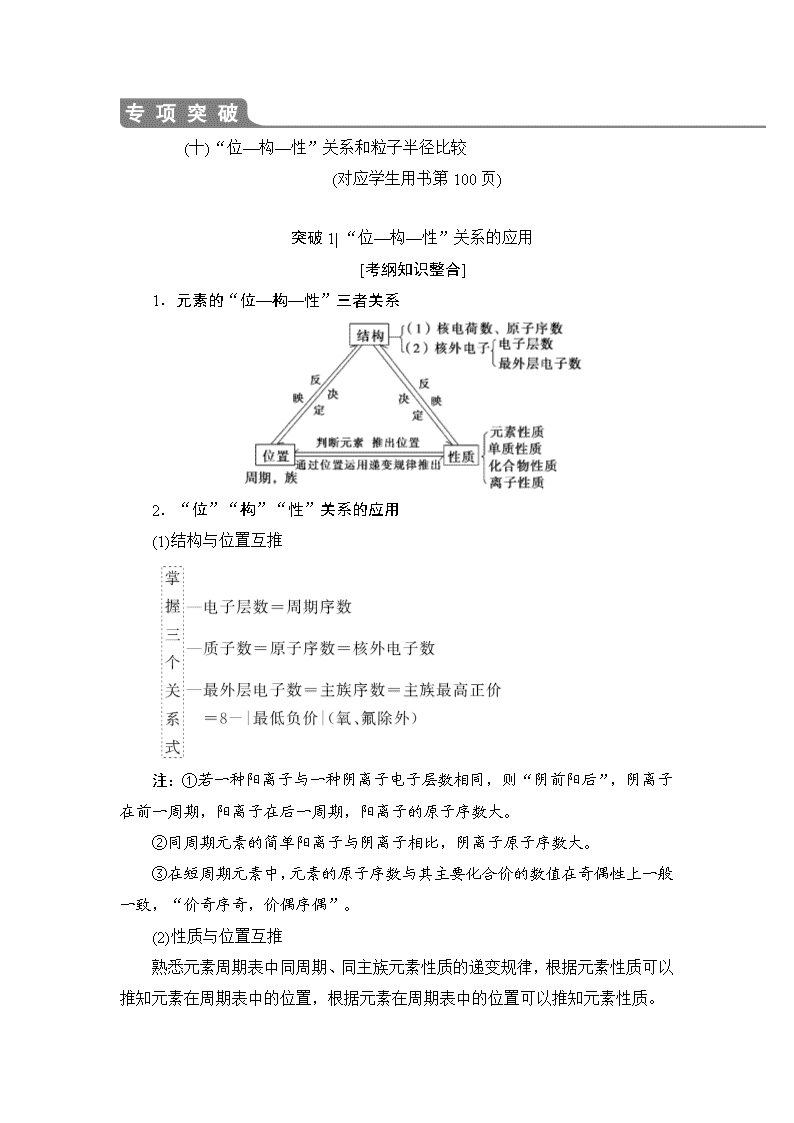
(十)“位—构—性”关系和粒子半径比较
(对应学生用书第100页)
突破1| “位—构—性”关系的应用
[考纲知识整合]
1.元素的“位—构—性”三者关系
2.“位”“构”“性”关系的应用
(1)结构与位置互推
注:①若一种阳离子与一种阴离子电子层数相同,则“阴前阳后”,阴离子在前一周期,阳离子在后一周期,阳离子的原子序数大。
②同周期元素的简单阳离子与阴离子相比,阴离子原子序数大。
③在短周期元素中,元素的原子序数与其主要化合价的数值在奇偶性上一般一致,“价奇序奇,价偶序偶”。
(2)性质与位置互推
熟悉元素周期表中同周期、同主族元素性质的递变规律,根据元素性质可以推知元素在周期表中的位置,根据元素在周期表中的位置可以推知元素性质。
(3)结构与性质互推
①最外层电子数是决定元素原子的氧化性和还原性的主要原因。
②原子半径决定了元素单质的性质;离子半径决定了元素组成化合物的性质。
③同主族元素最外层电子数相同,性质相似。
[高考命题点突破]
命题点1 利用周期表的片断结构推断性质
1.(2018·东北育才中学三模)短周期主族元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素。下列判断正确的是( )
【导学号:95160106】
A.甲一定是金属元素
B.气态氢化物的稳定性:庚>己>戊
C.乙、丙、丁的最高价氧化物的水化物可以相互反应
D.庚的最高价氧化物对应的水化物的酸性最强
B [由戊、己的位置及二者分别是空气、地壳中含量最多的元素,可判断出戊是N,己是O,则庚是F,丁是C,丙是Al,乙是Mg。甲可能是H或Li,A项错误;同周期,从左到右元素的非金属性逐渐增强,气态氢化物的稳定性也增强,B项正确;Mg(OH)2、Al(OH)3与H2CO3相互之间不能发生反应,C项错误;F没有最高价含氧酸,D项错误。]
2.(2018·专家原创)有四种短周期主族元素R、E、X、Y,其在周期表中的相对位置如图所示。R、X、Y的原子序数之和为37。
下列有关推断正确的是( )
【导学号:95160107】
A.简单离子半径:r(E)>r(Y)>r(R)
B.最高价氧化物对应的水化物酸性:R>X>E
C.气态氢化物的热稳定性:X>R>Y
D.E和Y组成的化合物含两种化学键
B [依题意,设R的原子序数为a,则X、Y的原子序数分别为a+7、a+9。则3a+16=37,解得a=7。所以,R为N,E为Al,X为Si,Y为S。A项,简单离子半径:r(S2-)>r(N3-)>r(Al3+),错误;B项,酸性:HNO3>H2SiO3>Al(OH)3,正确;C项,热稳定性:NH3>SiH4,H2S>SiH4,错误;D项,硫的非金属性比氯弱,氯化铝是共价化合物,则硫化铝一定是共价化合物,硫化铝只含共价键,错误。]
命题点2 “位—构—性”的相互综合推断
3.(2017·全国Ⅰ卷)短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是( )
【导学号:95160108】
A.X的简单氢化物的热稳定性比W的强
B.Y的简单离子与X的具有相同的电子层结构
C.Y与Z形成化合物的水溶液可使蓝色石蕊试纸变红
D.Z与X属于同一主族,与Y属于同一周期
C [四种主族元素都在短周期,W的简单氢化物可用作制冷剂,则W为N元素。Y的原子半径是所有短周期主族元素中最大的,则Y为Na元素。一种盐与稀盐酸反应既有黄色沉淀生成也有刺激性气体产生,则该盐为硫代硫酸钠,X为O元素,Z为S元素。A项,非金属性O强于N,所以水的热稳定性强于氨气,正确。B项,Y的简单离子为Na+,X的简单离子为O2-,Na+与O2-具有相同的电子层结构,正确。C项,硫化钠溶液水解显碱性,不能使蓝色石蕊试纸变红,错误。D项,O元素与S元素属于同一主族(第ⅥA族),S元素与Na元素都在第三周期,正确。]
4.(2018·山西重点中学联考)A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊均是由其中的两种或三种元素组成的常见化合物,庚是由其中的一种元素形成的单质,甲为淡黄色固体,已知:甲+乙===丁+庚,甲+丙===戊+庚;常温下0.1 mol·L-1丁溶液的pH为13,则下列说法不正确的是( )
A.元素C分别可以与元素A、B、D形成多种化合物
B.元素B、C、D的原子半径由大到小的顺序为r(D)>r(B)>r(C)
C.1.0 L 0.1 mol·L-1戊溶液中含阴离子总的物质的量小于0.1 mol
D.甲与戊都为离子化合物,其晶体中阳离子数与阴离子数之比相同
C [由丁的溶液可知丁为氢氧化钠,甲为过氧化钠,则可猜测单质庚为O2,由此推断乙为水,丙为二氧化碳,则A、B、C、D分别为H、C、O、Na。A项,氢、碳、钠和氧会形成多种化合物,如:H2O、H2O2,CO、CO2,Na2O、Na2O2等,故A项正确;B项,原子半径比较,先看周期数再看原子序数,故B项正确;C项,由于碳酸根离子会水解成碳酸氢根离子和氢氧根离子,故含0.1 mol Na2CO3的水溶液中阴离子的物质的量大于0.1 mol,C项错误;D项,过氧化钠和碳酸钠中阳离子数和阴离子数之比都为2∶1,故D项正确。]
根据表中短周期元素的有关信息判断,下列说法错误的是( )
元素编号
E
F
G
H
I
J
K
L
原子半
径/nm
0.037
0.074
0.082
0.099
0.102
0.143
0.160
0.186
最高化合
价或最低
化合价
+1
-2
+3
-1
-2
+3
+2
+1
A.最高价氧化物对应水化物的酸性:H>I
B.简单离子半径:K>F
C.同温下,形状、大小相同的单质与等浓度、等体积的稀硫酸反应的速率:L>K>J
D.相同条件下,等物质的量的单质与氢气化合放出的能量:F>I
B [F、I的最低负化合价都为-2,应该为第Ⅵ
A族元素,根据原子半径可知F为O,I为S;E、L的最高正化合价为+1,结合原子半径大小可知E为H,L为Na;K的最高正化合价为+2,结合原子半径可知K为Mg;G、J的最高正化合价为+3,结合原子半径可知G为B,J为Al;H的最低化合价为-1,为ⅦA族元素,其原子半径大于F,则H为Cl。选项A,Cl的最高价氧化物对应的水化物为高氯酸,S的最高价氧化物对应的水化物为硫酸,由于非金属性:Cl>S,则高氯酸的酸性大于硫酸,正确;选项B,Mg2+、O2-电子层结构相同,核电荷数越大离子半径越小,故离子半径:Mg2+<O2-,错误;选项C,L、K、J分别为Na、Mg、Al,三者的单质与等浓度、等体积的稀硫酸反应的速率:Na>Mg>Al,正确;选项D,非金属性:O>S,故氧气与氢气化合时生成的H2O的热稳定性高,放出的能量更多,D正确。]
突破2| 粒子半径的大小比较
[考纲知识整合]
粒子半径大小比较的一般方法
1.
2.同元素粒子:核外电子越多,半径越大,如r(Fe)>r(Fe2+)>r(Fe3+)、r(Cl)>r(Cl-)。
3.同电子数粒子:核电荷数越大,半径越小,如r(Na+)>r(Mg2+)>r(Al3+)。
4.核电荷数,电子层数,电子数均不同的粒子:可用参照法。如r(K+)与r(Mg2+)比较时可参照r(K+)>r(Na+)>r(Mg2+)来确定r(K+)>r(Mg2+)。
[高考命题点突破]
命题点 粒子半径的大小比较
1.下列各组微粒半径大小的比较中,错误的是( )
A.K>Na>Li B.Mg2+>Na+>F-
C.Na+>Mg2+>Al3+ D.Cl->F->F
B [A.同主族自上而下原子半径增大,故原子半径K>Na>Li,故A正确;B.核外电子排布相同,核电荷数越大离子半径越小,故离子半径F->Na+>Mg2+,故B错误;C.核外电子排布相同,核电荷数越大离子半径越小,故离子半径Na+>Mg2+>Al3+
,故C正确;D.最外层电子数相同,电子层越多离子半径越大,阴离子半径大于相应的原子半径,故半径Cl->F->F,故D正确。]
2.(2017·南通中学期中)A、B、C、D为四种短周期主族元素,且原子序数依次增大。已知A的最外层电子数是其电子层数的2倍,B是地壳中含量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有1个电子。下列说法正确的是( )
A.原子半径:C>A
B.离子半径:D3+>B2-
C.非金属性:A>B
D.最高价氧化物对应水化物的碱性:CC,A正确;根据核外电子排布相同的离子,核电荷数小的半径大,离子半径:O2->Al3+,B错误;非金属性:O>C,即B>A,C错误;根据元素的金属性越强最高价氧化物对应水化物的碱性越强,碱性:C>D,D错误。]
3.(2018·黄冈模拟)如图是部分短周期元素原子半径与原子序数的关系图,下列说法正确的是( )
【导学号:95160109】
A.最高价氧化物对应水化物的碱性:ZR
C.X、N两种元素组成的化合物不与任何酸反应
D.简单离子的半径:ZM,故A错误;B.HF的还原性比HCl的弱,故B错误;C.X、N两种元素组成的化合物为二氧化硅,可与HF反应,故C错误;D.离子电子层结构相同,核电荷数越大离子半径越小;最外层电子数相同,电子层数越多离子半径越大。所以简单离子的半径:Z
相关文档
- 2020届高考化学一轮复习化学能与热2021-05-13 01:09:447页
- 山西专用高考化学一轮复习化学反应2021-05-12 22:14:3911页
- 2021届高考化学一轮复习化学平衡及2021-05-12 21:58:3215页
- 2020届高考化学一轮复习化学平衡常2021-05-12 21:52:1611页
- 2021届高考化学一轮复习化学实验仪2021-05-12 19:45:389页
- 2021届高考化学一轮复习化学反应速2021-05-12 13:06:549页
- 化学反应及其能量高考化学一轮复习2021-05-12 12:14:174页
- 2021届高考化学一轮复习化学实验的2021-05-12 01:46:3512页
- 2019届高考化学一轮复习化学键 分2021-05-11 22:29:496页
- 2021届高考化学一轮复习化学反应速2021-05-11 15:21:1815页