- 1.02 MB
- 2021-05-12 发布
专题讲座二 气体的实验室制备、净化和收集
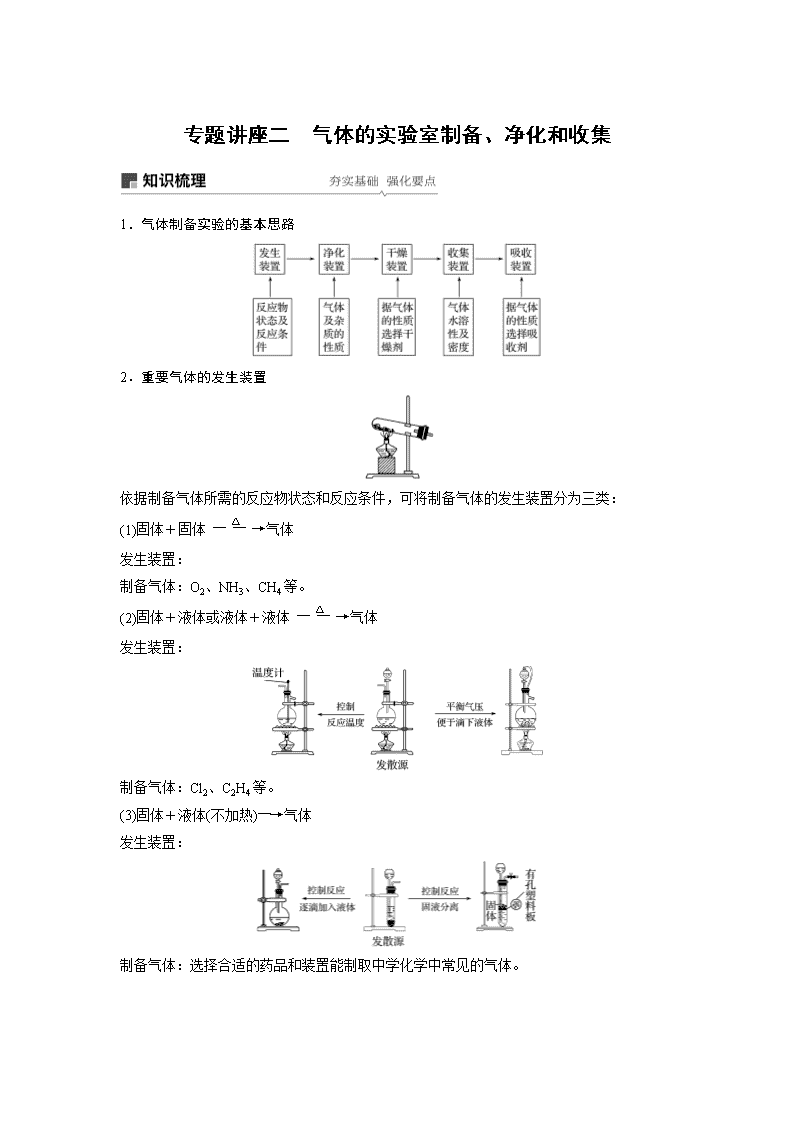
1.气体制备实验的基本思路
2.重要气体的发生装置
依据制备气体所需的反应物状态和反应条件,可将制备气体的发生装置分为三类:
(1)固体+固体气体
发生装置:
制备气体:O2、NH3、CH4等。
(2)固体+液体或液体+液体气体
发生装置:
制备气体:Cl2、C2H4等。
(3)固体+液体(不加热)―→气体
发生装置:
制备气体:选择合适的药品和装置能制取中学化学中常见的气体。
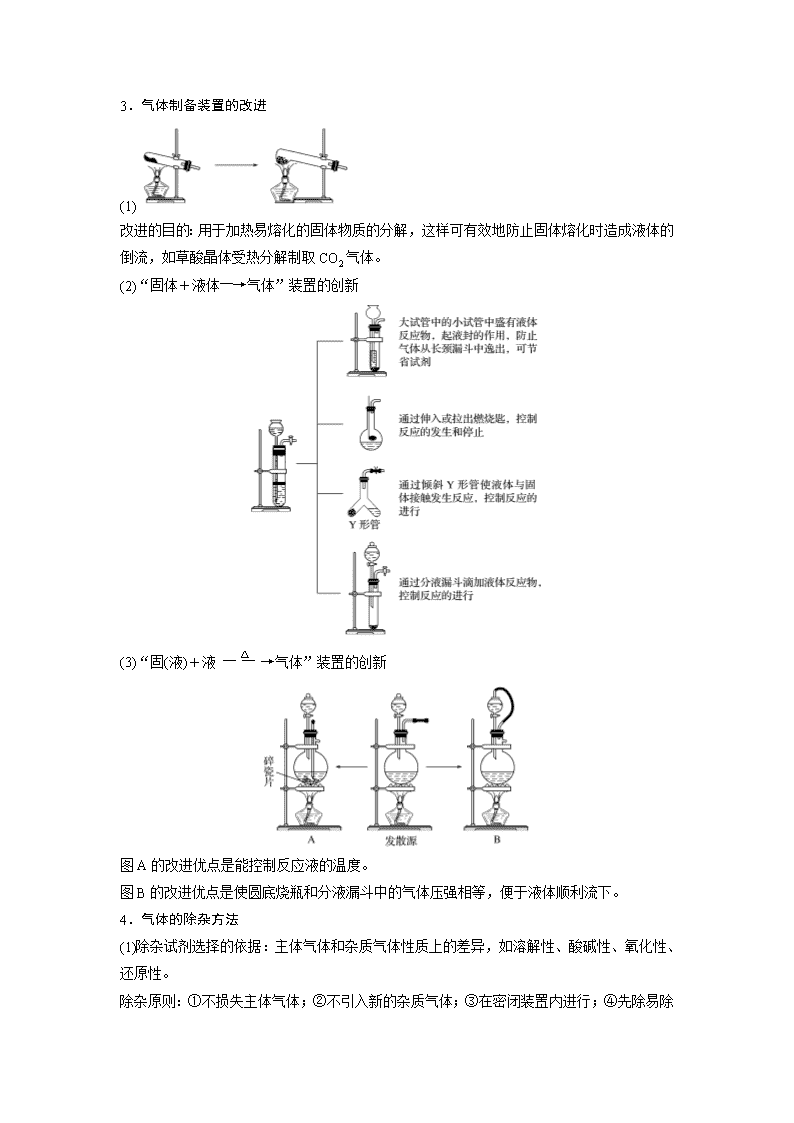
3.气体制备装置的改进
(1)
改进的目的:用于加热易熔化的固体物质的分解,这样可有效地防止固体熔化时造成液体的倒流,如草酸晶体受热分解制取CO2气体。
(2)“固体+液体―→气体”装置的创新
(3)“固(液)+液气体”装置的创新
图A的改进优点是能控制反应液的温度。
图B的改进优点是使圆底烧瓶和分液漏斗中的气体压强相等,便于液体顺利流下。
4.气体的除杂方法
(1)除杂试剂选择的依据:主体气体和杂质气体性质上的差异,如溶解性、酸碱性、氧化性、还原性。
除杂原则:①不损失主体气体;②不引入新的杂质气体;③在密闭装置内进行;④
先除易除的杂质气体。
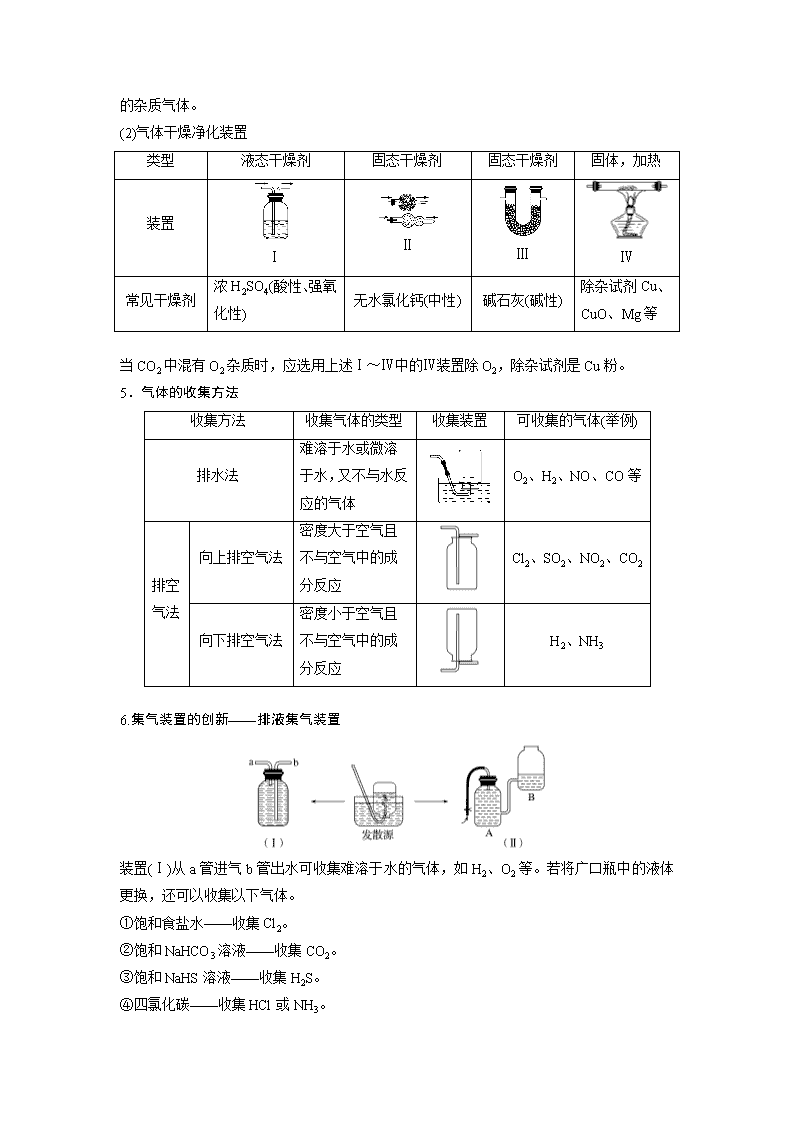
(2)气体干燥净化装置
类型
液态干燥剂
固态干燥剂
固态干燥剂
固体,加热
装置
Ⅰ
Ⅱ
Ⅲ
Ⅳ
常见干燥剂
浓H2SO4(酸性、强氧化性)
无水氯化钙(中性)
碱石灰(碱性)
除杂试剂Cu、CuO、Mg等
当CO2中混有O2杂质时,应选用上述Ⅰ~Ⅳ中的Ⅳ装置除O2,除杂试剂是Cu粉。
5.气体的收集方法
收集方法
收集气体的类型
收集装置
可收集的气体(举例)
排水法
难溶于水或微溶于水,又不与水反应的气体
O2、H2、NO、CO等
排空气法
向上排空气法
密度大于空气且不与空气中的成分反应
Cl2、SO2、NO2、CO2
向下排空气法
密度小于空气且不与空气中的成分反应
H2、NH3
6.集气装置的创新——排液集气装置
装置(Ⅰ)从a管进气b管出水可收集难溶于水的气体,如H2、O2等。若将广口瓶中的液体更换,还可以收集以下气体。
①饱和食盐水——收集Cl2。
②饱和NaHCO3溶液——收集CO2。
③饱和NaHS溶液——收集H2S。
④四氯化碳——收集HCl或NH3。
装置(Ⅱ)储气式集气。气体从橡胶管进入,可将水由A瓶排入B瓶,在瓶A中收集到气体。
7.尾气处理的原因、方法及装置
(1)原因:有些气体有毒或有可燃性,任其逸散到空气中,会污染空气或者引发火灾、爆炸等灾害。
(2)处理方法:一般根据气体的相关性质,使其转化为非气态物质或无毒物质,如酸性有毒气体用碱溶液吸收,可燃性气体用点燃等措施。
(3)尾气处理装置(见下图a、b、c)
①实验室制取Cl2时,尾气的处理可采用b装置。
②制取CO时,尾气处理可采用ac装置。
③制取H2时,尾气处理可采用ac装置。
题组一 气体的制备与性质探究
1.(2017·临沂市高三上学期期中考试)用下图所示装置进行实验,下列实验现象描述错误的是( )
实验
试剂甲
试剂乙
试剂丙
丙中的现象
A
稀盐酸
CaCO3
Na2SiO3溶液
有白色沉淀生成
B
浓硫酸
Na2SO3
BaCl2溶液
有白色沉淀生成
C
过氧化氢
MnO2
酸性KI淀粉溶液
溶液变为蓝色
D
浓盐酸
KMnO4
Na2S溶液
有淡黄色沉淀生成
答案 B
解析 A项,盐酸和碳酸钙反应生成CO2,CO2与硅酸钠溶液反应生成硅酸白色沉淀,正确;B项,浓硫酸与亚硫酸钠反应生成SO2,但SO2与氯化钡不反应,错误;C项,过氧化氢在二氧化锰的作用下分解生成氧气,氧气把碘化钾氧化为单质碘,碘遇淀粉显蓝色,正确;D
项,浓盐酸与高锰酸钾混合生成氯气,氯气把硫化钠氧化为单质S,产生淡黄色沉淀,正确。
2.(2018·曲阜市高三检测)用如图所示装置和相应试剂能达到实验目的的是( )
选项
实验目的
试剂a
试剂b
试剂c
装置
A
验证非金属性:S>C>Si
稀硫酸
Na2CO3
Na2SiO3溶液
B
制备纯净的氯气
浓盐酸
MnO2
饱和食盐水
C
检验溶液X中含有CO
盐酸
溶液X
澄清石灰水
D
除去Na2SO3中的Na2SO4
氯水
混合物
NaOH溶液
答案 A
解析 A项,装置b中出现气体,说明硫酸的酸性强于碳酸,装置c中出现沉淀,说明碳酸的酸性强于硅酸,最高价氧化物对应水化物的酸性越强,非金属性越强,即S>C>Si,正确;B项,MnO2和浓盐酸反应,需要加热,此装置中没有加热装置,饱和食盐水除去氯气中的HCl,从装置c中出来的氯气中混有水蒸气,不是纯净的,错误;C项,装置b中加入盐酸,出现能使澄清石灰水变浑浊的气体,不能说明X中含有CO,可能含有HCO或SO或HSO,错误;D项,氯水具有强氧化性,能把SO氧化成SO,不能达到实验目的,错误。
3.(2017·湖北省部分重点高中协作体高三上学期联考)利用如图所示装置进行下列实验,能得到相应实验结论的是( )
选项
①
②
③
实验结论
A
浓硫酸
Na2SO3
KMnO4溶液褪色
SO2有漂白性
B
浓盐酸
KMnO4
FeBr2溶液变为黄色
氧化性:Cl2>Br2
C
稀硫酸
碳酸钠
CaCl2溶液无明显变化
CO2不与CaCl2反应
D
浓硫酸
蔗糖
溴水褪色
浓硫酸具有脱水性、吸水性
答案 C
解析 A项,二氧化硫使酸性高锰酸钾溶液褪色表现的是二氧化硫的还原性,错误;B项,氯气通入溴化亚铁溶液先氧化亚铁离子,使溶液变为黄色,错误;C项,碳酸的酸性弱于盐酸,所以二氧化碳不与氯化钙反应,正确;D项,溴水褪色说明有二氧化硫生成,证明了浓硫酸的强氧化性,错误。
4.(2017·江西省临川区第一中学高三上学期期中考试)用下图所示装置进行实验,下列对实验现象的解释不合理的是( )
选项
①中试剂
①中现象
解释
A
品红溶液
溶液褪色
SO2具有漂白性
B
Na2SiO3溶液
产生胶体沉淀
酸性:H2SO3>H2SiO3
C
Ba(NO3)2溶液
生成白色沉淀
SO与Ba2+生成白色BaSO3沉淀
D
酸性KMnO4溶液
紫色褪去
SO2具有还原性
答案 C
解析 Cu和浓硫酸发生反应Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。A项,SO2具有漂白性,能使品红溶液褪色,正确;B项,通入SO2后产生胶体沉淀,说明产生H2SiO3,即H2SO3酸性强于H2SiO3,正确;C项,SO2溶于水,溶液显酸性,NO在酸性条件下具有强氧化性,能把H2SO3或SO氧化成SO,因此沉淀是BaSO4,错误;D项,酸性高锰酸钾溶液具有氧化性,紫色褪去,说明SO2具有还原性,正确。
题组二 高考新题型——和气体制备有关的仪器连接分析
5.(2017·全国卷Ⅰ,10)实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是( )
A.①②③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C.结束反应时,先关闭活塞K,再停止加热
D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
答案 B
解析 A项,气体从溶液中逸出易带出水蒸气,所以浓硫酸应放在③中,错误;B项,先通
H2以排除空气,加热前应先检验H2的纯度,正确;C项,若先停止通H2,空气有可能重新将W氧化,应先停止加热,再关闭活塞K,错误;D项,MnO2和浓盐酸反应制氯气需要加热,不能用启普发生器制备,错误。
6.(2018·海南省海南中学高三月考)用下图所示装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因分析中,一定错误的是( )
A.Ⅰ、Ⅱ装置之间缺少干燥装置
B.Ⅲ装置之后缺少干燥装置
C.Ⅱ装置中玻璃管内有水冷凝
D.CuO没有全部被还原
答案 D
解析 用H2还原CuO时,装置Ⅲ中CaCl2吸收的是生成的水,而装置Ⅱ中玻璃管通H2前后的质量差为反应时消耗CuO中氧的质量,即生成水中氧元素的质量,而m(水)-m(氧)=m(氢)。当Zn和稀硫酸反应产生的H2不干燥[m(水)偏大],装置Ⅲ后不加干燥装置,使Ⅲ中CaCl2吸收空气中的水分[m(水)偏大],Ⅱ中玻璃管内有水冷凝[m(氧)偏小],都会造成测得m(H)∶m(O)>1∶8。H2O的组成与CuO是否完全反应无关,只与通H2前后玻璃管的质量差和生成的水有关。
7.(2017·河北省武邑中学高三上学期期中考试)Cl2O是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物或还原剂接触会发生燃烧并爆炸。一种制取Cl2O的装置如图所示,加热装置和夹持仪器已略。
已知:Cl2O的熔点为-116 ℃,沸点为3.8 ℃;Cl2的沸点为-34.6 ℃;HgO+2Cl2===HgCl2+Cl2O。下列说法正确的是( )
A.装置②③中盛装的试剂依次是浓硫酸和饱和食盐水
B.通干燥空气的目的是作氧化剂
C.从装置⑤中逸出气体的主要成分是Cl2O
D.装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸
答案 D
解析 A项,从饱和食盐水中逸出的气体中含有水蒸气,所以氯气要先通过饱和食盐水,再通过浓硫酸,即装置②③中盛装的试剂依次是饱和食盐水和浓硫酸,错误;B项,通干燥空气的目的是将Cl2O从发生装置完全赶出至收集装置,错误;C项,从装置⑤中逸出气体的主要成分是Cl2,错误;D项,装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸,正确。
题组三 仪器连接专练
8.将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20 ℃,1.01×105 Pa)的体积。某同学拟选用如图实验装置完成实验:
最简易的装置其连接顺序:A接(______)(________)接(________)(________)接(________)(填接口字母,可不填满)。
答案 E D G
9.实验室合成硫酰氯要先制取干燥氯气。制备干燥纯净的氯气所用仪器如下图:
上述仪器的连接顺序:e接________,________接________,________接________,________接________(按气流方向,用小写字母表示)。
答案 d c a b i h g
10.亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
已知:① NO+NO2+2OH-===2NO+H2O
②气体液化的温度:NO2(21 ℃)、NO(-152 ℃)
(1)反应前应打开弹簧夹,先通入一段时间氮气,目的是_______________________________
________________________________________________________________________。
(2)为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→________;组装好仪器后,接下来进行的操作是_______________________________________________。
答案 (1)排出装置中的空气,防止干扰NO的检验 (2)CEDB 检查装置的气密性
解析 (1)反应前应打开弹簧夹,先通入一段时间氮气,排出装置中的空气,防止干扰NO的检验,否则会影响NO和NO2的检验。(2)为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A是发生装置,C是干燥除去水。因为NO2更易液化,先分离NO2,所以接E冷却二氧化氮,NO2分离后再检验NO,再接D通氧气,观察到气体从无色变成红棕色,说明是NO,B是尾气处理;吸收反应后剩余的NO和NO2的混合气体,防止污染空气。装置的连接为A→C→E→D→B;有气体参与或生成的实验必须检查装置的气密性,故组装好仪器后,接下来进行的操作是检查装置的气密性。
11.利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、 H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。
(1)仪器a的名称为________,仪器b中装入的试剂可以是____________。
(2)按气流方向正确的装置连接顺序为________(填字母,装置可重复使用)。
答案 (1)分液漏斗 NaOH或生石灰或碱石灰 (2)BDADC
解析 (1)仪器a的名称为分液漏斗,仪器b中装入的试剂可以是NaOH或生石灰或碱石灰。
(2)该实验在B处产生氨,通过D干燥氨,在A处NH3与MxOy反应,生成的水在D处被吸收,残留氨被C吸收,所以按气流方向正确的装置连接顺序为BDADC。
相关文档
- 化学反应及其能量高考化学一轮复习2021-05-12 12:14:174页
- 2021届高考化学一轮复习化学实验的2021-05-12 01:46:3512页
- 2019届高考化学一轮复习化学键 分2021-05-11 22:29:496页
- 2021届高考化学一轮复习化学反应速2021-05-11 15:21:1815页
- 2019届一轮复习化学实验常用仪器和2021-05-11 13:26:5616页
- 2020届高考化学一轮复习化学反应速2021-05-11 11:06:056页
- 2020届高考化学一轮复习化学资源的2021-05-11 10:43:4215页
- 2020届高考化学一轮复习化学计量在2021-05-10 21:04:0311页
- 2020届高考化学一轮复习化学反应与2021-05-10 20:34:198页
- 通用版高考化学微一轮复习化学平衡2021-05-10 19:28:2915页