- 1.08 MB
- 2021-05-12 发布
第章 化学实验基础
第1节 化学实验仪器和基本操作
考纲定位
全国卷5年考情
1.了解化学实验室常用仪器的主要用途和使用方法。
2.掌握化学实验的基本操作。能识别化学品标志。
3.了解实验室一般事故的预防和处理方法。
4.正确选用实验装置。
2017年:Ⅰ卷T10(D)、T26(1)(2);Ⅱ卷T28(3);Ⅲ卷T9、T26(2)
2016年:Ⅰ卷T10;Ⅱ卷T13;Ⅲ卷T9、T26(2)
2015年:Ⅰ卷T26;Ⅱ卷T13
2014年:Ⅰ卷T13、T26(1);Ⅱ卷T10、T28(1)(2)
2013年:Ⅰ卷T26(1)(2);Ⅱ卷T26(2)(4)
考点1| 常用化学仪器的识别和使用方法
(对应学生用书第185页)
[考纲知识整合]
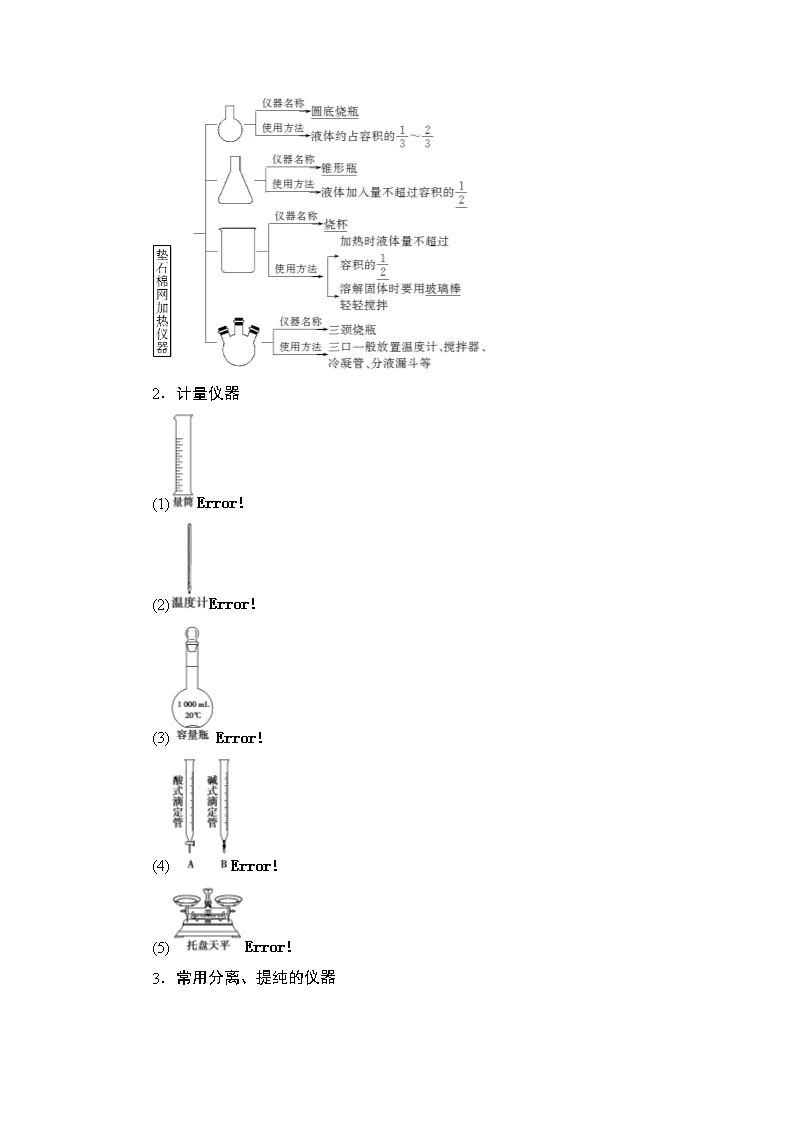
1.加热仪器
2.计量仪器
(1)
(2)
(3)
(4)
(5)
3.常用分离、提纯的仪器
(1)仪器②、③、④、⑤的名称分别为分液漏斗、蒸馏烧瓶、冷凝管(球形冷凝管或直形冷凝管)、干燥管。
(2)仪器①组装过滤器时,应注意滤纸上缘低于漏斗边缘。
(3)用仪器②后期分离时,下层液体从下口放出,上层液体从上口倒出。
(4)仪器③使用时,要垫石棉网加热,温度计的水银球插到烧瓶的支管口处。
(5)使用仪器④时,从下口进水,上口出水。其中的球形冷凝管适用于冷凝回流,不适用于蒸馏。
(6)仪器⑤⑥用于分离时,应装固体吸收剂进行除杂;对仪器⑤,从粗口进气,细口出气。
(7)用仪器⑦除杂时,从A口进气,B口出气,用仪器⑦排水收集气体时,从B口进气,A口出水。
4.其他仪器
(1)滴瓶
用途:用于盛放少量液体药品。
注意:①滴瓶上的滴管与滴瓶配套使用,不可互换;
②不能将滴管平放或倒置,以免溶液流入胶头;
③见光易分解的物质要用棕色瓶盛放。
(2)胶头滴管
用途:用于吸取和滴加少量液体。
注意:①胶头滴管使用时不要将液体吸入胶头内,不能平放或倒置;②滴液时不可接触器壁;③用后立即洗净,再去吸取其他药品;④滴液时,不可伸入仪器内,应悬空滴加。
(3) ①酒精灯所装酒精量不能超过其容积
的,不能少于;
②加热时要用外焰,熄灭时要用灯帽盖
灭,不能吹灭;
③绝对禁止向燃着的酒精灯里添加酒
精、用燃着的酒精灯引燃另一只酒
精灯;
④需要强热的实验用酒精喷灯加热。
[应用体验]
判断正误 (正确的打“√”,错误的打“×”)。
(1)所有能加热的玻璃仪器必须垫石棉网加热。( )
(2)烧瓶中液体加热时液体加入量不超过容积的。( )
(3)10 mL的量筒可量取8.52 mL水。( )
(4)配制450 mL 0.1 mol/L的NaCl溶液,可选用450 mL的容量瓶。( )
(5)酸式滴定管可用来量取12.54 mL稀盐酸。( )
(6)Fe(OH)3灼烧分解时用蒸发皿加热。( )
(7)粗盐提纯实验时,多次用到玻璃棒,其中蒸发结晶时,要不断搅拌至滤液蒸干以防止因受热不均匀而引起飞溅。( )
(8)用胶头滴管滴加液体时,应将滴管伸入仪器内滴加。( )
(9)用pH试纸测得盐酸溶液的pH为2.2。( )
【答案】 (1)× (2)√ (3)× (4)× (5)√ (6)× (7)× (8)× (9)×
[高考命题点突破]
命题点1 常用化学仪器的识别和使用方法
1.(2014·全国Ⅰ卷)下列有关仪器使用方法或实验操作正确的是( )
【导学号:95160342】
A.洗净的锥形瓶和容量瓶可以放进烘箱中烘干
B.酸式滴定管装标准溶液前,必须先用该溶液润洗
C.酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差
D.用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体
B [A.容量瓶是定量实验仪器,洗净后自然晾干,不能放进烘箱中烘干。
B.酸式滴定管用于准确量取溶液的体积,先用蒸馏水洗净后,再用待装溶液润洗2~3次,否则将导致待装溶液的浓度偏小,影响实验结果。
C.锥形瓶用蒸馏水洗涤后,直接加入待滴定溶液,若用待滴定溶液润洗,所含溶质的量增大,消耗标准溶液的体积增大,测得实验结果偏高。
D.配制溶液时,加水超过刻度线,应重新配制,若用滴管吸出多余部分,所得溶液的浓度将偏低。]
2.如图所示是实验室常用的部分仪器。
请回答下列问题:
(1)序号为⑥⑧⑩⑪⑫的仪器的名称分别为____________、________、________、________、________。
(2)在分液操作中,必须用到上述仪器中的________(填序号)。
(3)能作反应容器且可直接加热的仪器是上述中的________(填名称)。
(4)在配制一定物质的量浓度的溶液时,需要用到的仪器是________(填序号)。
(5)仪器上标有温度的是________(填序号)。
(6)读取⑨中液体体积时,仰视读数,结果________(填“偏大”或“偏小”)。
【答案】 (1)分液漏斗 容量瓶 直形冷凝管 蒸馏烧瓶 酸式滴定管 (2)②⑥ (3)试管 (4)②④⑧⑨ (5)⑧⑨⑫ (6)偏小
3.有下列几种常见仪器:①分液漏斗 ②长颈漏斗 ③酸式滴定管 ④容量瓶 ⑤碱式滴定管 ⑥球形冷凝管 ⑦直形冷凝管
请回答下列几个问题:
【导学号:95160343】
(1)使用前必须检查是否漏水的是________(填序号)。
(2)碱式滴定管不能盛装KMnO4溶液的理由是__________________
________________________________________________________________。
(3)蒸馏用的冷凝管最好是________(填序号,下空同),冷凝回流用的冷凝管最好是________。
(4)容量瓶用于配制溶液时,定容时仰视,所配溶液浓度有什么误差?________。
【答案】 (1)①③④⑤ (2)碱式滴定管下端的橡胶管易被KMnO4溶液氧化变质 (3)⑦ ⑥ (4)偏低
命题点2 特定装置的识图分析判断
4.下列有关实验原理、装置、操作或结论的描述中正确的是________(填序号)。
①制取纯净CO2 ②收集NO2
③除去Cl2中的HCl ④收集SO2
⑤检验气体是否易溶于水 ⑥制取乙酸乙酯
观察Fe的吸氧腐蚀
⑨验证Mg与稀盐酸反应放热 ⑩阳离子交换膜法电解NaCl溶液制碱
⑪测定溶液的pH ⑫验证浓H2SO4的脱水性、,强氧化性和SO2漂白性、 还原性
【解析】 ①纯碱易溶于水,无法控制反应,不正确;②ρ(NO2)>ρ(空气),正确;③除杂时,应从长管进,不正确;④ρ(SO2)>ρ(空气),进气管应插至瓶底,不正确;⑤气体易溶于水,p减小,倒吸,正确;⑥易发生倒吸,不正确;⑦硝酸易挥发,CO2中含有HNO3,不正确;⑧倒吸一段水柱,正确;⑨放热,温度高,压强大,U型管左液面下降,正确;⑩Na+透过交换膜,正确;⑪试纸不能直接放在桌面上,应放在玻璃片上,不正确;⑫蔗糖变黑且生成SO2,证明浓H2SO4的脱水性和强氧化性,SO2使品红退色,酸性KMnO4溶液退色证明SO2具有漂白性和还原性,正确。
【答案】 ②⑤⑧⑨⑩⑫
5.(2015·全国Ⅱ卷)用下图所示装置进行下列实验:将①中溶液滴入②
中,预测的现象与实际相符的是( )
选项
①中物质
②中物质
预测②中的现象
A
稀盐酸
碳酸钠与氢氧化钠的混合溶液
立即产生气泡
B
浓硝酸
用砂纸打磨过的铝条
产生红棕
色气体
C
氯化铝
溶液
浓氢氧化钠溶液
产生大量
白色沉淀
D
草酸溶液
高锰酸钾酸性溶液
溶液逐渐退色
D [A项Na2CO3和NaOH的混合溶液中滴加稀盐酸,稀盐酸先与NaOH发生中和反应,再与Na2CO3分步发生反应:Na2CO3+HCl===NaHCO3+NaCl,NaHCO3+HCl===NaCl+CO2↑+H2O,因此开始阶段滴加稀盐酸,②中不产生气泡。B项常温下,浓硝酸与铝条发生钝化,铝条表面生成致密的氧化铝薄膜,阻止内层铝与浓硝酸继续反应,②中观察不到产生红棕色气体。C项将AlCl3溶液滴加到NaOH溶液中,由于NaOH过量,发生的反应为AlCl3+4NaOH===Na[Al(OH)4]+3NaCl,得不到大量白色沉淀。D项KMnO4酸性溶液具有强氧化性,H2C2O4溶液具有较强的还原性,二者发生氧化还原反应:2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O,由于MnO被还原为Mn2+,②中酸性KMnO4溶液逐渐退色。]
[易错防范] 给定装置的识图关键点
(1)仪器的选择和连接问题;(2)给定目的的试剂选择及反应的控制问题;(3)连接时导管的进出口问题。
考点2| 化学实验常见的基本操作
(对应学生用书第188页)
[考纲知识整合]
1.药品的取用
(1)取用粉末状或小颗粒状固体用药匙(或纸槽),要把药品送入试管底部,而不能沾在管口和管壁上,块状和大颗粒固体用镊子夹取。
(2)向容器内加液体药品
取少量液体可用胶头滴管,取用较多的液体用倾倒法,注意试剂瓶上的标签朝向手心;向容量瓶、漏斗中倾倒液体时,要用玻璃棒引流。
2.物质的溶解
(1)固体物质的溶解
①振荡、搅拌、加热等措施可加快溶解速率;
②一般将溶剂加入溶质中,但配制氯化铁、硫酸铝等一些易水解的盐溶液时,要将这些固体用相应酸溶解,再加入蒸馏水,以得到澄清溶液。
(2)气体的溶解
①溶解度不大的气体,如CO2、Cl2、H2S等,用如图(a)所示装置;
②极易溶于水的气体,如HCl、NH3等,用如图(b)所示装置,该类装置可防止倒吸。
(3)液体物质的溶解(稀释):一般把密度大的液体加入到密度小的液体中,如浓硫酸的稀释、浓硫酸与浓硝酸的混合等。
3.物质的加热
(1)固体的加热
①试管口要略向下倾斜,防止生成的水倒流,引起试管炸裂。
②先给试管均匀加热,受热均匀后再固定在药品部位加热。
(2)液体的加热
加热前,先把玻璃容器外壁的水擦干,以免炸裂试管;用试管夹夹住试管中上部,试管口向上倾斜,不得对人,以防液体沸腾时溅出烫伤人。
提醒:三种加热方式比较
加热方式
适用范围或特点
直接加热
瓷质、金属质或小而薄的玻璃仪器(如试管)等
隔石棉网加热
较大的玻璃反应器(如烧杯、烧瓶等)
浴热(水浴、
油浴、沙浴等)
反应器均匀受热且一定温度恒温加热,但水浴加热温度不超过100°C
4.常用试纸的使用
(1)常见类型
②——测量(粗测)溶液的pH,确定酸碱性的强弱
③——检验SO2等有漂白性的物质
④——检验Cl2等有氧化性的物质
(2)使用方法
①检验溶液:取一小块试纸放在玻璃片或表面皿上,用玻璃棒蘸取待测液体,点在试纸中部,观察试纸的颜色变化,确定溶液的性质,若用pH试纸测pH时,还需与标准比色卡对照确定pH。
②检验气体:先用蒸馏水把试纸润湿,用镊子夹取或粘在玻璃棒的一端,然后再放在集气瓶口或导管口处,观察试纸的颜色变化。
③用pH试纸定量测定溶液的pH时,不能用蒸馏水润湿。若润湿,测得的结果可能会产生误差。
酸性溶液pH偏大,碱性溶液pH偏小,中性溶液pH无误差。
5.装置的气密性检查
检查装置气密性的基本思路是使装置内外压强不等,观察气泡或液面变化。
(1)微热法:如图a。用酒精灯微热或用手焐热容器,导管口产生气泡,停止加热或松开手后导管内倒吸形成一段水柱,证明装置不漏气。
(2)液差法:如图b、c。连接好仪器,b中夹紧弹簧夹,从长颈漏斗中注入适量水,使b中长颈漏斗中的液面高于锥形瓶中的液面,静置,若液面位置保持不变,证明装置不漏气。c中,从乙管加入适量水,使乙管液面高于甲管液面,静置,若液面位置保持不变,证明装置不漏气。
(3)滴液法:如图d。向分液漏斗中注入适量水,关闭弹簧夹,打开分液漏斗活塞,如果水不能持续流下,则装置气密性良好。
(4)抽气(吹气)法:如图e、f。e中关闭分液漏斗的活塞,轻轻向外拉动或向里推动注射器的活塞,一段时间后,活塞能回到原来位置,表明装置的气密性良好。f中打开弹簧夹,向导管口吹气,如果长颈漏斗中的液面上升,且停止吹气后,夹上弹簧夹,长颈漏斗液面保持稳定,则表明装置的气密性良好。(液差法的拓展)
6.仪器的洗涤
(1)方法:使用毛刷,用去污剂和水冲洗。
(2)洗净的标准:玻璃仪器内壁附着均匀的水膜,既不聚成水滴,也不成股流下。
(3)试剂选择:溶解或通过化学反应把黏附物转化为可溶物而洗去。
实例:填写下列表格。
残留物
洗涤剂
容器里附有的油污
热的碱性溶液
容器壁上附着的硫
CS2或热的NaOH溶液
试管壁上的银镜
稀HNO3
AgCl
氨水
制Cl2时残留的MnO2
热的浓盐酸
[高考命题点突破]
命题点1 化学实验基本操作
1.下列有关实验的基本操作正确的是________(填序号)。
①将试管平放,用纸槽往试管里送入固体粉末,然后竖立试管
②用胶头滴管向试管中加入液体时,胶头滴管紧贴试管内壁
③为了促进固体物质的溶解,可采用加热、搅拌等措施
④稀释浓硫酸时,把浓硫酸慢慢倒入盛有水的量筒中并搅拌
⑤长时间盛放石灰水的烧杯应先加入适量的盐酸进行洗涤
⑥加热试管时,应先小火预热试管,然后固定位置加热
⑦水浴加热的优点是使反应器均匀受热并且控制恒温
⑧测定NH4Cl溶液的pH时,应先取一条pH试纸将一端浸入溶液中观察颜色变化,然后与标准比色卡对比确定溶液的pH
⑨用pH试纸可以测定氯水的pH
⑩检验NH3和HCl都可用湿润蓝色石蕊试纸
⑪用量筒量取液体时,视线与量筒内液体凹液面最低处保持水平
⑫对于气体的实验室制法过程中,加药品前的操作一般为检验装置气密性
⑬使用分液漏斗、滴定管、容量瓶前的第一步操作为检查仪器是否漏水
【解析】 ②胶头滴管一般不能插入试管内;④量筒不能用于稀释物质;⑧试纸不能直接浸入溶液中;⑨氯水具有漂白性,不能用pH试纸测pH;⑩检验NH3应用湿润的红色石蕊试纸。
【答案】 ①③⑤⑥⑦⑪⑫⑬
2.下列实验操作能达到实验目的的是( )
A.用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,原溶液中有Na+、无K+
B.向某溶液中加入硝酸钡溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,则原溶液中一定有SO
C.铜丝浸入Fe(NO3)3溶液,铜丝逐渐溶解,铜丝浸入AgNO3溶液,铜丝表面有银析出,可以比较Fe、Cu、Ag的金属活动性强弱
D.向新制的白色AgCl悬浊液中滴加少量0.1 mol·L-1KI溶液,试管中白色沉淀转化为黄色沉淀,证明Ksp(AgCl)>Ksp(AgI)
D [选项A,黄色火焰可以覆盖K+的浅紫色火焰,检验K+需透过蓝色钴玻璃观察火焰,A错误;选项B,向某溶液中加入硝酸钡溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,则原溶液中也可能有SO,B错误;选项C,不能根据+3价铁与Cu的氧化性强弱判断Fe、Cu的金属活动性强弱,C错误;选项D,沉淀溶解平衡向生成溶度积更小的物质的方向移动,则向新制的AgCl白色悬浊液中滴加少量0.1 mol·L-1KI溶液,产生黄色沉淀,证明Ksp(AgCl)>Ksp(AgI),D正确。]
[易错防范] 化学实验基本操作的7个“不”
(1)容量瓶、量筒等定量容器,不能用作反应器,也不能用于溶解稀释或贮存液体。
(2)做完实验,剩余药品不能随意丢弃,也不要放回原瓶(活泼金属钠、钾等必须放回原试剂瓶)。
(3)称量有腐蚀性、易潮解的物质时,不能用纸片。
(4)温度计不能代替玻璃棒用于搅拌。
(5)浓H2SO4稀释时,水不能注入浓H2SO4中。
(6)测溶液pH时,pH试纸不能润湿。
(7)化学药品不能用手接触;不能用鼻子直接凑到容器口去闻气味;绝不能品尝味道。
命题点2 常见装置气密性检查
3.下列装置中,不添加其他仪器无法检查气密性的是( )
A [
A项,需用止水夹夹住橡胶管,烧瓶支管需封闭;B项,可用液差法;C项,可用微热法;D项,可用抽气法。]
4.(1)某实验小组利用如图装置(部分固定装置略去)制备氮化钙(Ca3N2),并探究其实验式。
【导学号:95160344】
按图连接好实验装置。检查装置的气密性,方法是
_______________________________________________________
______________________________________________________
_______________________________________________________
_______________________________________________________。
(2)右图装置气密性检查方法为__________________________________
_________________________________________________________________
_________________________________________________________________
_________________________________________________________________
________________________________________________________________。
【答案】 (1)关闭活塞K,将末端导管插入试管A的水中,用酒精灯微热硬质玻璃管,若导管口有连续均匀的气泡冒出,撤去酒精灯冷却一段时间,导管内形成一段水柱,并且一段时间不回落,说明装置气密性良好
(2)法1:将针筒活塞慢慢向外拉,若导管内液面下降或导管口冒出气泡,说明气密性良好
法2:将针筒活塞慢慢向里推进,若导管内液面上升,说明气密性良好
[题后归纳]
(1)一般气密性检查的答题模板
①微热法:封闭→微热→观察气泡→冷却导管中水柱上升→说明气密性良好。
②液差法:封闭→加水形成液面高度差→停止加水→观察液面不变化→
说明气密性良好。
规范思路:装置形成封闭体系→操作(微热、手捂、热毛巾捂、加水等)→描述现象→得出结论。
(2)化学实验操作的6个“第一步”
①检查装置的气密性——制取气体、验证气体的性质等与气体有关的实验操作。
②检查是否漏水——滴定管、容量瓶、分液漏斗等的使用。③调“0”点——天平等的使用。
④验纯——点燃可燃性气体等。
⑤分别取少量溶液——未知溶液的鉴别等。⑥湿润——用红色石蕊试纸、蓝色石蕊试纸、碘化钾淀粉试纸检验或验证某些气体时。
考点3| 化学实验安全与试剂保存
(对应学生用书第190页)
[考纲知识整合]
1.化学实验安全
(1)指出下列危险化学品标志的名称
爆炸品 易燃固体 氧化剂
剧毒品 腐蚀品
(2)化学实验中常见事故的处理
意外事故
处理方法
酒精及其他易燃有机物小面积失火
立即用湿布或沙土扑盖
钠、磷等失火
迅速用沙子覆盖
腐蚀性酸(或碱)流到桌上
立即用适量NaHCO3溶液(或稀醋酸)
冲洗,后用水冲洗
腐蚀性酸(或碱)沾到皮肤上
用水冲洗,再用NaHCO3稀溶液(或硼酸溶液)冲洗
腐蚀性酸、碱溅到眼中
立即用水反复冲洗,并不断眨眼,千万不要用手揉眼睛
误食重金属盐
应立即口服生蛋清或牛奶
汞滴落在桌上或地上
尽量回收,然后在桌子或地上撒上硫粉
(3)常见操作的安全问题
①加热制取气体,用排水法收集时,结束时不能先停止加热,防止倒吸,应先将导管移出。
②点燃H2、CH4或CO时,应先检验气体的纯度,防止爆炸。
③涉及H2或CO的性质验证的综合实验装置需加热时,应先排出装置中的空气,防止爆炸。
④浓H2SO4稀释时,应将浓H2SO4沿器壁缓缓注入水中并用玻璃棒不断搅拌,防止暴沸。
⑤液体加热时加沸石或碎瓷片防止暴沸。
⑥实验室里的药品,不能用手接触;不能用鼻子凑到容器口去闻气体的气味;不能尝药品的味道。
⑦不得用燃着的酒精灯去点燃另一只酒精灯;熄灭时不得用嘴去吹。
⑧给试管内液体加热时,不要把拇指按在试管夹短柄上;切不可使试管口对着自己或别人。
⑨使用玻璃容器加热时,不要使玻璃容器的底部跟灯芯接触,以免容器破裂;烧得很热的玻璃容器,不要用冷水冲洗或放在桌面上,以免破裂。
(4)三类安全装置图示
①防污染尾气处理装置
②防倒吸尾气处理装置
③防堵塞装置
防止堵塞导管,或使液体顺利流入,或使内外压强相等。
a b c d
2.常见化学试剂的保存
(1)试剂瓶选用的四个要素
①瓶口:固体药品存放于广口瓶中;液体药品存放于细口瓶中。
②瓶质:与SiO2强烈反应的试剂(如氢氟酸)不能用玻璃试剂瓶盛装。
③瓶塞:碱性溶液不可用带玻璃塞的试剂瓶来盛装,酸性或强氧化性溶液不可用带橡胶塞的试剂瓶盛装。
④瓶色:见光易分解的试剂应保存在棕色试剂瓶中。
(2)试剂保存的“六注意”
①易与空气中的氧气、水蒸气、二氧化碳等起反应的药品应密封保存。如钾、钠应浸在煤油中;白磷放在水中,使之与空气隔绝。
②易潮解、挥发、吸水的药品应密封保存。如固体NaOH、浓盐酸、浓硫酸等。
③见光易分解的物质应盛放在棕色瓶中,放置于阴凉处。如AgNO3、浓HNO3等。
④液态溴有毒且易挥发,应贮存于磨口的细口瓶中,加水封,加盖玻璃塞(不能用橡胶塞),并放置于阴凉处。
⑤易挥发、着火的药品应密封保存并放置于阴凉处,远离火源。如乙醇、乙醚、苯等。
⑥盛放药品的器皿应不能跟所盛药品反应。如盛NaOH溶液的试剂瓶不能用玻璃塞而应用橡胶塞。
[高考命题点突破]
命题点1 化学安全及一般事故的预防和处理方法
1.下列有关实验安全的说法或装置正确的是________(填序号)。
【导学号:95160345】
①在氢气还原氧化铜的实验中,应先通氢气,后加热氧化铜
②蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞投入碎瓷片
③实验室做钠的实验时,余下的钠屑投入废液缸中
④用如图装置制氨水
⑤金属钠着火时使用泡沫灭火器灭火
⑥用试管加热碳酸氢钠固体时使试管口竖直向上
⑦少量浓硫酸沾在皮肤上,应立即用氢氧化钾溶液冲洗
⑧用下图装置处理尾气CO
⑨浓H2SO4和乙醇的化学品标志分别为
和
⑩给试管中的液体加热时,应加入几片碎瓷片或不时地移动试管,以防暴沸
⑪在气体发生装置上直接点燃一氧化碳气体时,必须先检验一氧化碳气体的纯度
【答案】 ①⑦⑧⑨⑩⑪
2.对下列事故或药品的处理正确的是( )
A.钠、镁着火可用CO2灭火
B.燃着的酒精灯被打翻,引起失火,应立即用水浇灭
C.浓硫酸溅到皮肤上时立即用稀氢氧化钾溶液冲洗
D.有大量的氯气泄漏时,应用肥皂水浸湿软布捂住鼻 孔,并迅速离开现场
D [钠、镁着火用CO2灭火时可生成O2,A项错误;燃着的酒精灯被打翻,引起失火,应用湿抹布盖灭,B项错误;少量浓硫酸沾在皮肤上,先用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液,C项错误。]
[题后归纳] 实验室操作应当注意以下五防
(1)防爆炸:点燃可燃性气体(如H2、CO、CH4、C2H2、C2H4)或用CO、H2还原Fe2O3、CuO之前,要检验气体纯度。
(2)防暴沸:①配制硫酸的水溶液或硫酸的酒精溶液时,要将密度大的浓硫酸缓慢倒入水或酒精中;②加热液体混合物时要加沸石。
(3)防失火:实验室中的可燃物质一定要与强氧化性试剂分开放置并远离火源。
(4)防中毒:制取有毒气体(如Cl2、CO、SO2、H2S、NO2、NO等)时,应在通风橱中进行。
(5)防倒吸:加热法制取并用排水法收集气体或吸收溶解性较大气体时,要注意熄灭酒精灯前先将导管从液体中拿出。
命题点2 常用试剂保存
3.下列常用试剂保存正确的是________(填序号)。
①Na、K、Li均可保存在盛有煤油的广口瓶中
②Na2CO3溶液、NaOH溶液、水玻璃均可保存在带有玻璃塞的细口瓶中
③浓HNO3、AgNO3溶液、氯水均可保存在棕色细口试剂瓶中,并放于冷暗处
④保存硫酸亚铁溶液需加入铁钉
⑤AgBr、AgI固体可以放在无色广口瓶中
⑥酸性KMnO4溶液应放在带有玻璃塞的试剂瓶中
⑦汽油、苯等有机溶剂应放在带有橡皮塞的试剂瓶中
⑧液溴易挥发,在存放液溴的试剂瓶中应加水封
⑨氢氟酸保存在带塑料塞的玻璃瓶中,防止瓶口和塞子粘住
⑩镁、铝在空气中易形成致密的保护膜,可不密封保存
【解析】 ①Li不能保存于煤油中;②碱性溶液不能用玻璃塞;⑤AgBr、AgI见光均易分解,应放在棕色瓶中;⑦汽油、苯可溶解橡胶,不能用带有橡皮塞的试剂瓶保存;⑨氢氟酸与玻璃瓶中的SiO2反应生成SiF4气体,应用塑料瓶。
【答案】 ③④⑥⑧⑩
相关文档
- 化学反应及其能量高考化学一轮复习2021-05-12 12:14:174页
- 2021届高考化学一轮复习化学实验的2021-05-12 01:46:3512页
- 2019届高考化学一轮复习化学键 分2021-05-11 22:29:496页
- 2021届高考化学一轮复习化学反应速2021-05-11 15:21:1815页
- 2019届一轮复习化学实验常用仪器和2021-05-11 13:26:5616页
- 2020届高考化学一轮复习化学反应速2021-05-11 11:06:056页
- 2020届高考化学一轮复习化学资源的2021-05-11 10:43:4215页
- 2020届高考化学一轮复习化学计量在2021-05-10 21:04:0311页
- 2020届高考化学一轮复习化学反应与2021-05-10 20:34:198页
- 通用版高考化学微一轮复习化学平衡2021-05-10 19:28:2915页