- 452.50 KB
- 2021-05-09 发布
定量实验设计与评价
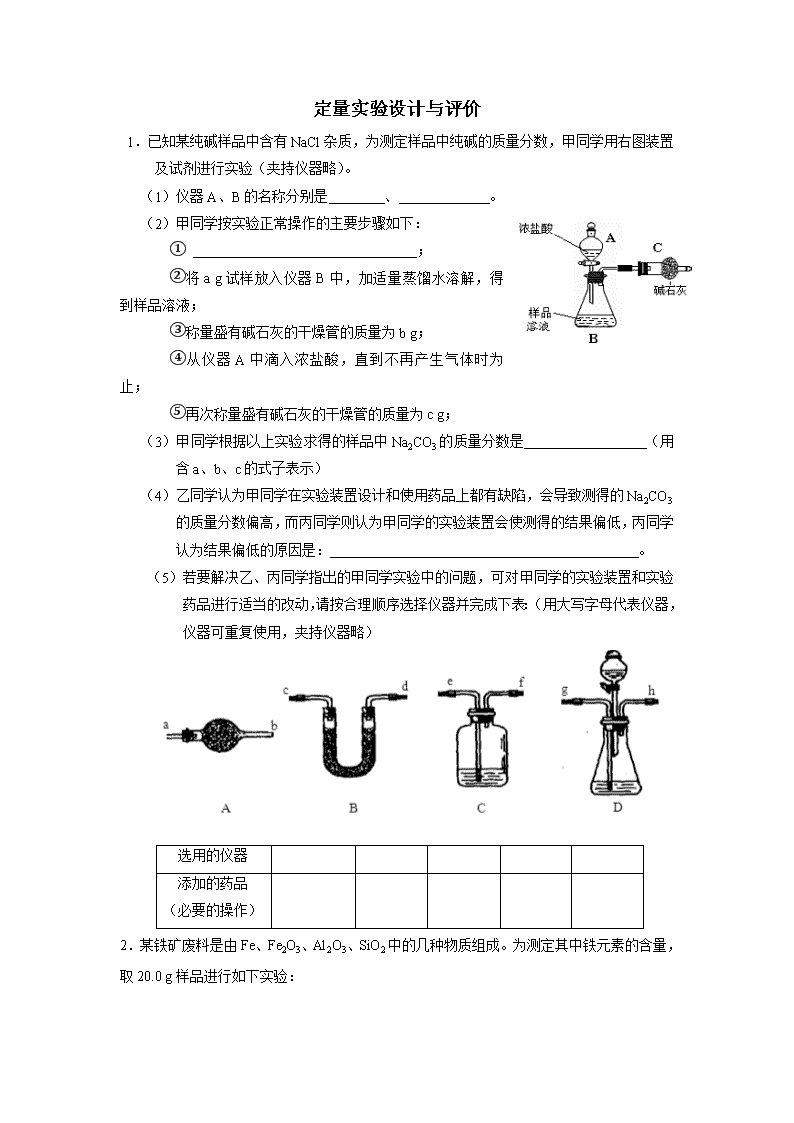
1.已知某纯碱样品中含有NaCl杂质,为测定样品中纯碱的质量分数,甲同学用右图装置及试剂进行实验(夹持仪器略)。
(1)仪器A、B的名称分别是 、 。
(2)甲同学按实验正常操作的主要步骤如下:
① ;
②将a g试样放入仪器B中,加适量蒸馏水溶解,得到样品溶液;
③称量盛有碱石灰的干燥管的质量为b g;
④从仪器A中滴入浓盐酸,直到不再产生气体时为止;
⑤再次称量盛有碱石灰的干燥管的质量为c g;
(3)甲同学根据以上实验求得的样品中Na2CO3的质量分数是 (用含a、b、c的式子表示)
(4)乙同学认为甲同学在实验装置设计和使用药品上都有缺陷,会导致测得的Na2CO3的质量分数偏高,而丙同学则认为甲同学的实验装置会使测得的结果偏低,丙同学认为结果偏低的原因是: 。
(5)若要解决乙、丙同学指出的甲同学实验中的问题,可对甲同学的实验装置和实验药品进行适当的改动,请按合理顺序选择仪器并完成下表:(用大写字母代表仪器,仪器可重复使用,夹持仪器略)
选用的仪器
添加的药品
(必要的操作)
2.某铁矿废料是由Fe、Fe2O3、Al2O3、SiO2中的几种物质组成。为测定其中铁元素的含量,取20.0 g样品进行如下实验:
已知:向Z中滴加KSCN溶液,无明显现象;H2体积为标准状况下测得。
请回答:
(1)分离X和Y的实验操作方法是________。
(2)向X中加入稀盐酸,发生氧化还原反应的离子方程式是________。
(3)下列说法正确的是________(填字母)。
a.W能与稀盐酸反应
b.铁矿废料中一定含有Al2O3
c.向Z中滴加几滴氯水,溶液变黄
(4)经测定W为单质,则铁矿废料中铁元素的质量分数为________。
3.某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。
⑴ m克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是
①常温下碳与浓硫酸不反应;② 。
⑵写出加热时A中碳与浓硫酸发生反应的化学方程式 。
⑶B中的现象是: ;C的作用是: 。
⑷待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为 (写表达式)。
⑸甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因:
。
⑹最后对所得测量结果进行评价,小组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低是(任答一条即可)
。
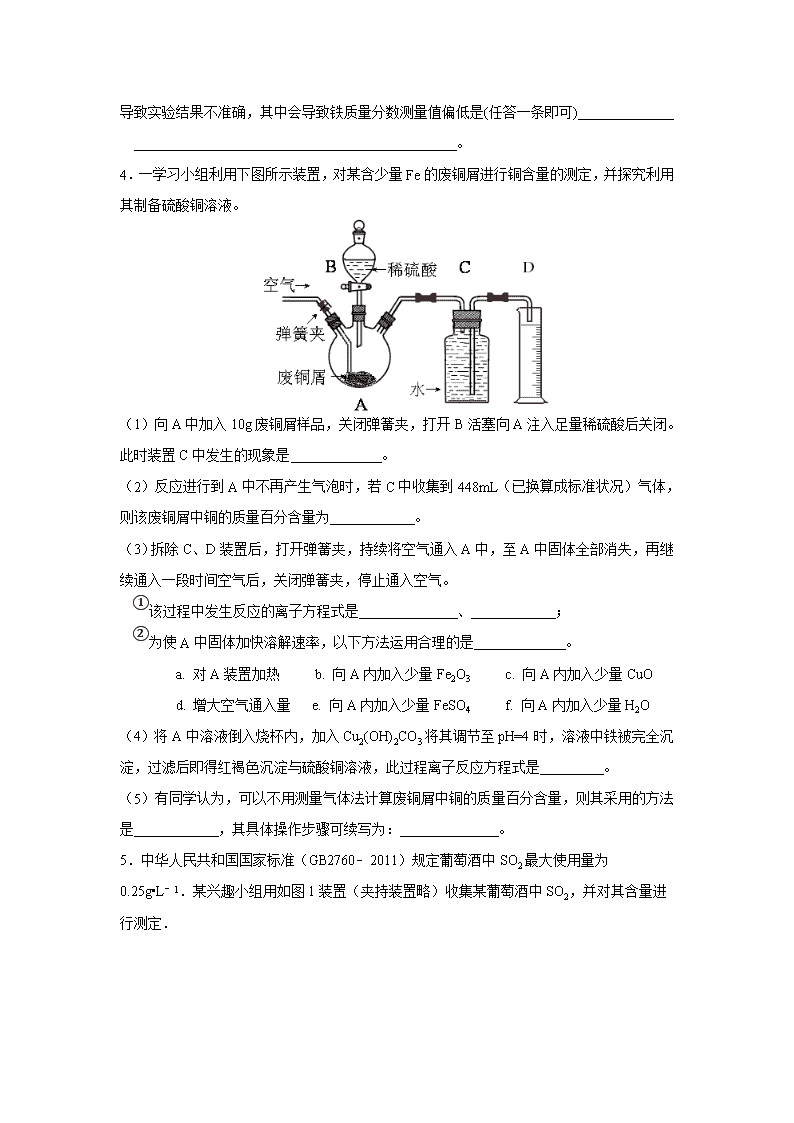
4.一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液。
(1)向A中加入10g废铜屑样品,关闭弹簧夹,打开B活塞向A注入足量稀硫酸后关闭。此时装置C中发生的现象是 。
(2)反应进行到A中不再产生气泡时,若C中收集到448mL(已换算成标准状况)气体,则该废铜屑中铜的质量百分含量为 。
(3)拆除C、D装置后,打开弹簧夹,持续将空气通入A中,至A中固体全部消失,再继续通入一段时间空气后,关闭弹簧夹,停止通入空气。
①该过程中发生反应的离子方程式是 、 ;
②为使A中固体加快溶解速率,以下方法运用合理的是 。
a. 对A装置加热 b. 向A内加入少量Fe2O3 c. 向A内加入少量CuO
d. 增大空气通入量 e. 向A内加入少量FeSO4 f. 向A内加入少量H2O
(4)将A中溶液倒入烧杯内,加入Cu2(OH)2CO3将其调节至pH=4时,溶液中铁被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液,此过程离子反应方程式是 。
(5)有同学认为,可以不用测量气体法计算废铜屑中铜的质量百分含量,则其采用的方法是 ,其具体操作步骤可续写为: 。
5.中华人民共和国国家标准(GB2760﹣2011)规定葡萄酒中SO2最大使用量为0.25g•L﹣1.某兴趣小组用如图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.
(1)仪器A的名称是 ,水通入A的进口为 .
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为 .
(3)除去C中过量的H2O2,然后用0.0900mol•L﹣1 NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的 ;若滴定终点时溶液的pH=8.8,则选择的指示剂为 ;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积 (填序号)(①=10mL,②=40mL,③<10mL,④>40mL)
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为 g•L﹣1
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施: .
6.某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去。
提供的试剂:研细的钙片粉末(钙片中的其他成分不与盐酸反应)、2mol/L 盐酸、5%NaOH溶液、饱和Na2CO3溶液、饱和NaHCO3溶液和蒸馏水。
图1 图2
实验过程:
I.检查两套装置的气密性。
II.在A、C的右边加入0.25 g钙片粉末,左边加入3 mL
2mol/L盐酸,塞紧塞子。在B、E中均加入饱和NaHCO3溶液,如图所示,记下量气管读数。
Ⅲ.将A、C倾斜,使液体与固体混合,实验结束并冷却后读出量气管读数,测得 B中收集到的气体为41.90 mL,E中收集到的气体体积为39.20 mL(以上气体体积均已折算为标准状况下的体积)。
回答下列问题:
(1)I中检查图1装置气密性的方法是 。
(2)A中发生反应的离子方程式为 ;D中加入的试剂为 。
(3)实验前左右两管液面在同一水平面上,最后读数时右管的液面高于左管的液面,
应进行的操作是 。
(4)图2实验所得钙片中的碳酸钙的质量分数为 ;图1实验比图2实验所得
钙片中的碳酸钙含量偏高,用离子方程式表示偏高的原因: 。
7.某食盐样品中混有NaBr杂质,为了测定该食盐样品的纯度,可设计实验过程如图1所示:
阅读上述实验过程,完成下列填空:
A
B
C
D
图2
(1)请你从图2中选用四个装置(可重复使用)来完成向溶液A中通入过量Cl2的实验,将所选装置的选项字母填入方框,并在括号中写出装置内所放的化学药品;
( )
(饱和食盐水)
(溶液 A )
( )
C
(2)为了证明溶液D中几乎不存在Br—,可选用的试剂为(多选不给分) (填选项字母);
A. 碘水 B. 淀粉碘化钾溶液 C. 新制氯水 D. 食盐水
图3
(3)依据图3所示,在萃取操作中应选取的有机溶剂为(多选不给分) ;
A.四氯化碳 B.甲苯 C.乙醇 D.裂化汽油
(4)在萃取、分液的过程中,把分液漏斗玻璃塞上的凹槽对准漏斗口上的小孔,其目的是 ;
如图3所示,待分液漏斗内的混合液分层后,应采取的操作是
;
(5)加热蒸发溶液D时,除需带有铁圈的铁架台、坩埚钳和火柴外,还必须用到的仪器有 、 、 ;
(6)试计算原固体混合物中氯化钠的质量分数为 。
8.实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuON2+3Cu+3H2O
试回答:
(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下列仪器设计一个简单的实验方案:
①仪器连接的顺序(用字母编号表示,仪器可重复使用) ;d中浓硫酸的作用是 , ;实验完毕时观察到a中的现象是 。
②列出计算Cu的相对原子质量的表达式 。
③下列情况将使测定结果偏大的是 。(以下选择填空不限1个正确答案,均用字母编号填写)
A.CuO未全部还原为Cu B.CuO受潮 C.CuO中混有Cu
(2)如果仍采用上述仪器装置,其他方案可选用测定的物理量有 。
A.m(Cu)和m(CuO) B.m(N2)和m(H2O)
C.m(Cu)和m(H2O) D.m(NH3)和m(H2O)
【答案与解析】
1. (1)分液漏斗、锥形瓶
(2) ① 按图组装仪器,并检查装置的气密性;
(3)
(4) 装置中残留有CO2,未被碱石灰吸收
(5)
选用的仪器
C
D
C
A
B
添加的药品
(必要的操作)
NaOH溶液
从e口鼓入空气
稀硫酸
样品溶液
浓硫酸
碱石灰
碱石灰
2.(1)过滤 (2)Fe+2H+==2Fe2++H2↑ 2Fe3++Fe==3Fe2+
(3)ac (4)11.2%
3.⑴ 常温下Fe遇浓硫酸发生钝化
⑵ C + 2H2SO4(浓) = CO2↑ + 2SO2↑ + 2H2O
⑶ 品红溶液褪色(或“颜色变浅”) 除尽反应产物中的SO2气体
⑷ (11m-3b)/11m
⑸ 装置内的CO2难以赶尽,导致E质量增重偏小
⑹ SO2不一定能全部被品红、KMnO4除去或E中碱石灰会吸收空气中的CO2、H2O(其它合理的也对)
4.(1)水面下降,水顺长导管排入D中
(2)88.8%
(3)①4Fe2+ + O2 + 4H+ = 4Fe3+ +2H2O
2Fe3+ + Cu = 2Fe2+ + Cu2+
②a b d e
(4)Cu2(OH)2CO3 + H+ + Fe3+ = 2Cu2+ + Fe(OH)3↓ + CO2↑
(5)测定沉淀法,将(4)中所得红褐色沉淀洗涤、干燥、称量、计算
5.(1)冷凝管或冷凝器;b;
(2)SO2+H2O2=H2SO4;
(3)③;酚酞;④;
(4)0.24;
(5)原因:盐酸的挥发;改进措施:用不挥发的强酸如硫酸代替盐酸(或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响).
【解析】(1)根据仪器A的构造可知,仪器A为冷凝管,冷凝管中通水方向采用逆向通水法,冷凝效果最佳,所以应该进水口为b;
(2)双氧水具有氧化性,能够将二氧化硫氧化成硫酸,反应的化学方程式为:SO2+H2O2=H2SO4;
(3)氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用③的方法;滴定终点时溶液的pH=8.8,应该选择酚酞做指示剂(酚酞的变色范围是8.2~10.0);若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,滴定管的0刻度在上方,10mL刻度线下方还有40mL有刻度的溶液,另外滴定管50mL刻度线下有液体,因此管内的液体体积>(50.00mL﹣10.00mL)=40.00mL,所以④正确;
(4)根据2NaOH~H2SO4~SO2可知SO2的质量为:×(0.0900mol/L×0.025L)×64g/mol=0.072g,该葡萄酒中的二氧化硫含量为:=0.24g/L;
(5)由于盐酸是挥发性酸,挥发的酸消耗氢氧化钠,使得消耗的氢氧化钠溶液体积增大,测定结果偏高;因此改进的措施为:用不挥发的强酸,如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响.
6.(1)往B中右侧量气管中加水,一段时间后量气装置左右液面差不变,说明气密性良好
(2)CaCO3 + 2H+ ==== Ca2+ + CO2↑ + H2O
蒸馏水(H2O)
(3)向下移动右管,使左右两管液面相平
(4)70%(或用小数、分数表示)
HCO3— + H+ ==== CO2↑ + H2O
(MnO2和浓HCl)
(饱和食盐水)
(溶液A)
(NaOH溶液)
(1)
7.
A
C
C
C
(2)C
(3)B
(4)使漏斗内外空气相通,以保证漏斗里的液体能够流出
打开活塞,使下层液体慢慢流出。注意不要使上层液体流出。上层液体从分液漏斗上口倒出
(5)蒸发皿、酒精灯、玻璃棒
(6)90.0%
8.(1)①bcacd;吸收未反应的NH3,防止空气中水蒸汽进入装置;a中的现象是固体由黑色转变为红色。
②[18m(CuO)/m(H2O)]-16。
③AC
(2)AC
【解析】(1)① 仪器连接顺序由实验目的决定。该实验主要是要测定NH3与CuO反应生成的水的质量(CuO的质量在实验前即可称出),故应先制备干燥的NH3(用碱石灰干燥,不用浓H2SO4,因为浓H2SO4会与NH3反应),然后让NH3与CuO反应,再测定生成水的质量(用碱石灰吸收反应后生成的水蒸汽,不能用浓H2SO4吸收,因NH3不一定反应完)。另外为了吸收多余的NH3,同时也为了防止空气中的水蒸汽造成实验误差,最后应接d装置。故仪器的连接顺序为bcacd。d中浓H2SO4的作用是吸收未反应的NH3,防止空气中水蒸汽进入装置。实验完毕后观察到a中的现象是固体由黑色转变为红色。
②根据化学方程式可计算出Cu的相对原子质量的表达式为[18m(CuO)/m(H2O)]-16。
③根据Cu的相对原子质量的表达式可知,要使测定结果偏大,则m(CuO)要偏大,m(H2O) 要偏小。由给出的选项看,A、C生成的水少,测定结果偏大;B生成的水多,测定结果偏小。故本小题答案为A、C。
(2)如果仍采用上述仪器装置,由于气体的质量难以测量,也难于收集,所以B、D不可选用,且由B、D给出的量无法计算出Cu的相对原子质量。可供选用测定的物理量还有Cu的质量,结合CuO的质量或H2O的质量都能计算出Cu的相对原子质量。故答案为AC。