- 7.88 MB
- 2021-04-21 发布
课 题
1
常 见 的 酸 和 碱
课题
1
常见的酸和碱
课 题
1
常 见 的 酸 和 碱
酸、甜、苦、辣
是我们生活中的味道,请问你们还知道哪些是具有酸味的物质吗?
这些物质中有很多存在一种很重要的物质:酸,
同时自然界还存在另一种物质:碱。
通过回忆说出你判断酸碱的方法?
1
、把二氧化碳通入
紫色石蕊
的试管中会看到什么现象?该现象说明了什么?
2
、在右图的实验中,可以看到什么 现象?这说明
酚酞试液
有什么性质?
紫色石蕊
遇碳酸
变红色
无色酚酞
遇浓氨水
变红色
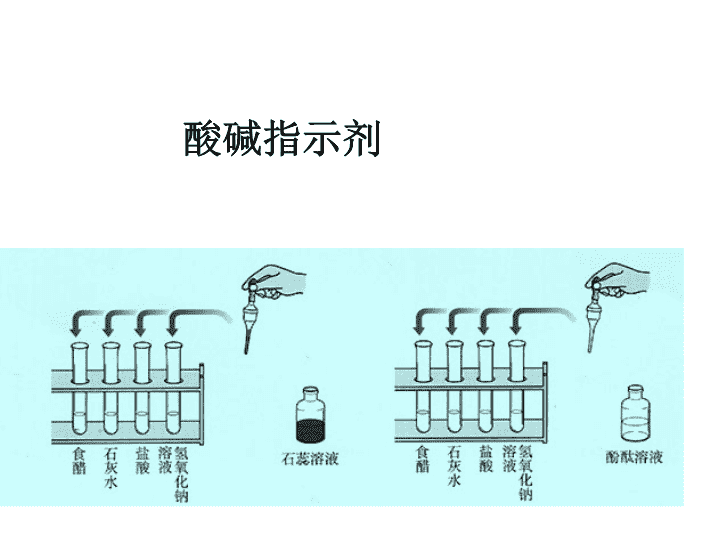
酸碱指示剂
课 题
1
常 见 的 酸 和 碱
[
实验
10-1]
加入紫色石蕊溶液后
的颜色变化
加入无色酚酞溶液后
的颜色变化
食 醋
石灰水
盐 酸
NaOH
溶液
变红色
变蓝色
变红色
变红色
变红色
变蓝色
不变色
不变色
结论:
1
、紫色石蕊溶液遇酸溶液变成红色,
遇碱溶液变成蓝色(即酸红碱蓝)
2
、酚酞遇酸溶液不变色
,
遇碱溶液变红色
指示剂
酸性溶液中的
颜色变化
中性溶液
中的颜色
碱性溶液中的
颜色变化
石蕊试液
酚酞试液
指示剂在不同溶液中的变色情况
无 色
无 色
变红色
变蓝色
变红色
紫 色
酸溶液 酸性溶液
?
NH
4
NO
3
溶液
Na
2
CO
3
溶液
酸溶液
酸性溶液
归 纳 与 分 析
课 题
1
常 见 的 酸 和 碱
1
、酸碱指示剂(指示剂)的概念
跟酸或碱的溶液起作用而显示
不同颜色
的物质。
2
、常用指示剂:
紫色石蕊溶液
和无色酚酞溶液
3
、变色规律
:
紫色石蕊溶液
遇酸溶液变成
红色
,遇碱溶液变成
蓝色
(即
酸红
碱蓝
)
无色酚酞溶液遇酸溶液不变色,遇碱溶液变成
红色
。
4
、指示剂的作用
:
能检验溶液的
酸碱性
5
、如何用酸碱指示剂检验溶液的酸碱性?
若溶液呈现红色,则说明该溶液为酸性溶液。
1
、取少量该溶液
2
、滴入几滴
石蕊
试液
若溶液呈现蓝色,则说明该溶液为碱性溶液。
课 题
1
常 见 的 酸 和 碱
讨论
:根据实验
10-1
的现象,试分析这
4
种物质中,哪些可能是酸溶液,哪些可能是碱溶液? 酸溶液: 碱溶液:
食醋、盐酸
石灰水、氢氧化钠溶液
练习
:有三瓶标签已失落的无色液体,它们分别是硫酸溶液、氢氧化钠溶液和蒸馏水,如何鉴别它们?
1
、用试管分别取三种溶液少量并编号(
A
、
B
、
C
);
现象:
结论:
2
、分别滴入几滴紫色石蕊试液,观察颜色变化。
步骤:
A
为
蓝色
,
B
没有变化,
C
为
红色
A
为氢氧化钠溶液,
B
为蒸馏水,
C
为硫酸溶液
课 题
1
常 见 的 酸 和 碱
指示剂
(汁液)
在不同溶液中的颜色变化
食 醋
石灰水
盐 酸
氢氧化钠
牵牛花
红色
蓝色
红色
蓝色
月季花
红色
草绿色
红色
草绿色
紫卷心菜
红色
绿色
红色
绿色
万寿菊
黄色
黄色
黄色
黄色
活动与探究步骤:
1
、取一种花(
月季花
)的花瓣,在研钵中捣烂,加入酒精(乙醇与水的体积比为
1∶1
)浸泡;
2
、用纱布将浸泡出的汁液过滤或挤出,得到指示剂;
3
、试验指示剂在上述
4
种溶液中和颜色变化;
4
、根据在溶液中的颜色变化是否明显来判断,能否作为指示剂使用。
课 题
1
常 见 的 酸 和 碱
许多植物的果实和花瓣中含有色素。现提取几种植物的果实或花瓣的汁液,用稀酸、稀碱和水逐一检验,现象记录如下表。
汁液
酸溶液
水
碱溶液
牵牛花
红色
紫色
蓝色
万寿菊
黄色
黄色
黄色
胡萝卜
橙色
橙色
橙色
玫瑰
浅红色
浅红色
绿色
(2)
手工制作一朵纸玫瑰花,用
pH=12
的某种溶液浸泡后晾干,用所提取的玫瑰的汁液均匀的涂在纸玫瑰花上,纸花会变成
色。
(3)
与实验中常用的指示剂石蕊的变色原理相似的是
(
填植物的名称
)
(1)
上述植物的汁液不能用来区别稀硫酸和氢氧化钠溶液的是
、
。
(
填植物的名称
)
万寿菊 胡萝卜
绿
牵牛花
【
实验
】
如图所示,分别试验盐酸、硫酸、氢氧化钠溶液、氢氧化钙溶液、蒸馏水和乙醇的导电性。
能导电的溶液有
(
灯亮
)
不能导电的溶液有
(
灯不亮
)
盐酸
硫酸
氢氧化钠溶液
氢氧化钙溶液
蒸馏水
乙醇
HCl = H
+
+ Cl
-
H
2
SO
4
=2H
+
+SO
4
2-
酸
=H
+
+
酸根离子
NaOH = Na
+
+ OH
-
Ca(OH)
2
=Ca
2+
+2OH
-
碱
=
金属离子
+OH
-
在不同的酸溶液中都含有相同的
H
+
,所以酸有一些相似的性质。
在不同的碱溶液中都含有相同的
OH
—
,所以,碱也有一些相似的性质。
课 题
1
常 见 的 酸 和 碱
为什么不同的酸都能使紫色石蕊溶液变红色、无色酚酞溶液不变色?为什么不同的碱都能使紫色石蕊溶液变蓝色、无色酚酞溶液变红色?你知道其中的原因吗?
导电的物质:
盐酸、硫酸、氢氧化钠溶液、氢氧化钙溶液
说明上述四种溶液中存在着自由移动的粒子。
H
Cl =
H
+
+ Cl
-
H
2
SO
4
=
2H
+
+ SO
4
2-
Na
OH
= Na
+
+
OH
-
Ca(
OH
)
2
= Ca
2+
+
2OH
-
酸在溶液中能离解出
H
+
和酸根离子
。在不同的酸溶液中都含有
H
+
。
碱在溶液中能离解出
OH
-
和金属离子
。在不同的碱溶液中都含有
OH
-
。
酸
(
H
+
酸根
)
名称:某酸;
化学式:
H
排头
(H
2
O
、
H
2
O
2
)
碱
(
金属
+
OH
)
名称:氢氧化某;
化学式:
OH
断后(
C
2
H
5
OH
)
1.
常见的酸有盐酸(
HCl
)、硫酸
(
H
2
SO
4
)
、碳酸(
H
2
CO
3
)、醋酸(
CH
3
COOH
)等。从名称上判断最后一个字都是“酸”,即“某酸”;从结构上看都含有氢元素。
2 .
常见的碱有氢氧化钠(
NaOH
)、氢氧化钙
(Ca(OH)
2
)
、氢氧化铝
(Al(OH)
3
)
、一水合氨(
NH3.H2O
)等。除一水合氨,从名称上看都叫“氢氧化某”;从结构上看都含有氢氧根(
OH
)。
根据实验现象完成表格
浓盐酸
浓硫酸
颜色、状态
打开瓶盖后的现象
气味
无色、液体
无色、粘稠油状液体
无味
瓶口有白雾产生
无明显现象
(
难挥发
)
原因
:
浓盐酸挥发出
HCl
气体与空气中水蒸气结合形成盐酸的小液滴。
说明盐酸易挥发
有刺激性气味
1.
如何区分浓盐酸和浓硫酸
浓盐酸
特性
:
挥发性
2.
分别盛放浓盐酸和浓硫酸的两个试剂瓶,敞口放置一段时间后(不考虑水分的蒸发),两瓶酸的质量、质量分数各有何变化?
溶质质量
溶剂质量
溶质质量分数
浓盐酸
浓硫酸
减少
减小
增加
减小
不变
不变
密封保存
应如何保存?
3
、浓硫酸的特性:
(做干燥剂:不能干燥
NH
3
)
(脱水性)
(
2
)腐蚀性:
(
1
)吸水性:
原因
:
浓硫酸可以夺取纸张、木材、布料、皮肤里的水分(脱去
H
、
O
两种元素结合成水),生成黑色的炭。
(炭化)
(物理性质)
(化学性质)
浓硫酸
特性
1
:
吸水性
用途:
做某些气体的干燥剂
——
酸性干燥剂
通入液面下
H
2
、
H
2
O
H
2
哪些气体能用
浓硫酸
来干燥?哪些不能用?
注意:长管进,短管出
(长进短出)
洗气瓶
能干燥
不能干燥:
碱性气体:
NH
3
中性气体:
H
2
、
O
2
酸性气体:
CO
2
、
SO
2
、
HCl
4
、浓硫酸的稀释:
一定要把
浓硫酸
沿着烧杯的内壁慢慢注入
水
中,并用
玻璃棒
不断搅拌。
切不可将水倒入浓硫酸中
。
2.
盐酸和硫酸的用途:
用 途
盐
酸
重要化工产品。用于金属表面除锈、制药等;人体胃液中含有盐酸,可帮助消化。
硫
酸
重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、冶炼石油和金属除锈等。
浓硫酸有吸水性,在实验室中常用它做干燥剂
(如
CO2
、
H2
、
O2
等)
但不能用来干燥氨气
。
思考
1:
如果不慎将浓硫酸沾到皮肤或衣服上,应怎样处理呢
?
思考
2
:
如果将稀硫酸沾到皮肤或衣服上,是否也要进行这样的处理?为什么?
立即用大量水冲洗,然后涂上
3%
~
5%
的碳酸氢钠溶液
。
浓盐酸
浓硫酸
性质
①
纯净的浓盐酸是无色、有
刺激性气味、有酸味的液体;
②有强腐蚀性;③易挥发,
打开瓶口有白雾
①
无色无味油状的液体;②
有强腐蚀性;③吸水性,可
作干燥剂;④脱水性
保存
因具有挥发性,需密封保存
因具有吸水性,需密封保存
[
典例
]
(
双选
)
下列说法错误的是
( )
A
.浓盐酸和浓硫酸都应密封保存,因为它们都有挥发性
B
.人的胃液中含有少量盐酸,可以促进食欲,帮助消化
C
.浓盐酸和浓硝酸打开瓶口都有白雾
D
.稀释浓硫酸时,应用玻璃棒引流将浓硫酸慢慢注入水中,
并不断搅拌
酸的化学性质
盐酸
(HCl)
稀硫酸
(H
2
SO
4
)
与指示剂反应
紫色石蕊变
________
,酚酞
________
与金属单
质反应
(
镁、锌、铁
)
Mg
+
2HCl===MgCl
2
+
H
2
↑
;
________________________
;
_________________________
Mg
+
H
2
SO
4
===MgSO
4
+
H
2
↑
;
_________________________
;
__________________________
现象
有
________
冒出,固体
________
,溶液
________
与金属氧化物
反应
_________________________
__________________________
现象
固体
________
,溶液
________________
Fe
2
O
3
+
6HCl===2FeCl
3
+
3H
2
O
Fe
2
O
3
+
3H
2
SO
4
===Fe
2
(SO
4
)
3
+
3H
2
O
溶解
由无色变为黄色
1
.
石蕊遇酸变
__
______
,酚酞遇酸
________
。
2
.
金属单质+酸
===__
______
+
________(
金属的活泼性在
H
前面
)
3
.
金属氧化物+酸
==
= ________
+
________(
各元素化合价
反应前后无变化
)
。
常见的碱
1
.几种常见的碱
(一)、氢氧化钠
(NaOH)
实验
现象
分析
观察氢氧化钠的颜色和状态
将氢氧化钠放在表面皿上,放置一会儿
将氢氧化钠放入盛有少量水的试管里,并用手触摸试管外壁
白色、固体
表面潮湿、溶解
吸收水份而潮解
感到较热
溶于水放出大量热
讨论:
氢氧化钠应如何保存?为什么?
①
物理性质:
氢氧化钠是白色固体,易溶于水,并放出大量热。
氢氧化钠在空气中易潮解
——
可作某些气体的干燥剂
。
(是一种固态干燥剂),装置如图所示:
②
腐蚀性:
氢氧化钠有强烈的
腐蚀性,
所以,它的俗名叫做
苛性钠
、
火碱
或
烧碱
。
如果不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。
小结:
注意!
在使用氢氧化钠时必须十分小心,防止眼睛、皮肤、衣服被它腐蚀。实验时最好戴防护眼镜。
③
用途:
氢氧化钠是一种重要的化工原料,广泛应用于肥皂、石油、造纸、纺织和印染等工业。氢氧化钠能与油脂反应,在生活中可以用来去除油污,如炉具清洁剂中就含有氢氧化钠。
(二)、氢氧化钙
[Ca(OH)
2
]
检验二氧化碳用的是什么试剂呢?
石灰水,它就是氢氧化钙的水溶液。
它可由生石灰
(CaO)
与水反应得到:
CaO + H
2
O = Ca(OH)
2
反应中放出大量热。
[
小结
]
:
Ca(OH)
2
是一种白色粉末,俗称熟石、消石灰,微溶于水,其水溶液俗称为石灰水,有腐蚀性和涩味。
氢氧化钙的制取:
故:
CaO
可作干燥剂(是一种常见的食品干燥剂)
蓝色
蓝色
红色
红色
碱的化学性质
⑴
碱与指示剂反应:
滴入紫色
石蕊
溶液后
滴入无色
酚酞
溶液后
氢氧化钠
溶液
氢氧化钙
溶液
碱
溶液
能使紫色石蕊溶液变
蓝色
;
能使无色酚酞溶液变
红色
。
注:
不溶性碱不能形成溶液,故不能使指示剂变色。
[
讨论
]
:
氢氧化钠溶液中能使指示剂变色,是什么粒子改变了指示剂的颜色?请提出你的猜想,并设计实验来验证你的猜想。
假设猜想:
猜想一:使酚酞变红的可能是
NaOH
溶液中的
水分子
;
猜想二:使酚酞变红的可能是
NaOH
溶液中的
;
猜想三:使酚酞变红的可能是
NaOH
溶液中的
;
设计实验:
1
、取
2mL
蒸馏水,滴入几滴酚酞溶液。现象:溶液呈无色。说明猜
想
不正确;
2
、取
2mL
氯化钠,滴入几滴酚酞溶液。现象:溶液呈无色。说明猜
想
不正确;
实验结论:
NaOH
溶液中滴入
使酚酞溶液变红,说明使酚酞变红的粒
子是
。
反思:
有人认为实验
1
不必做,理由是:
钠离子
氢氧根离子
一
二
氢氧根离子
实验
2
中氯化钠溶液中有水,若呈无色,可说明猜想一不正确。
⑵
Ca(OH)
2
+CO
2
= CaCO
3
↓+H
2
O
①
回忆:二氧化碳使澄清石灰水变浑浊
②
氢氧化钠在空气中不仅吸收水分而潮解,还会与空气中的二氧化碳发生反应而变质:
2NaOH+CO
2
= Na
2
CO
3
+H
2
O
应用:
氢氧化钙能与空气中的二氧化碳反应,生成坚硬的碳酸钙。将氢氧化钙粘土和沙子混凝,用来做建筑材料,就是利用氢氧化钙的这一性质
。
所以,氢氧化钠必须密封保存。
讨论:上面两个反应有什么共同之处?三氧化硫、二氧化硫与碱的反应与上面的两个反应类似,试写出有关反应的化学方程式及应用:
_________________________________
碱与某些非金属氧化物反应生成盐和水
2NaOH+SO
3
= Na
2
SO
4
+H
2
O
Ca(OH)
2
+SO
2
= CaSO
3
+H
2
O
用
NaOH
、
Ca(OH)
2
可用来除去工业废气中的
SO
2
、
SO
3
想想:如何检验是否变质?
[
讨论
]
:
怎样来设计实验来证明氢氧化钠和二氧化碳能之间发生了反应呢?
[
实验方案
]
:
盛氢氧化钠溶液 红墨水
(
1
): (
2
):
装
CO
2
水
NaOH+CO
2
(
3
):在反应后的剩余物质中加入稀盐酸,看有无汽泡产生(对生成物进行检验)。
[
想一想
]
:上述实验方案是根据什么原理来验证明了它们之间发生了反应的?
实验
1
、
2
是利用在密闭容器内二氧化碳与氢氧化钠反应后,容器内的气压减小,使外界气压大于容器内的气压,从而产生一些现象。实验
3
是通过对生成物的检验来证明是否发生反应。
小结:
碱的化学性质
1
,碱溶液能使紫色石蕊试液变蓝,使无色酚酞试液 变红。
2
,碱
+
某些非金属氧化物
——
化合物
+
水
1
.鉴别石灰水和氢氧化钠溶液可选用的试剂是
(
)
A
、酚酞溶液
B
、二氧化碳
C
、
CuO D
、稀盐酸
2
.纯净的氢氧化钠是一种
_______
色固体,由于在空气里它不仅能吸收
_______
而潮解,还能跟空气里的
___________
起反应而变质。所以,氢氧化钠必须
________
保存。写出有关反应的化学方程式:
______________________________
。
向
变质的氢氧化钠
中加入足量的盐酸,可观察到的现象是
______________________
,写出所发生反应的化学方程式:
_______________________________
_____________________________
。
生石灰变质分析
①取固体溶于水,有放热现象,溶液变浑浊,
则固体中含有
②向①中混合液中滴加稀盐酸,若有气体产生,固体中含有
结论:固体中一定有 可能含有
2. ①
取固体溶于水,没有放热现象,则固体中没有
②取①中混合液滴加酚酞,若溶液变红,则固体中含有
③向②中反应液滴加稀盐酸,有气泡产生,则固体中含有
结论:固体中一定含有
一定没有
CaO
CaCO
3
CaO
Ca(OH)
2
CaCO
3
CaO
、
CaCO
3
Ca(OH)
2
Ca(OH)
2
、
CaCO
3
CaO
3.
某同学取生石灰样品,加水,再滴加无色酚酞,变红色,该同学得出:样品中一定含有
Ca(OH)
2
,该说法是否正确,为什么?
不正确。生石灰和水反应会生成
Ca(OH)
2
,也能使无色酚酞变红
相关文档
- 中考年化学考点跟踪:第17讲 常见的2021-04-21 18:36:174页
- 人教版化学九下《常见的酸和碱(二)》2021-04-20 22:30:251页
- 2019九年级化学全册 第二单元 常见2021-04-20 17:07:553页
- 河北中考化学复习主题一身边的化学2021-04-20 03:09:266页
- 中考化学5常见的酸和碱一轮复习题2021-04-19 18:49:068页
- 常见的酸和碱 教案22021-04-17 13:42:449页
- 包头专版2020中考化学复习方案第102021-04-17 13:04:0422页
- 新课标RJ2020中考化学复习方案主题2021-04-17 12:41:2112页
- 常见的酸和碱学案22021-04-16 17:19:434页
- 九年级化学下册第十单元酸和碱课题2021-04-16 15:46:176页