- 796.50 KB
- 2021-04-21 发布
富集在海水中的元素——卤素
考点一 氯及其化合物的性质和应用
【基础知识梳理】
1.氯气的物理性质
颜色
状态
气味
密度
毒性
溶解性
黄绿色
气体
比空气大
有毒
1体积水溶解
约2体积Cl2
2.从氯的原子结构认识氯气的化学性质——氧化性
(1)与金属反应:与变价金属反应生成高价金属氯化物。
①与铁反应:___________________________________________________________。
②与铜反应:Cu+Cl2CuCl2。
(2)与非金属反应
与H2反应:H2+Cl22HCl。
(3)与还原性无机化合物反应:
①与碘化钾溶液反应:________________________________________________________。
②与SO2水溶液反应:________________________________________________________。
③与FeCl2溶液反应:_________________________________________________________。
3.从化合价的角度认识Cl2的化学性质——歧化反应
氯气与水或碱反应,氯的化合价既有升高又有降低,因而氯气既表现氧化性又表现还原性。
(1)与水反应
氯气与水反应的化学方程式:___________________________________________________。
(2)与碱反应(完成下列反应的化学方程式)
①与烧碱反应:_______________________________________________________________。
②制取漂白粉:_______________________________________________________________
_____________________________________________________________________________。
漂白粉的主要成分是________________,有效成分是____________。
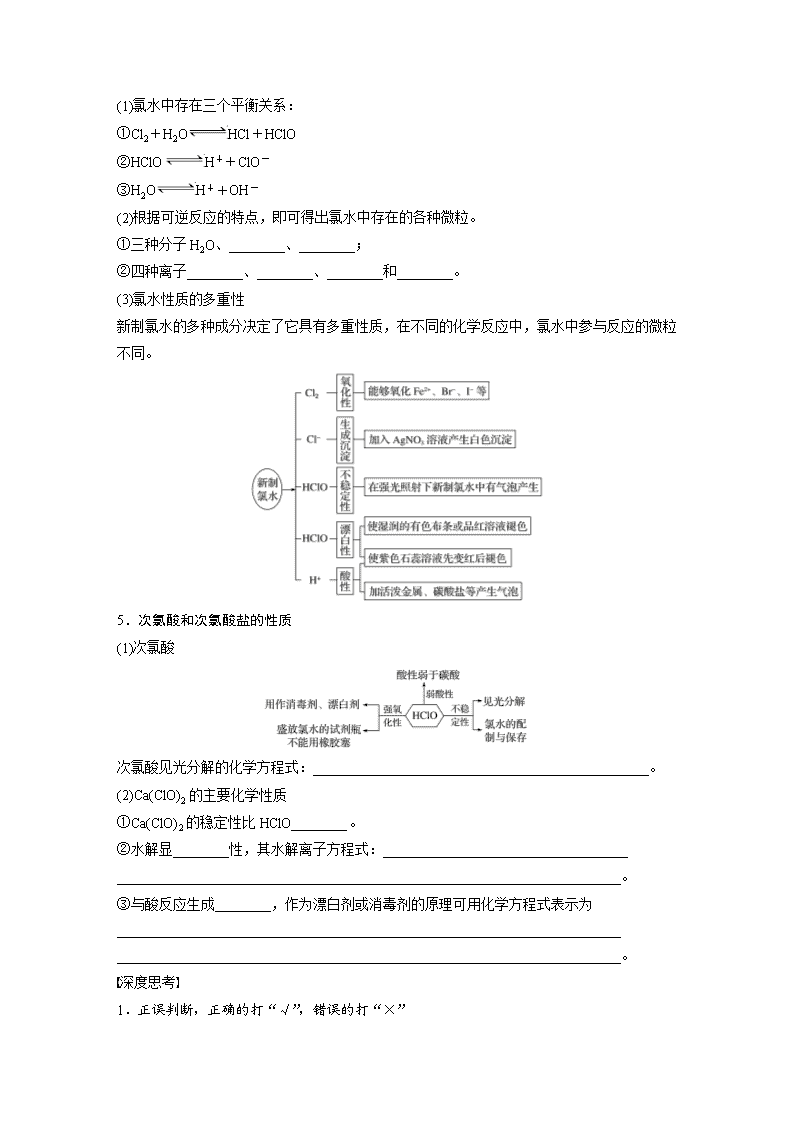
4.从平衡的角度理解氯水的成分和性质
(1)氯水中存在三个平衡关系:
①Cl2+H2OHCl+HClO
②HClOH++ClO-
③H2OH++OH-
(2)根据可逆反应的特点,即可得出氯水中存在的各种微粒。
①三种分子H2O、________、________;
②四种离子________、________、________和________。
(3)氯水性质的多重性
新制氯水的多种成分决定了它具有多重性质,在不同的化学反应中,氯水中参与反应的微粒不同。
5.次氯酸和次氯酸盐的性质
(1)次氯酸
次氯酸见光分解的化学方程式:________________________________________________。
(2)Ca(ClO)2的主要化学性质
①Ca(ClO)2的稳定性比HClO________。
②水解显________性,其水解离子方程式:___________________________________
________________________________________________________________________。
③与酸反应生成________,作为漂白剂或消毒剂的原理可用化学方程式表示为
________________________________________________________________________
________________________________________________________________________。
深度思考
1.正误判断,正确的打“√”,错误的打“×”
(1)过量的铁粉在少量氯气中加热,充分反应后产物为FeCl2( )
(2)氯气溶于水得氯水,溶液呈酸性且可以导电,所以氯气是电解质( )
(3)新制氯水必须用棕色瓶密封保存,光照氯水有气泡逸出,该气体是氯气( )
(4)新制取的漂白粉是混合物( )
(5)氯气可以使湿润的有色布条褪色,但是实际起漂白作用的物质是次氯酸,而不是氯气( )
(6)Cl2具有很强的氧化性,在化学反应中只能作氧化剂( )
2.久置的氯水和新制氯水在性质上有哪些不同?
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
3.在空气中长时间放置的漂白粉,最终得到的主要固体物质是什么?用方程式表示漂白粉在空气中久置变质的过程。
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
【解题探究】
题组一 氯气和氯水的性质
1.向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如图所示,则甲、乙、丙中注入的液体分别是( )
①AgNO3溶液 ②NaOH溶液 ③水
A.①②③ B.②①③ C.③②① D.①③②
2.氯水中存在多种分子和离子,它们在不同的反应中表现出不同的性质。下列结论正确的是( )
A.加入有色布条,片刻后有色布条褪色,说明有Cl2存在
B.溶液呈浅黄绿色,且有刺激性气味,说明有Cl2存在
C.先加入盐酸酸化,再加入AgNO3溶液,生成白色沉淀,说明有Cl-存在
D.加入NaOH溶液,氯水的浅黄绿色消失,说明有HClO存在
题组二 从平衡移动的角度分析氯水中的变化
3.在新制饱和氯水中,若只改变某一条件,下列叙述正确的是( )
A.再通入少量氯气,减小
B.通入少量SO2,溶液漂白性增强
C.加入少量的碳酸钠粉末,pH增大,溶液漂白性增强
D.光照过程中,有气泡冒出,溶液的导电性减弱
4.氯气对水杀菌消毒体系中起杀菌作用的主要是HClO。25 ℃时氯气-氯水体系中存在以下平衡关系:
①Cl2(g)Cl2(aq) K1=10-1.2
②Cl2(aq)+H2OHClO+H++Cl- K2=10-3.4
25 ℃时,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1 mol·L-1的NaOH溶液,溶液pH变化的曲线如图所示。下列叙述正确的是( )
A.用氯气对水杀菌消毒,夏季要比冬季好
B.Cl2(g)+H2OHClO+H++Cl- K=10-4.6
C.图中①→②的变化,两个平衡均向右移动,Cl2(aq)的浓度减小,HClO浓度增大
D.图中点③所示溶液中饱和氯水恰好与NaOH反应,溶质只有NaCl和NaClO
【反思归纳】
氯水中平衡移动的应用
向氯水中加入的物质
浓度变化
平衡移动的方向
应用
可溶性氯化物
c(Cl-)增大
左移
①用饱和食盐水除Cl2中的HCl
②用排饱和食盐水法收集Cl2
盐酸
c(H+)和
c(Cl-)增大
左移
次氯酸盐与浓盐酸反应制Cl2
NaOH
c(H+)减小
右移
用NaOH溶液吸收多余Cl2
Ca(OH)2
c(H+)减小
右移
制漂白粉
CaCO3
c(H+)减小
右移
制高浓度的HClO溶液
光照
c(HClO)减小
右移
氯水避光保存或现用现配
题组三 次氯酸盐和其他含氯消毒剂
5.某消毒液的主要成分为NaClO,还含有一定量的NaOH。下列用来解释事实的方程式中,不合理的是(已知:饱和NaClO溶液的pH约为11)( )
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-===ClO-+Cl-+H2O
B.该消毒液的pH约为12:ClO-+H2OHClO+OH-
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生有毒Cl2:2H++Cl-+ClO-===Cl2↑+H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-===HClO+CH3COO-
6.氯胺是一种长效缓释有机氯消毒剂,有强氧化性,其杀菌能力是一般含氯消毒剂的4倍~5倍,下列有关氯胺(NH2Cl)的说法一定不正确的是( )
A.氯胺的水解产物为NH2OH(羟氨)和HCl
B.氯胺的电子式为
C.氯胺中氯的化合价为+1
D.氯胺的消毒原理与漂白粉相似
7.二氧化氯(ClO2)是一种黄绿色易溶于水的气体,常用于饮用水消毒。下列有关ClO2制备与杀菌的说法不合理的是( )
A.NaClO2在酸性条件下歧化生成ClO2和NaCl,则n(氧化剂)∶n(还原剂)=1∶4
B.ClO2在强碱性环境中使用失效,可能的原因是2ClO2+2OH-===ClO+ClO+H2O
C.可用饱和食盐水除去ClO2中的NH3
D.等物质的量的ClO2杀菌效果比Cl2强
【归纳总结】
含氯消毒剂的共同特点是利用本身的强氧化性,或与水反应产生HClO,杀灭具有生命活性的微生物。解答这类题目,一般要从氧化性,得电子数目以及平衡移动等角度分析思考。
考点二 氯气的实验室制法
【基础知识梳理】
氯气是一种性质活泼的气体,以氯气的实验室制备、性质实验为素材的实验题目在高考实验类试题中占有很重要的位置,复习中应高度重视。
深度思考
1.正误判断,正确的打“√”,错误的打“×”
(1)MnO2与浓盐酸反应制Cl2的离子方程式:MnO2+4HClMn2++2Cl-+Cl2↑+2H2O( )
(2)除去Cl2中少量HCl气体,可用饱和食盐水,也可用饱和碳酸氢钠溶液( )
(3)检验氯气可用湿润的淀粉碘化钾试纸( )
(4)氯气在饱和食盐水中的溶解度小于在纯水中的溶解度( )
(5)实验室快速制取氯气可以采用高锰酸钾与浓盐酸的反应( )
(6)用NaOH溶液吸收多余的Cl2时,为防止倒吸,导气管不能伸到液面以下( )
2.含0.4 mol HCl的浓盐酸与足量的MnO2共热,能否得到0.1 mol Cl2?为什么?
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
3.下图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。
思考装置B、C、D的作用分别是:
B________________________________________________________________________;
C________________________________________________________________________;
D________________________________________________________________________。
【解题探究】
题组一 氯气制备与性质实验
1.实验室用MnO2和浓盐酸制Cl2时,有如下操作:①连好装置,检查气密性;②缓缓加热;③加入MnO2粉末;④从装有浓盐酸的分液漏斗中加入浓盐酸;⑤将多余氯气用NaOH溶液吸收;⑥用向上排气收集氯气。顺序正确的是( )
A.①②③④⑥⑤ B.③④②①⑥⑤
C.①④③②⑥⑤ D.①③④②⑥⑤
2.某同学用下列装置制备并检验Cl2的性质。
下列说法正确的是( )
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部被消耗
B.Ⅱ图中:量筒中发生了加成反应
C.Ⅲ图中:发生的反应不是燃烧反应
D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
【归纳总结】
实验室用MnO2和浓盐酸制取Cl2时应注意以下四点
(1)为了减少制得的Cl2中HCl的含量,加热温度不宜过高,以减少HCl的挥发。
(2)因Cl-浓度越小,其还原性越弱,所以必须用浓盐酸加热才可反应,稀盐酸不反应。
(3)实验结束后,先使反应停止并排出残留的Cl2后,再拆卸装置,避免污染空气。
(4)尾气吸收时,用NaOH溶液吸收Cl2,不能用澄清石灰水吸收,因为溶液中含Ca(OH)2的量少,吸收不完全。
题组二 氯化物的制取
3.二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到信息:①将干燥的氯气在110~140 ℃与硫反应,即可得S2Cl2粗品。②有关物质的部分性质如下表:
物质
熔点/℃
沸点/℃
化学性质
S
112.8
444.6
略
S2Cl2
-77
137
遇水生成HCl、SO2、S;300 ℃以上完全分解:S2Cl2+Cl22SCl2
设计实验装置图如下:
(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见
________________________________________________________________________
________________________________________________________________________,
利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式_________________________________________________
________________________________________________________________________;
E中反应的化学方程式____________________________________________________。
(3)C、D中的试剂分别是____________、____________________________________。
(4)仪器A、B的名称是________、________,F的作用是______________。
(5)如果在加热E时温度过高,对实验结果的影响是____________,在F中可能出现的现象是
________________________________________________________________________。
(6)S2Cl2粗品中可能混有的杂质是________、________(填两种),为了提高S2Cl2的纯度,关键的操作是控制好温度和_______________________________________________________。
(7)装置H中盛有NaOH溶液,其作用是__________________________________________,
发生反应的化学方程式为_______________________________________________________。
【反思归纳】
许多金属氯化物如FeCl3、AlCl3,非金属氯化物,如PCl3、SiCl4、S2Cl2都易水解。涉及此类物质的制备问题,除了要重视Cl2制备、净化、尾气处理,还要考虑产品的纯度,防水解等措施。
考点三 卤素的性质及X-的检验
【基础知识梳理】
1.溴、碘单质物理性质比较
性质
Br2
I2
颜色
深红棕色
紫黑色
状态
液体
溶解性
水中
溶解度不大
溶解度不大
有机溶剂中
易溶
特性
易______、有毒
①易______
②使淀粉溶液变______
2.氯、溴、碘单质化学性质比较
(1)与碱溶液反应,如与NaOH溶液反应的化学方程式为
________________________________________________________________________(X=Cl、Br、I)。
(2)氧化性
①都能与金属反应生成金属卤化物,如与钠反应的化学方程式为_____________________(X=Cl、Br、I)。
②氯、溴、碘单质的氧化性强弱是Cl2______Br2______I2,阴离子的还原性:Cl-______Br-______I-。
Cl2能从Br-的溶液中置换出Br2,其离子方程式:
_______________________________________________________;同理,Br2能置换出I2,
其离子方程式:_______________________________________________________________。
③与一些还原性离子反应,如Br2与SO、Fe2+反应的离子方程式分别为
________________________________________________________________________
________________________________________________________________________。
3.卤素离子的检验方法
(1)AgNO3溶液——沉淀法
(2)置换——萃取法
未知液
有机层呈
(3)氧化——淀粉法检验I-
未知液 ______色溶液,表明有I-
深度思考
1.正误判断,正确的打“√”,错误的打“×”
(1)海水提溴的过程中不发生氧化还原反应( )
(2)可以用淀粉溶液检验加碘食盐中的KIO3( )
(3)用CCl4萃取碘水中的碘,先振荡,后静置,液体分层,下层呈无色( )
(4)碘易升华,可用加热升华法除去NH4Cl中混有的I2( )
(5)实验室保存少量液溴时常加少量水液封,并用玻璃塞密封,不能用橡胶塞( )
(6)类比Fe与Cl2反应,可知Fe与I2反应产物为FeI3( )
(7)I-可使淀粉溶液变蓝( )
2.溴水是中学化学中常用的试剂,请思考总结中学化学实验中有哪些使溴水褪色的情况?
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
【解题探究】
题组一 卤素的性质
1.已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部分颜色描述正确的是( )
选项
①
②
③
④
A
黄绿色
橙色
蓝色
白色
B
无色
橙色
紫色
白色
C
黄绿色
橙色
蓝色
无色
D
黄绿色
无色
紫色
白色
2.(2016·临沂二模)某混合溶液中含有NaI、NaBr、Na2SO4三种溶质,其物质的量均为1 mol,向混合溶液中通入一定量的氯气。下列说法正确的是( )
A.将溶液蒸干最多可以得到4 mol NaCl
B.将溶液蒸干并灼烧,得到的固体可能是NaCl、NaBr、Na2SO4
C.向溶液中滴加淀粉KI溶液,溶液变蓝,则氯气一定过量
D.若通入氯气的体积为22.4 L(标准状况),反应的离子方程式为2I-+Cl2===I2+2Cl-
题组二 卤素单质及离子的鉴别
3.下列叙述中正确的是( )
A.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
B.用硝酸酸化的硝酸银溶液能一次鉴别NaCl、NaBr、KI三种失去标签的溶液
C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D.某浅黄色的溴水,加入CCl4振荡静置后,上层显橙红色
4.鉴别NaCl、NaBr、NaI可以选用的试剂是( )
①碘水、淀粉溶液 ②氯水、CCl4 ③溴水、苯 ④稀硝酸、AgNO3溶液 ⑤氯水、苯 ⑥FeCl3溶液、CCl4
A.①②④ B.②③⑥ C.②④⑤ D.④⑤⑥
5.下列叙述中正确的是( )
A.液溴易挥发,在存放液溴的试剂瓶中应加水封
B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C.某溶液加入CCl4,CCl4层显橙色,证明原溶液中存在Br-
D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
【反思归纳】
卤素单质性质的特殊性
(1)Br2在常温下呈液态,是唯一的液态非金属单质。液态Br2有剧毒,易挥发,故保存Br2时在试剂瓶中Br2液面上需用水封,磨口的玻璃塞用蜡封。
(2)I2遇淀粉显蓝色,这是碘单质的特殊性质,该性质可用于检验Cl2。Cl2可使湿润的淀粉KI试纸变蓝,其实质是Cl2+2I-===2Cl-+I2。此外碘单质易升华,是常温下固体单质中唯一的双原子分子。
(3)Br2和I2都可被某些有机溶剂(如四氯化碳、苯)萃取。
(4)氟元素无正价,F2与H2O发生置换反应生成O2:2F2+2H2O===4HF+O2。
(5)F2不能从NaX溶液中置换出X2(X代表Cl、Br、I)。
题组三 卤素单质氧化性强弱的实验探究方法
6.为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是____________________________________________。
(2)验证氯气的氧化性强于碘的实验现象是________________________________________
________________________________________________________________________。
(3)B中溶液发生反应的离子方程式是____________________________________________
________________________________________________________________________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是
________________________________________________________________________
________________________________________________________________________。
(5)过程Ⅲ实验的目的是____________________________________________________
________________________________________________________________________。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下________________,得电子能力逐渐减弱。
答案精析
考点一
基础知识梳理
1.刺激性
2.(1)①2Fe+3Cl22FeCl3
(2)(从左到右,从上到下)苍白 白雾 爆炸 白雾
(3)①Cl2+2KI===2KCl+I2
②Cl2+SO2+2H2O===H2SO4+2HCl
③Cl2+2FeCl2===2FeCl3
3.(1)Cl2+H2OHCl+HClO
(2)①Cl2+2NaOH===NaCl+NaClO+H2O
②2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
Ca(ClO)2、CaCl2 Ca(ClO)2
4.(2)①Cl2 HClO ②H+ Cl- ClO- OH-
5.(1)2HClO2HCl+O2↑ (2)①强 ②碱 ClO-+H2OHClO+OH- ③HClO Ca(ClO)2+CO2+H2O===2HClO+CaCO3↓
深度思考
1.(1)× (2)× (3)× (4)√ (5)√ (6)×
2.久置的氯水最终变为稀盐酸,表现为酸性。新制氯水中含有氯气、盐酸和次氯酸,除具有酸性外,还呈浅黄绿色,有刺激性气味,具有强氧化性。
3.最终得到的物质是CaCO3和CaCl2;Ca(ClO)2+H2O+CO2===CaCO3↓+2HClO,2HClO2HCl+O2↑。
解题探究
1.B 2.B
3.C [饱和氯水不能再溶解氯气,各成分的浓度不变,A项错;SO2+Cl2+2H2O===2HCl+H2SO4,Cl2+H2OH++Cl-+HClO的平衡左移,HClO的浓度减小,漂白性减弱,B项错;加入少量的碳酸钠粉末,消耗H+,使上述平衡正向移动,HClO的浓度增大,C项正确;光照过程中,HClO分解,生成O2和HCl,溶液中的离子浓度增大,导电性增强,D项错误。]
4.B
5.B [A项,NaClO的制备为Cl2与NaOH溶液反应:Cl2+2OH-===ClO-+Cl-+H2O,正确;B项,NaClO饱和溶液的pH为11,该消毒液中溶液的pH为12,是由于消毒液中还含有少量的NaOH,故pH增大是由于NaOH电离所致,错误;C项,该消毒液与洁厕灵混用会发生氧化还原反应:2H++Cl-+ClO-===Cl2↑+H2O,正确;D项,因为醋酸的酸性比次氯酸的酸性强,CH3COOH+ClO-===CH3COO-+HClO,HClO浓度增大,漂白性增强,正确。]
6.A [NH2Cl+H2ONH3+HClO,反应生成的HClO能杀菌消毒。该水解反应是一个可逆反应,HClO杀菌后浓度减小,平衡向右移动,氯胺转化成HClO;相反,当HClO浓度较高时,平衡向左移动,转化为氯胺,相当于暂时“贮存”,避免其分解损失,这样就延长了消毒时间。]
7.C [A项,酸性条件下ClO发生歧化反应,生成Cl-和ClO2,可写出方程式:4H++5ClO
eq oal(-,2)===Cl-+4ClO2↑+2H2O,显然氧化剂与还原剂的物质的量之比为1∶4,正确;B项,方程式符合歧化反应化合价的变化,正确;C项,ClO2易溶于水,显然不能用饱和食盐水除杂,错误;D项,等物质的量的ClO2作氧化剂时得电子数比Cl2得电子数多,正确。]
考点二
深度思考
1.(1)× (2)× (3)√ (4)√ (5)√ (6)×
2.不能。原因:(1)随反应进行,浓盐酸变为稀盐酸,不能再被MnO2氧化;(2)由于盐酸具有挥发性,反应过程中HCl挥发。
3.向上排空气收集氯气 安全瓶作用,防止D中的液体倒吸入B中 吸收尾气,防止氯气扩散到空气中污染环境
解题探究
1.D 2.D
3.(1)用导管将A的上口和B相连(或将A换成恒压滴液漏斗),在G和H之间增加干燥装置 (2)MnO2+4H++2Cl-Mn2++Cl2↑+2H2O 2S+Cl2S2Cl2 (3)饱和食盐水 浓硫酸
(4)分液漏斗 蒸馏烧瓶 导气、冷凝 (5)产率降低(或S2Cl2分解) 有固体产生(或其他正确描述) (6)SCl2 S(答案合理即可)控制浓盐酸的滴速不要过快 (7)吸收多余的氯气,保护环境
Cl2+2NaOH===NaClO+NaCl+H2O
考点三
基础知识梳理
1.(从左到右,从上到下)固体 挥发 升华 蓝
2.(1)2NaOH+X2NaX+NaXO+H2O
(2)①2Na+X2===2NaX ②> > < < Cl2+2Br-===2Cl-+Br2 Br2+2I-===2Br-+I2
③SO+Br2+H2O===SO+2Br-+2H+
2Fe2++Br2===2Br-+2Fe3+
3.(1)白 淡黄 黄 (2)Br- I- (3)蓝
深度思考
1.(1)× (2)× (3)× (4)× (5)√ (6)× (7)×
2.(1)因萃取而褪色:苯、CCl4与溴水混合后,水层几乎为无色。
(2)因碱性条件下发生歧化反应而褪色:如溴水与强碱反应,即Br2+2NaOH===NaBr+NaBrO+H2O。
(3)因被还原而褪色:如H2S、SO2、SO、Fe2+、I-等能将Br2还原为Br-而使溴水褪色。
(4)因生成沉淀而褪色:如溴水中加入AgNO3溶液,生成AgBr沉淀而使溴水褪色。
(5)因发生加成反应而褪色:含、—CC—的有机物与Br2发生加成反应,而使溴水褪色。
(6)因发生取代反应而褪色:如,使溴水褪色。
解题探究
1.A 2.B
3.B [还有很多氧化剂(如HNO3、O3等)能将I-氧化为I2,A错;碘单质的CCl4溶液显紫色,C项错;CCl4的密度比水大,应下层显橙红色,D项错。]
4.C 5.A
6.(1) (2)湿润的淀粉KI试纸变蓝
(3)Cl2+2Br-===Br2+2Cl-
(4)打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后CCl4层变为紫红色
(5)确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰
(6)原子半径逐渐增大
解析 A中滴加浓盐酸后,发生反应:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,生成黄绿色气体Cl2,在A、B、C中分别发生反应:Cl2+2KI===2KCl+I2,Cl2+2NaBr===2NaCl+Br2,Cl2+2NaBr===2NaCl+Br2,由于B、C中生成了Br2而使溶液变为黄色,打开活塞b,C中生成的Br2在D中发生反应:Br2+2KI===2KBr+I2。过程Ⅲ实验,当B中黄色溶液继续通入过量Cl2时,溶液变为红棕色,以此为对照,说明C中黄色溶液无Cl2,从而排除Cl2对溴置换碘实验的干扰。
相关文档
- 2020届高考化学一轮复习化学与自然2021-04-21 14:16:5213页
- 2021届(鲁科版)高考化学一轮复习化学2021-04-21 14:06:1514页
- 2020年高考化学一轮复习化学反应速2021-04-21 01:20:094页
- 2020届高考化学一轮复习化学平衡常2021-04-21 00:04:4526页
- 2020届高考化学一轮复习化学键作业2021-04-20 22:30:5310页
- 2021届高考化学一轮复习化学平衡常2021-04-20 22:17:5110页
- 2020届高考化学一轮复习化学反应进2021-04-20 22:16:308页
- 2020届高考化学一轮复习化学能与热2021-04-20 20:04:355页
- 2021届高考化学一轮复习化学反应与2021-04-20 19:03:076页
- 2021届(鲁科版)高考化学一轮复习化学2021-04-20 15:18:306页