- 629.50 KB
- 2021-04-19 发布
原电池原理
2/11/2021
1
原电池 ,金属的腐蚀和防护
1.
本节要点
构成原电池的条件?
3.
原电池的工作原理?
什么是原电池?
4.
原电池的正负极和电子流向如何判断?
2.
2/11/2021
2
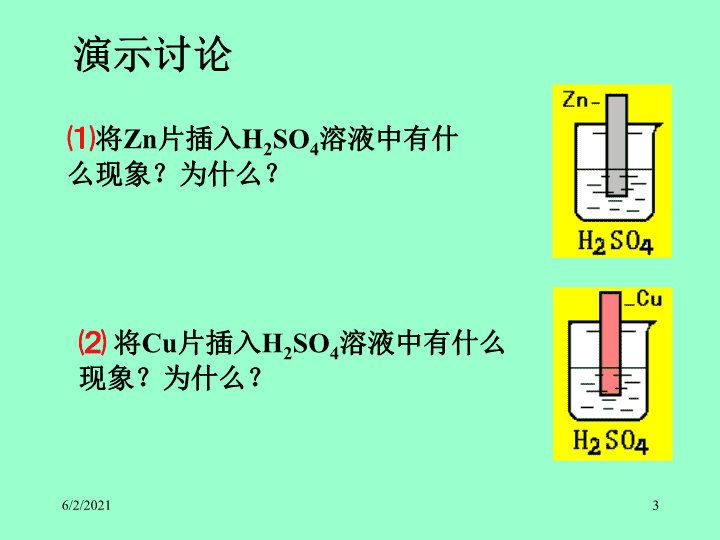
⑴
将
Zn
片插入
H
2
SO
4
溶液中有什么现象?为什么?
⑵
将
Cu
片插入
H
2
SO
4
溶液中有什么现象?为什么?
演示讨论
2/11/2021
3
⑷
若将
Zn
片
,Cu
片用一导线连接再浸在
H
2
SO
4
溶液中,有什么现象?为什么?
⑶
将一
Zn
片
,Cu
片平行插入
H
2
SO
4
溶液中,有什么现象?为什么?
原电池演示
2/11/2021
4
⑸
导线间接一电流计有何现象产生?为什么?
⑹
用一干电池连接电流计验证电子流向,确定
Zn
片
, Cu
片的正负极是怎样的?
2/11/2021
5
1
化学能
转化为
的
装置
就叫
原电池
。
把
电能
什么是原电池?
一、原电池
2/11/2021
6
2.
构成原电池的条件是什么?
(1)
有两个相连的电极
导体;
相连的形式可以多种多样的;
电极材料可以多种多样。
两种活泼不同的金属。
一种金属与一种非金属(如石墨)。
也可以两电极都是其它材料。
哪种是负极?
电极本身都参与反应吗?
哪个是负极?
电极本身参与反应吗?
哪个是负极?
电极本身一定参与反应吗?
2/11/2021
7
(3)
在电极表面上能发生自发进行的氧化还原反应。
(必定是放热反应)
正极、负极、电解质溶液构成闭合回路
(2)
两电极都
接触
电解质溶液(酸、碱、盐)
把
化学能转化为电能
的
装置。
闭合电路
电极相连
接触
电解质溶液
自发的氧化还原反应分两处进行
2/11/2021
8
3
、简单原电池的正负极和电子流向如何判断?
负极
(
–
)
:
电 子
电 流
是
不活泼金属或非金属
,
正极
(
+
)
:
是
活泼金属
,
本身
失去电子
,
发生
氧化反应
。
进电子
,
本身不反应,
得电子
发生
还原反应
。
是溶液中的
阳离子
要用到金属活动性顺序表:
注意:
K,Ca,Na,Mg,Al,Zn,Fe,Sn,Pb,(
H
),Cu,Hg,Ag,Pt,Au
…
活泼性,还原性依次 减弱。
2/11/2021
9
4
、原电池的工作原理
什么
?
2/11/2021
10
氧化反应
Zn-2e=Zn
2+
铜锌
原电池
电解质溶液
失
e
,沿导线传递,有电流产生
还原反应
2H
+
+2e
-
=H
2
↑
阴离子
阳离子
总反应:
负极
正极
2H
+
+2e
-
=H
2
↑
Zn-2e
-
=Zn
2+
Zn+2H
+
=Zn
2+
+H
2
↑
Zn+H
2
SO
4
=ZnSO
4
+H
2
↑
(
离子方程式)
(化学方程式)
电极反应
正极:
负极:
(氧化反应)
(还原反应)
阳离子
2/11/2021
11
②
正负两极上进出电子总数相等,根据
电子守恒
原理可进行许多有关电极反应的计算。
③
原电池反应跟直接反应差别:
反应速率加快;一般只有一个电极直接参加反应。
①
原电池的工作原理是将氧化还原反应分在正(氧化)、负(还原)两极进行,负极上失去的电子流入正极,从而产生电流。
明确以下几点
④
利用原电池原理 可
制作各种电池
,如干电池、铅蓄电池、银锌电池、锂电池、氢氧燃料电池
……
。
2/11/2021
12
练习
⒈
判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式
.
①
②
③
(
×
)
(
×
)
(
∨
)
2H
+
+2e
-
=
H
2
↑
负极:
总反应:
正极
:
Zn
-
2e
-
=
Zn
2+
Zn+2H
+
=Zn
2+
+H
2
↑
2/11/2021
13
⑤
④
(
∨
)
(
∨
)
负极
:
正极
:
总反应
:
正极:
负极
:
总反应:
Zn
-
2e
-
=
Zn
2+
2H
+
+2e
-
=
H
2
↑
Zn+2H
+
=Zn
2+
+H
2
↑
Fe
-
2e
-
=
Fe
2+
Cu
2+
+2e
-
=
Cu
Fe+Cu
2+
=Fe
2+
+Cu
Fe+CuSO
4
=Cu+FeSO
4
2/11/2021
14
⑦
⑥
(
×
)
(
∨
)
负极:
正极:
总反应:
Zn
-
2e
-
=
Zn
2+
Cu
2+
+2e
-
=
Cu
Zn+Cu
2+
=Zn
2+
+Cu
或
Zn+CuSO
4
=
ZnSO
4
+Cu
2/11/2021
15
⑧
⑨
(
×
)
(
∨
)
负极:
正极:
总反应:
Fe
-
2e
-
=
Fe
2+
2H
+
+2e
-
=
H
2
↑
Fe+2H
+
= Fe
2+
+H
2
↑
或
Fe+H
2
SO
4
=
FeSO
4
+H
2
↑
2/11/2021
16
2.
如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入
CuSO
4
溶液,片刻后可观察到的现象是
3
。
试将下列两个氧化还原反应分别设计成两个原电池
⑴
Zn + 2AgNO
3
=Zn(NO
3
)
2
+2Ag
⑵
2Fe
3+
+Fe=3Fe
2+
(
D
)
( Zn∣AgNO
3
∣C )
( Fe∣Fe
2
(SO
4
)
3
∣C )
A.
铁圈和银圈左右摇摆不定;
B.
保持平衡状态;
C.
铁圈向下倾斜;
D.
银圈向下倾斜;
2/11/2021
17
本节要点
:
1
,原电池概念。
2
,构成原电池的条件。
3
,原电池的正负极和电子流向判断。
4
,原电池的工作原理。
小 结
2/11/2021
18
相关文档
- 【化学】四川省成都七中实验学校202021-04-19 21:59:1517页
- 四川省武胜烈面中学校2019-2020学2021-04-19 21:58:0219页
- 化学课外兴趣小组活动总结2021-04-19 21:55:522页
- 2018-2019学年四川省绵阳南山中学2021-04-19 21:55:5117页
- 2014年中考化学小题精练 碳及一氧2021-04-19 21:55:513页
- 2017-2018学年陕西省西安电子科技2021-04-19 21:55:3412页
- 高中化学 3_3《盐类的水解》课件2 2021-04-19 21:55:2333页
- 2017-2018学年陕西省西安市长安区2021-04-19 21:52:408页
- 中考化学二轮复习试卷化学用语含答2021-04-19 21:52:3417页
- 江西省九江市2020届高三第二次模拟2021-04-19 21:52:1718页