- 2.57 MB
- 2021-04-17 发布
第
7
讲 化学反应与能量
[
最新考纲
]
1.
了解化学反应中能量转化的原因及常见的能量转化形式。
2.
了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。
3.
了解热化学方程式的含义,能正确书写热化学方程式。
4.
了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。
5.
了解焓变
(Δ
H
)
与反应热的含义。
6.
理解盖斯定律,并能运用盖斯定律进行有关反应焓变的计算。
反应热与焓变的概念及图像的理解
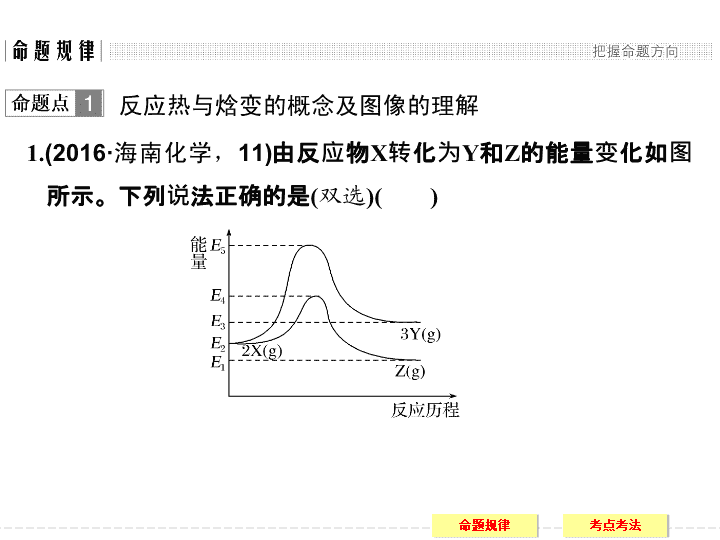
1.
(2016·
海南化学,
11)
由反应物
X
转化为
Y
和
Z
的能量变化如图所示。下列说法正确的是
(
双选
)
(
)
A.
由
X
→
Y
反应的
Δ
H
=
E
5
-
E
2
B.
由
X
→
Z
反应的
Δ
H
<0
C.
降低压强有利于提高
Y
的产率
D.
升高温度有利于提高
Z
的产率
解析
化学反应中的能量变化决定于反应物和生成物所具有的总能量的相对大小,由图可知,
X
→
Y
反应的
Δ
H
=
E
3
-
E
2
,
X
→
Z
反应的
Δ
H
=
E
1
-
E
2
<0
,反应放热,
A
项错误,
B
项正确;由
X
生成
Y
的反应,即
2X(g)
3Y(g)
,是气体物质的量增大的反应,降低压强、平衡正向移动,有利于提高
Y
的产率,
C
正确;
X
→
Z
的反应是放热反应,升高温度平衡逆向移动,不利于提高
Z
的产率,
D
错误。
答案
BC
①
C(s)
+
H
2
O(g)===CO(g)
+
H
2
(g)
Δ
H
1
=
a
kJ·mol
-
1
②
CO(g)
+
H
2
O(g)===CO
2
(g)
+
H
2
(g)
Δ
H
2
=
b
kJ·mol
-
1
③
CO
2
(g)
+
3H
2
(g)===CH
3
OH(g)
+
H
2
O(g)
Δ
H
3
=
c
kJ·mol
-
1
④
2CH
3
OH(g)===CH
3
OCH
3
(g)
+
H
2
O(g)
Δ
H
4
=
d
kJ·mol
-
1
答案
C
3.
[2017·
课标全国
Ⅰ
,
28(2)]
(1)
下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统
(
Ⅰ
)
和系统
(
Ⅱ
)
制氢的热化学方程式分别为
___________________________________________
、
________________________________________________
,
制得等量
H
2
所需能量较少的是
________
。
(2)
[2015·
课标全国Ⅰ,
28(3)]
已知反应
2HI(g)===H
2
(g)
+
I
2
(g)
的
Δ
H
=+
11 kJ· mol
-
1
,
1 mol H
2
(g)
、
1 mol I
2
(g)
分子中化学键断裂时分别需要吸收
436 kJ
、
151 kJ
的能量,则
1 mol HI(g)
分子中化学键断裂时需吸收的能量为
________________kJ
。
(3)
[2015·
海南化学,
16(3)]
由
N
2
O
和
NO
反应生成
N
2
和
NO
2
的能量变化如图所示,若生成
1 mol N
2
,其
Δ
H
=
________kJ· mol
-
1
。
利用盖斯定律计算反应热或书写热化学方程式
A.Δ
H
2
>Δ
H
3
B.Δ
H
1
<Δ
H
3
C.Δ
H
1
+
Δ
H
3
=
Δ
H
2
D.Δ
H
1
+
Δ
H
2
>
Δ
H
3
解析
1 mol CuSO
4
·5H
2
O(s)
溶于水会使溶液温度降低,为吸热反应,故
Δ
H
1
>
0
,
1 mol CuSO
4
(s)
溶于水会使溶液温度升高,为放热过程,故
Δ
H
2
<
0
,
1 mol CuSO
4
·5H
2
O(s)
溶于水可以分为两个过程,先分解成
1 mol CuSO
4
(s)
和
5 mol
水,然后
1 mol CuSO
4
(s)
再溶于水
CuSO
4
·5H
2
O
的分解为吸热反应,即
Δ
H
3
>
0
,根据盖斯定律得到关系式
Δ
H
1
=
Δ
H
2
+
Δ
H
3
,分析得到答案
Δ
H
1
<
Δ
H
3
。
答案
B
5.(1)
[2017·
江苏化学,
26(1)]
TiO
2
与
Cl
2
难以直接反应,加碳生成
CO
和
CO
2
可使反应得以进行。
已知:
TiO
2
(s)
+
2Cl
2
(g)=== TiCl
4
(g)
+
O
2
(g)
Δ
H
1
=+
175.4 kJ·mol
-
1
2C(s)
+
O
2
(g)===2CO(g)
Δ
H
2
=-
220.9 kJ·mol
-
1
沸腾炉中加碳氯化生成
TiCl
4
(g)
和
CO(g)
的热化学方程式:
__________________________________________________
。
(2)
[2016·
四川理综,
11(5)]
工业上常用磷精矿
[Ca
5
(PO
4
)
3
F]
和硫酸反应制备磷酸。已知
25
℃
,
101 kPa
时:
CaO(s)
+
H
2
SO
4
(l)===CaSO
4
(s)
+
H
2
O(l)
Δ
H
=-
271 kJ·mol
-
1
5CaO(s)
+
3H
3
PO
4
(l)
+
HF(g)===Ca
5
(PO
4
)
3
F(s)
+
5H
2
O(l)
Δ
H
=-
937 kJ·mol
-
1
则
Ca
5
(PO
4
)
3
F
和硫酸反应生成磷酸的热化学方程式是
____________________________________________________
。
答案
(1)TiO
2
(s)
+
2Cl
2
(g)
+
2C(s)===TiCl
4
(g)
+
2CO(g)
Δ
H
=-
45.5 kJ/mol
(2)Ca
5
(PO
4
)
3
F(s)
+
5H
2
SO
4
(l)===5CaSO
4
(s)
+
HF(g)
+
3H
3
PO
4
(l)
Δ
H
=-
418 kJ·mol
-
1
6.(1)
(2017·
课标全国
Ⅱ
,
27)
丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(3)
[2016·
课标全国
Ⅱ
,
26(3)]
①
2O
2
(g)
+
N
2
(g)===N
2
O
4
(l)
Δ
H
1
②
N
2
(g)
+
2H
2
(g)===N
2
H
4
(l)
Δ
H
2
③
O
2
(g)
+
2H
2
(g)===2H
2
O(g)
Δ
H
3
④
2N
2
H
4
(l)
+
N
2
O
4
(l)===3N
2
(g)
+
4H
2
O(g)
Δ
H
4
=-
1 048.9 kJ·mol
-
1
上述反应热效应之间的关系式为
Δ
H
4
=
________
。
答案
(1)
+
123
(2)2Δ
H
1
-
3Δ
H
2
-
Δ
H
3
(3)2Δ
H
3
-
2Δ
H
2
-
Δ
H
1
(4)Δ
H
1
+
Δ
H
2
-
Δ
H
3
分析评价
题型:选择题 填空题
评析:本部分知识考查一方面突出对概念的理解和应用,以图表为背景,考查化学反应中能量变化;另一方面根据已知热化学方程式书写待求反应的热化学方程式或直接计算反应热,是近几年高考热点。
启示
:二轮复习时应强化盖斯定律的应用,另外还应加强计算训练,
“
思路会,算不对
”
是制约高分的一个重要因素。
高频考点一 反应热与焓变
[
考点精要
]
1
.
三个角度理解产生化学反应热效应的原因
(1)
从宏观角度分析:
Δ
H
=
H
1
(
生成物的总能量
)
-
H
2
(
反应物的总能量
)
(2)
从微观角度分析:
Δ
H
=
E
1
(
反应物的键能总和
)
-
E
2
(
生成物的键能总和
)
(3)
从活化能角度分析:
Δ
H
=
E
1
(
正反应活化能
)
-
E
2
(
逆反应活化能
)
2
.
正确理解活化能在图示中的意义
(1)
从反应物至最高点的能量数值表示正反应的活化能,即
E
1
;
(2)
从最高点至生成物的能量数值表示逆反应的活化能,即
E
2
。
(3)
催化剂只能影响正、逆反应的活化能,而不影响反应的
Δ
H
。
3
.
燃烧热与中和热
[
考法指导
]
【考法训练
1
】
已知
H
2
O
2
在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示。下列说法正确的是
(
)
反应热图像分析
(
难度系数
☆☆
)
解析
催化剂不会影响反应的热效应和平衡转化率;
C
项,热化学方程式应标明状态。
答案
D
【考法训练
2
】
如图所示,
a
曲线是
298 K
、
101 kPa
时
N
2
与
H
2
反应过程中能量变化的曲线,下列叙述正确的是
(
)
解析
A
项,书写热化学方程式时,要标出各物质的聚集状态,错误;
B
项,由图可知
b
曲线中活化能降低,应是加入催化剂,升高温度不能改变活化能,错误;
C
项,加入催化剂,反应的反应热不变,错误;
D
项,题图表示的是
1 mol N
2
和
3 mol H
2
完全反应时的反应热,实际上
N
2
和
H
2
的反应是可逆反应,该条件下放出的热量小于
92 kJ
,而
2 mol N
2
和
6 mol H
2
在该条件下放出的热量小于
184 kJ
,增大反应物浓度,平衡正向移动,则
Q
2
>
2
Q
1
,故有
184
>
Q
2
>
2
Q
1
,正确。
答案
D
【考法训练
3
】
下列说法正确的是
(
)
A.
在
25
℃
、
101 kPa
,
1 mol C
与适量
O
2
反应生成
1 mol CO
时,放出
110.5 kJ
热量,则
C
的燃烧热为
110.5 kJ·mol
-
1
B.
在
25
℃
、
101 kPa
,
1 mol H
2
完全燃烧生成液态水放出
285.8 kJ
热量,则
H
2
的燃烧热为-
285.8 kJ·mol
-
1
C.
测定
HCl
和
NaOH
反应的中和热时,每次实验均应测量
3
个温度,即盐酸起始温度、
NaOH
起始温度和反应后终止温度
D.
在稀溶液中:
H
+
(aq)
+
OH
-
(aq)===H
2
O(l)
Δ
H
=-
57.3 kJ·mol
-
1
,若将含
0.5 mol H
2
SO
4
的浓硫酸与含
1 mol NaOH
的溶液混合,则放出的热量等于
57.3 kJ
燃烧热和中和热的理解与应用
(
难度系数
☆☆
)
解析
C
的燃烧热是指
1 mol C
完全燃烧生成
CO
2
时放出的热量,生成
CO
时放出的热量不是
C
的燃烧热,
A
项错误。
1 mol H
2
完全燃烧生成液态水时放出的热量是
H
2
的燃烧热,则
H
2
的燃烧热为
285.8 kJ·mol
-
1
,
B
项错误。浓硫酸稀释时放热,故含
0.5 mol H
2
SO
4
的浓硫酸与含
1 mol NaOH
的溶液混合,放出的热量大于
57.3 kJ
,
D
项错误。
答案
C
【考法训练
4
】
已知强酸与强碱的稀溶液发生中和反应的热效应为:
H
+
(aq)
+
OH
-
(aq)===H
2
O(l)
Δ
H
=-
57.3 kJ·mol
-
1
。稀醋酸、浓硫酸、稀硝酸分别与
0.1 mol·L
-
1
NaOH
溶液恰好完全反应放出的热量与
NaOH
溶液体积的关系如图所示。则下列描述正确的是
(
)
A.A
代表稀硝酸与
NaOH
溶液反应
B.B
代表稀醋酸与
NaOH
溶液反应
C.
b
=
5.73
D.C
代表浓硫酸与
NaOH
溶液反应
解析
醋酸电离吸热,浓硫酸溶解放热,故稀醋酸、浓硫酸、稀硝酸分别与等体积、等浓度的
NaOH
溶液反应放出热量的大小顺序为:浓硫酸>稀硝酸>稀醋酸,故
A
代表浓硫酸与
NaOH
溶液反应,
B
代表稀硝酸与
NaOH
溶液反应,
C
代表稀醋酸与
NaOH
溶液反应,
A
、
B
、
D
项错误;稀硝酸与
1.0 L 0.1 mol·L
-
1
NaOH
溶液恰好完全反应时生成
0.1 mol H
2
O
,故
b
=
5.73
,
C
项正确。
答案
C
“
两热比较
”
易混点
燃烧热的定量点是
1 mol
可燃物,而注意点是生成物氧化物必须稳定,这种稳定包括状态的稳定;中和热的定量点是生成
1 mol H
2
O(l)
,而注意点是弱酸、弱碱的电离及溶解热和沉淀生成热的影响。
【当堂指导】
高频考点二 热化学方程式的书写与判断
1
.
热化学方程式正误判断的六个易错点
[
考点精要
]
2
.
书写热化学方程式的两个注意点
(1)
注意同素异形体转化的名称问题。
对于具有同素异形体的物质,除了要注明聚集状态之外,还要注明物质的名称。
(2)
注意可逆反应中的反应热及热量变化问题。
由于反应热是指反应完全时的热效应,所以对于可逆反应,其热量要小于反应完全时的热量。
[
考法指导
]
【考法训练
1
】
正误判断,正确的划
“√”
,错误的划
“×”
热化学方程式的正误判断
(
难度系数
☆☆
)
(2)
密闭容器中,
9.6 g
硫粉与
11.2 g
铁粉混合加热生成硫化亚铁
17.6 g
时,放出
19.12 kJ
热量。则
Fe(s)
+
S(s)===FeS(s)
Δ
H
=-
95.6 kJ· mol
-
1
(
)
答案
(1)
×
(2)
√
(3)
×
(4)
×
【考法训练
2
】
向足量
H
2
SO
4
溶液中加入
100 mL 0.4 mol·L
-
1
Ba(OH)
2
溶液,放出的热量是
5.12 kJ
。若向足量
Ba(OH)
2
溶液中加入
100 mL 0.4 mol·L
-
1
HCl
溶液时,放出的热量为
2.292 kJ
,则
Na
2
SO
4
溶液与
BaCl
2
溶液反应的热化学方程式为
(
)
答案
D
【典例演示】
根据要求回答下列问题:
(1)
机动车尾气已成为城市大气的主要污染源,机动车尾气中的主要有害物质为氮的氧化物。目前科技工作者正在探索用甲烷等燃烧气体将氮氧化物还原为
N
2
和
H
2
O
,涉及的反应有:
CH
4
(g)
+
4NO
2
(g)===4NO(g)
+
CO
2
(g)
+
2H
2
O(g)
Δ
H
1
=-
574 kJ·mol
-
1
CH
4
(g)
+
2NO
2
(g)===CO
2
(g)
+
2H
2
O(g)
+
N
2
(g)
Δ
H
2
=-
867 kJ·mol
-
1
写出
CH
4
还原
NO
生成
N
2
的热化学方程式:
____________________________________________________
。
热化学方程式的书写
(
难度系数
☆☆☆
)
(2)
一定条件下,不同量的
CO
2
与不同量的
NaOH
充分反应放出的热量如下表所示:
写出该条件下,
CO
2
与
NaOH
反应生成
NaHCO
3
的热化学方程式
________________________________________________
。
CO
2
的量
NaOH
的量
放出的热量
22.0 g
750 mL 1.0 mol·L
-
1
x
kJ
1.0 mol
2.0 L 1.0 mol·L
-
1
y
kJ
(3)
我国煤炭资源相对石油和天然气资源丰富,煤的综合利用主要是指煤的气化和液化。煤的主要成分为碳氢化合物,用
CH
代表煤的
“
分子式
”
。已知:
煤炭在氧气氛围中气化
2CH(s)
+
O
2
(g)===2CO(g)
+
H
2
(g)
Δ
H
1
气化后的气体合成甲醇
CO(g)
+
2H
2
(g)===CH
3
OH(g)
Δ
H
2
甲醇制备丙烯的反应
3CH
3
OH(g)===C
3
H
6
(g)
+
3H
2
O(g)
Δ
H
3
写出在一定条件下,煤炭在氧气氛围中反应直接生成丙烯、水蒸气和
CO
的热化学方程式
_____________________________
____________________________________________________
。
答案
(1)CH
4
(g)
+
4NO(g)===2N
2
(g)
+
CO
2
(g)
+
2H
2
O(g)
Δ
H
=-
1 160 kJ·mol
-
1
(2)NaOH(aq)
+
CO
2
(g)===NaHCO
3
(aq)
Δ
H
=-
(4
x
-
y
) kJ·mol
-
1
(3)12CH(s)
+
6O
2
(g)===C
3
H
6
(g)
+
3H
2
O(g)
+
9CO(g)
Δ
H
=
6Δ
H
1
+
3Δ
H
2
+
Δ
H
3
【考法训练
3
】
依据信息书写热化学方程式
(1)
在
25
℃
、
101 kPa
下,一定质量的无水乙醇完全燃烧时放出热量
Q
kJ
,其燃烧生成的
CO
2
用过量饱和石灰水吸收可得
100 g CaCO
3
沉淀,则乙醇燃烧的热化学方程式为
__________________________________________________
。
(2)
已知
25
℃
、
101 kPa
时,
Mn(s)
+
O
2
(g)===MnO
2
(s)
Δ
H
=-
520 kJ· mol
-
1
S(s)
+
O
2
(g)===SO
2
(g)
Δ
H
=-
297 kJ· mol
-
1
Mn(s)
+
S(s)
+
2O
2
(g)===MnSO
4
(s)
Δ
H
=-
1 065 kJ· mol
-
1
SO
2
与
MnO
2
反应生成无水
MnSO
4
的热化学方程式是
__________________________________________________
。
(4)
化合物
AX
3
和单质
X
2
在一定条件下反应可生成化合物
AX
5
。已知
AX
3
的熔点和沸点分别为-
93.6
℃
和
76
℃
,
AX
5
的熔点为
167
℃
。
室温时
AX
3
与气体
X
2
反应生成
1 mol AX
5
,放出热量
123.8 kJ
。该反应的热化学方程式为
____________________________
___________________________________________________
。
(5)
贮氢合金
ThNi
5
可催化由
CO
、
H
2
合成
CH
4
的反应。温度为
T
时,该反应的热化学方程式为
__________________________
____________________________________________________
。
已知温度为
T
时:
CH
4
(g)
+
2H
2
O(g)===CO
2
(g)
+
4H
2
(g)
Δ
H
=+
165 kJ·mol
-
1
CO(g)
+
H
2
O(g)===CO
2
(g)
+
H
2
(g)
Δ
H
=-
41 kJ·mol
-
1
答案
(1)C
2
H
5
OH(l)
+
3O
2
(g)===2CO
2
(g)
+
3H
2
O(l)
Δ
H
=-
2
Q
kJ· mol
-
1
(2)MnO
2
(s)
+
SO
2
(g)===MnSO
4
(s)
Δ
H
=-
248 kJ· mol
-
1
(3)N
2
(g)
+
3H
2
(g)
2NH
3
(l)
Δ
H
=
2(
a
-
b
-
c
)kJ·mol
-
1
(4)AX
3
(l)
+
X
2
(g)===AX
5
(s)
Δ
H
=-
123.8 kJ·mol
-
1
(5)CO(g)
+
3H
2
(g)===CH
4
(g)
+
H
2
O(g)
Δ
H
=-
206 kJ·mol
-
1
【当堂指导】
热化学方程式的书写步骤
模型一 利用盖斯定律计算反应热
【示例
1
】
甲醇既是重要的化工原料,又可作为燃料,利用合成气
(
主要成分为
CO
、
CO
2
和
H
2
)
在催化剂作用下合成甲醇。发生的主要反应如下:
模型示例
]
回答下列问题:
已知反应
①
中相关的化学键键能数据如下:
由此计算Δ
H
1
=
________ kJ·mol
-
1
;
已知
Δ
H
2
=-
58 kJ·mol
-
1
,则
Δ
H
3
=
________ kJ·mol
-
1
。
化学键
H—H
C—O
C O
H—O
C—H
E
/(kJ·mol
-
1
)
436
343
1 076
465
413
[
分析建模
]
[
模型应用
]
答案
-
99
+
41
[
当堂应用
]
【应用
1
】
工业生产中可用苯乙烷生产苯乙烯。已知:
答案
A
模型二 利用盖斯定律书写热化学方程式
【示例
2
】
应对雾霾污染、改善空气质量需要从多方面入手,如开发利用清洁能源。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。
[
模型示例
]
【应用
2
】
(1)
在化工生产过程中,少量
CO
的存在会引起催化剂中毒。为了防止催化剂中毒,常用
SO
2
将
CO
氧化,
SO
2
被还原为
S
。已知:
①
C(s)
+
1/2O
2
(g)===CO(g)
Δ
H
1
=-
126.4 kJ·mol
-
1
②
C(s)
+
O
2
(g)===CO
2
(g)
Δ
H
2
=-
393.5 kJ·mol
-
1
③
S(s)
+
O
2
(g)===SO
2
(g)
Δ
H
3
=-
296.8 kJ·mol
-
1
则
SO
2
氧化
CO
的热化学方程式为
______________________
___________________________________________________
。
[
当堂应用
]
(2)LiH
可作飞船的燃料,已知下列反应:
①
2Li(s)
+
H
2
(g)===2LiH(s)
Δ
H
=-
182 kJ·mol
-
1
②
2H
2
(g)
+
O
2
(g)===2H
2
O(l)
Δ
H
=-
572 kJ·mol
-
1
③
4Li(s)
+
O
2
(g)===2Li
2
O(s)
Δ
H
=-
1 196 kJ·mol
-
1
试写出
LiH
在
O
2
中燃烧的热化学方程式
___________________
____________________________________________________
。
答案
(1)SO
2
(g)
+
2CO(g)===S(s)
+
2CO
2
(g)
Δ
H
=-
237.4 kJ·mol
-
1
(2)2LiH(s)
+
O
2
(g)===Li
2
O(s)
+
H
2
O(l)
Δ
H
=-
702 kJ·mol
-
1
模型三 应用盖斯定律比较反应热
【示例
3
】
已知:
2H
2
(g)
+
O
2
(g)===2H
2
O(g)
Δ
H
1
[
模型示例
]
[
分析建模
]
比较
Δ
H
1
与
Δ
H
2
的大小的方法。因
Δ
H
1
<
0
,
Δ
H
2
<
0
,
Δ
H
3
<
0(
均为放热反应
)
,依据盖斯定律得
Δ
H
1
=
Δ
H
2
+
Δ
H
3
,即
|Δ
H
1
|
>
|Δ
H
2
|
,所以
Δ
H
1
<
Δ
H
2
。
答案
D
【应用
3
】
已知:
C(s)
+
O
2
(g)===CO
2
(g)
Δ
H
1
CO
2
(g)
+
C(s)===2CO(g)
Δ
H
2
2CO(g)
+
O
2
(g)===2CO
2
(g)
Δ
H
3
4Fe(s)
+
3O
2
(g)===2Fe
2
O
3
(s)
Δ
H
4
3CO(g)
+
Fe
2
O
3
(s)===3CO
2
(g)
+
2Fe(s)
Δ
H
5
下列关于上述反应焓变的判断正确的是
(
)
A.Δ
H
1
>
0
,
Δ
H
3
<
0 B.Δ
H
2
<
Δ
H
4
C.Δ
H
1
=
Δ
H
2
+
Δ
H
3
D.Δ
H
3
=
Δ
H
4
+
Δ
H
5
[
当堂应用
]
解析
A
项,
C(s)
、
CO(g)
在
O
2
(g)
中燃烧生成
CO
2
,均为放热反应,则有
Δ
H
1
<
0
、
Δ
H
3
<
0
;
B
项,
CO
2
(g)
与
C(s)
在高温条件下反应生成
CO(g)
,该反应为吸热反应,则有
Δ
H
2
>
0
,
Fe(s)
与
O
2
(g)
反应生成
Fe
2
O
3
(s)
为放热反应,则有
Δ
H
4
<
0
;
C
项,将五个热化学方程式依次编号为
①
、
②
、
③
、
④
、
⑤
,根据盖斯定律,由
②
+
③
可得
①
,则有Δ
H
1
=
Δ
H
2
+
Δ
H
3
;
D
项,根据盖斯定律,由
③
×
3
-
⑤
×
2
可得
④
,则有
Δ
H
4
=
3Δ
H
3
-
2Δ
H
5
。
答案
C