- 247.00 KB
- 2021-04-17 发布
化学综合实验题的突破方法
专题训练
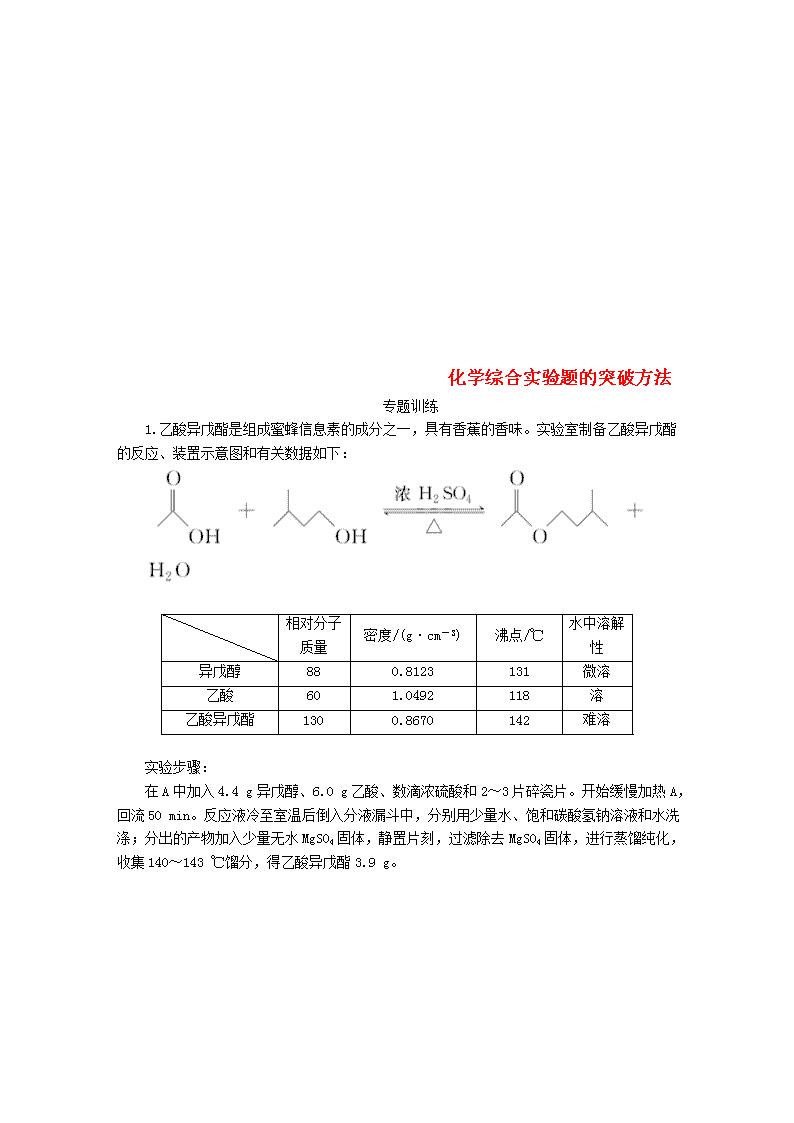
1.乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
相对分子质量
密度/(g·cm-3)
沸点/℃
水中溶解性
异戊醇
88
0.8123
131
微溶
乙酸
60
1.0492
118
溶
乙酸异戊酯
130
0.8670
142
难溶
实验步骤:
在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
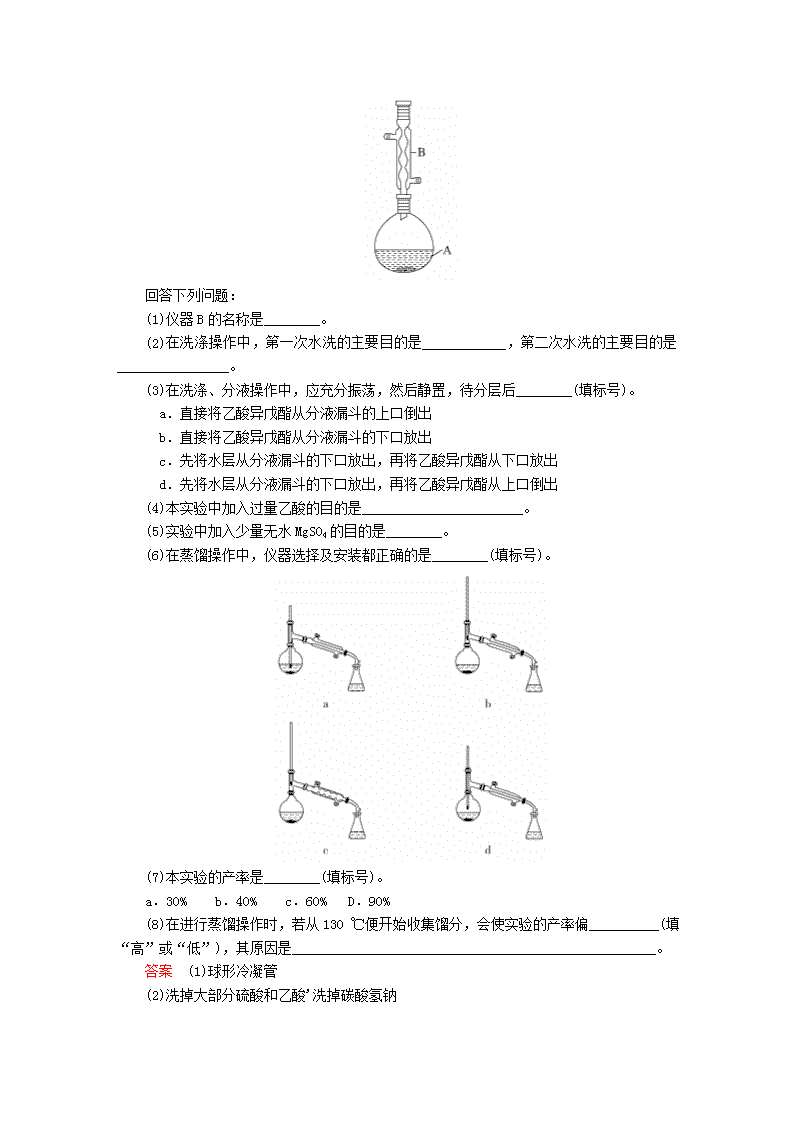
(1)仪器B的名称是________。
(2)在洗涤操作中,第一次水洗的主要目的是____________,第二次水洗的主要目的是________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是_______________________。
(5)实验中加入少量无水MgSO4的目的是________。
(6)在蒸馏操作中,仪器选择及安装都正确的是________(填标号)。
(7)本实验的产率是________(填标号)。
a.30% b.40% c.60% D.90%
(8)在进行蒸馏操作时,若从130 ℃便开始收集馏分,会使实验的产率偏__________(填“高”或“低”),其原因是____________________________________________________。
答案 (1)球形冷凝管
(2)洗掉大部分硫酸和乙酸'洗掉碳酸氢钠
(3)d'(4)提高醇的转化率'(5)干燥'(6)b'(7)c
(8)高'会收集少量未反应的异戊醇
解析 (1)仪器B为球形冷凝管。
(2)第一次水洗的目的是除去作催化剂的硫酸和过量的乙酸,接下来用饱和碳酸氢钠溶液进一步除去残留的少量乙酸,第二次水洗的目的是除去过量的饱和碳酸氢钠溶液。
(3)洗涤、分液后有机层密度小,在上面,密度大的水层在下面,需将水层从分液漏斗下口放出,然后将有机层从分液漏斗上口倒出,d项正确。
(4)制备乙酸异戊酯的反应为可逆反应,加入过量的乙酸,能提高醇的转化率,从而提高乙酸异戊酯的产率。
(5)加入少量无水MgSO4能除去有机层中的少量水,起到干燥作用。
(6)蒸馏实验中温度计水银球需和蒸馏烧瓶支管口在同一高度,而c中不应该用球形冷凝管,球形冷凝管一般用于反应装置,即在反应时考虑到反应物的蒸发流失而用球形冷凝管冷凝回流,使反应更彻底,故b正确。
(7)根据题中化学方程式及所给各物质的量,可知实验中异戊醇完全反应,理论上应生成乙酸异戊酯6.5 g,实验中实际生成乙酸异戊酯3.9 g,故乙酸异戊酯的产率为3.9/6.5×100%=60%。
(8)若从130 ℃便开始收集馏分,则收集得到的是乙酸异戊酯和少量未反应的异戊醇的混合物,导致所测出的实验产率偏高。
2.某化学兴趣小组为研究过氧化钠与SO2的反应情况,进行如下探究。
(1)[提出假设]
向一定量的过氧化钠固体中通入足量的SO2,对反应后的固体产物成分及反应原理提出如下假设。
假设一:反应后固体中只有Na2SO3,证明SO2未被氧化;
假设二:反应后固体中只有Na2SO4,证明SO2完全被氧化;
假设三:反应后固体中__________________________,证明SO2部分被氧化。
(2)[定性研究]
为验证假设三,该小组进行如下研究,请你完善表中内容。
实验步骤(不要求写出具体操作过程)
预期的实验现象和结论
取适量反应后的固体置于试管中,___________________________________________________
______________________________________________________________________________________________________________
(3)[定量研究]
通过测量气体的体积判断发生的化学反应,实验装置如图所示:
①装置B中所盛装试剂的名称为________。
②装置D的作用是___________________________________。
③请画出装置E。
④实验测得装置C中过氧化钠的质量增加了m1 g,装置D的质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),利用上述有关测量数据将下列表格补充完整。
SO2被氧化的程度
V与m1或m2的关系
未被氧化
—
完全被氧化
V=0
部分被氧化
________
答案 (1)既有Na2SO3,又有Na2SO4
(2)
实验步骤(不要求写出具体操作过程)
预期的实验现象和结论
加少量水溶解,加入BaCl2溶液,再加入稀盐酸
加入BaCl2溶液有白色沉淀产生,加入稀盐酸沉淀部分溶解。证明原固体中既有Na2SO3,又有Na2SO4
(其他合理答案均可。如先加足量盐酸,再加BaCl2溶液)
(3)①浓硫酸 ②吸收未反应的SO2
③
④0<V<或m1>
解析 (1)结合假设一和假设二,很容易确定假设三是反应后固体为Na2SO3和Na2SO4的混合物。
(2)证明SO2部分被氧化,其反应可能为①2Na2O2+2SO2===2Na2SO3+O2,②Na2O2
+SO2===Na2SO4。为证明固体为Na2SO3和Na2SO4的混合物,实验时应取少量固体溶解于水后再加入试剂,并且现象与结论要对应。
(3)定量研究中,装置A制得的SO2气体要先干燥,故装置B中所盛试剂为浓硫酸,SO2在装置C中与过氧化钠反应,过量的SO2被装置D中的碱石灰吸收。用装置E收集可能生成的O2并测量其体积。若SO2完全被氧化,只发生反应②,V=0;若SO2未被氧化,只发生反应①,利用装置C中过氧化钠的质量增加了m1 g,根据差量法,可求得V=(此处注意m2 g是一个干扰数据,因为无法知道装置A中生成SO2气体的量);若SO2部分被氧化时,反应①②均有发生,0