- 766.00 KB
- 2021-04-17 发布
人教版选修4 P79 图4-8 CuCl2溶液的电解
阴极
Cu2++2e- =Cu
阳极
2Cl- -2e-= Cl2↑
还原反应 氧化反应
请点击观看 视频:氯化铜溶液
的电解
总反应
CuCl2 Cu + Cl2↑
e-
e-
e-
e-
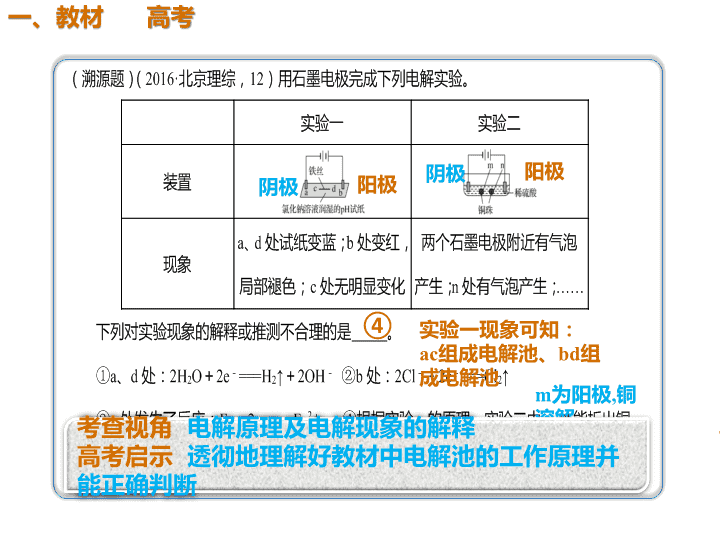
④
阴极 阳极 阴极 阳极
实验一现象可知:
ac组成电解池、bd组
成电解池
m为阳极,铜
溶解
2.(2018·宜昌期末)用图甲装置电解一定量的CuSO4溶
液,M、N为惰性电极。电解过程实验数据如图乙所示。
横轴表示电解过程中转移电子的物质的量,纵轴表示电
解过程产生气体的总体积。下列说法不正确的是( )
A.A点所得溶液只需加入一定量的CuO固体就可恢复
到起始状态
B.电解过程中N电极表面先有红色物质生成,后有气
泡产生
C.Q点时M、N两电极上产生的总气体在相同条件下体
积相同
D.若M电极材料换成Cu,则电解过程中CuSO4溶液的
浓度不变
A
特殊点:P点
两个阶段电解的
分界点
解析 惰性材料作电极,在阳极上H2O先放电,即阳极的电极反应
式为2H2O-4e-===O2↑+4H+,在阴极,Cu2+先放电,即阴极的电
极反应式为Cu2++2e-===Cu,P点后,气体体积突然增大,说明P
点Cu2+消耗完全,P点后,阴极的电极反应式是2H++2e-===H2↑,
即A点是电解完CuSO4后,又电解了一部分水,应加入CuO和H2O或
Cu(OH)2,才能恢复到原来的状态,故A说法错误;N极接电源的负
极,N极作阴极,根据选项A的分析,先有红色铜析出,然后出现气
体,故B说法正确;Q点的气体来自两个阶段,第一阶段:阳极电极
反应式为2H2O-4e-===4H++O2↑,阴极电极反应式为Cu2++2e-
===Cu,第二阶段:阳极电极反应式为2H2O-4e-===4H++O2↑,
阴极反应式为2H++2e-===H2↑,P点产生的气体为氧气,其体积为
b L,从P点到Q点,第二阶段,阴极产生的气体体积为2b L,阳极
产生的气体体积为b L,阳极气体总体积为(b+b)L=2b L,故C说法
正确;若M电极换成Cu,阳极上发生反应Cu-2e-===Cu2+,阴极
反应式为Cu2++2e-===Cu,因此电解过程中CuSO4溶液的浓度不
变,故D说法正确。
(1)书写电解池中电极反应式时,要以实际放
电的离子表示,但书写总电解反应方程式时,
弱电解质要写成分子式。
(2)要确保两极电子转移数目相同,且注明条
件“电解”。
(3)电解水溶液时,应注意放电顺序中H+、
OH-之后的离子一般不参与放电。
(4)当电解池的电极材料为活性电极时,则阳
极为电极本身失电子,不能再用电解规律。
规避“四个”失分点
突破电化学定量计算的三种方法
相关文档
- 人教部编版七年级上册第三单元后的2021-04-17 13:54:3322页
- 八年级数学下册第四章因式分解2提2021-04-17 13:46:2218页
- 人教部编版九年级下册语文课堂教学2021-04-17 13:45:2121页
- 外研版三年级下册英语Module 8 Uni2021-04-17 13:39:2034页
- 八年级道德与法治上册第一单元走进2021-04-17 13:34:4816页
- 人教版部编版九年级上册道德与法治2021-04-17 13:33:5125页
- 2018年高考数学考点突破教学课件:9_2021-04-17 13:23:4544页
- 2020春六年级语文下册第一单元3古2021-04-17 13:10:3169页
- 北师大版小学一年级下册教学课件-2021-04-17 13:10:2916页
- 人教版高三数学总复习教学课件:2-62021-04-17 13:02:3958页