- 1.53 MB
- 2021-04-17 发布
济南二中高三线上检测
化学试题
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S- -35.5
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.化学现象随处可见,化学制品伴随我们的生活。下列说法错误的是( )
A. “霾尘积聚难见路人”,雾霾可能产生丁达尔效应
B. “用浓酒和糟入甑(蒸锅),蒸令气上……”,其中涉及的操作是蒸馏
C. “世间丝、麻、裘皆具素质……”,其中的“丝、麻”的主要成分都是蛋白质
D. 古剑“沈卢”以“剂钢为刃,柔铁为茎干,不尔则多断折”,其中的“剂钢”是铁合金
【答案】C
【解析】
【详解】A.雾霾中可能存在直径1-100nm的粒子,这些粒子分散在空气中形成胶体,可产生丁达尔效应,A项正确;
B.“用浓酒和糟入甑(蒸锅),蒸令气上……”,通过蒸煮使酒精转化为蒸气,再冷凝收集,是蒸馏操作,B项正确;
C.“丝”是蚕丝,主要成分为蛋白质;“麻”来自植物,主要成分为纤维素,C项错误;
D.钢是铁和碳的合金,D项正确;
答案选C。
2.《学习强国》学习平台说“最基本的生命分子中都有碳原子”。常用于测定文物的年代,作为示踪原子对研究有机化学反应和生物化学反应更为方便。被用来作为阿伏伽德罗常数的标准。关于、、说法正确的是( )
A. 质子数与质量数相同 B. 化学性质相似
C. 互为同素异形体 D. 质子数与中子数相等
【答案】B
【解析】
【详解】根据原子符号的表示含义,、、三种原子的质子数都是6个,中子数分别是8、7、6,它们属于同位素,由于原子核外都有6
- 26 -
个电子,核外电子排布相同,因此三种同位素原子的化学性质相同,故合理选项是B。
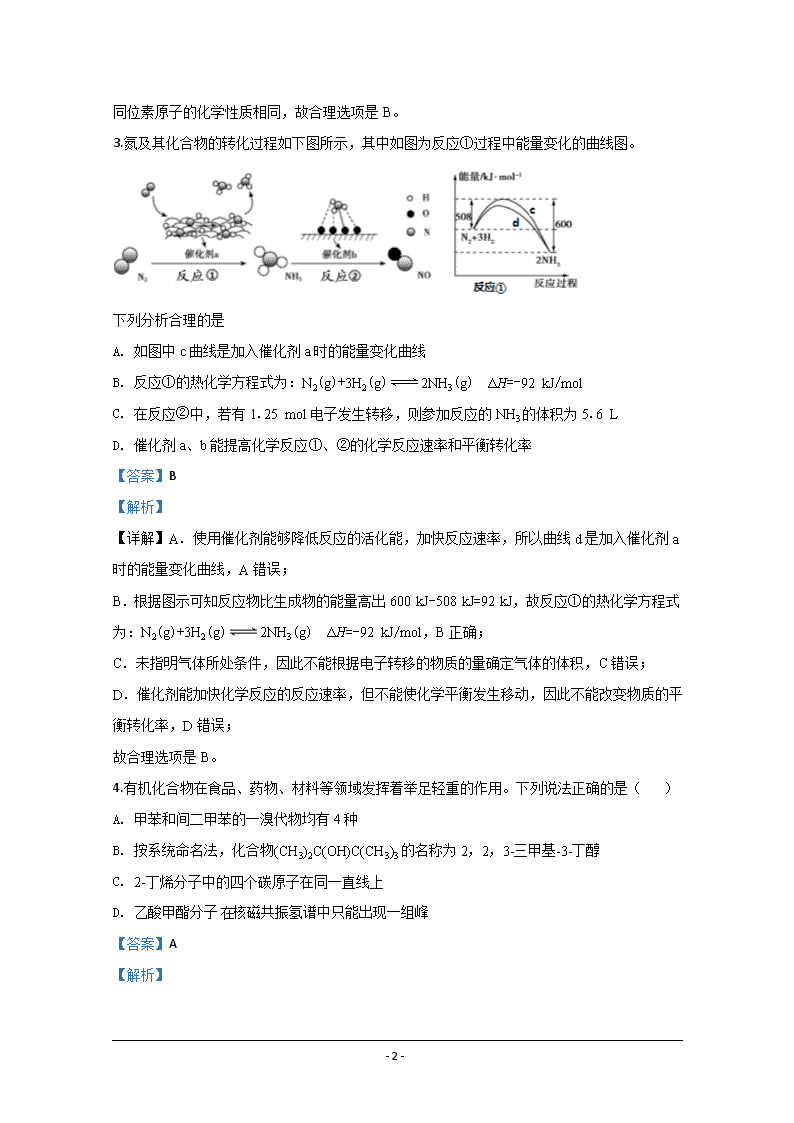
3.氮及其化合物的转化过程如下图所示,其中如图为反应①过程中能量变化的曲线图。
下列分析合理的是
A. 如图中c曲线是加入催化剂a时的能量变化曲线
B. 反应①的热化学方程式为:N2(g)+3H2(g)2NH3(g) ΔH=-92 kJ/mol
C. 在反应②中,若有1.25 mol电子发生转移,则参加反应的NH3的体积为5.6 L
D. 催化剂a、b能提高化学反应①、②的化学反应速率和平衡转化率
【答案】B
【解析】
【详解】A. 使用催化剂能够降低反应的活化能,加快反应速率,所以曲线d是加入催化剂a时的能量变化曲线,A错误;
B. 根据图示可知反应物比生成物的能量高出600 kJ-508 kJ=92 kJ,故反应①的热化学方程式为:N2(g)+3H2(g)2NH3(g) ΔH=-92 kJ/mol,B正确;
C. 未指明气体所处条件,因此不能根据电子转移的物质的量确定气体的体积,C错误;
D. 催化剂能加快化学反应的反应速率,但不能使化学平衡发生移动,因此不能改变物质的平衡转化率,D错误;
故合理选项是B。
4.有机化合物在食品、药物、材料等领域发挥着举足轻重的作用。下列说法正确的是( )
A. 甲苯和间二甲苯的一溴代物均有4种
B. 按系统命名法,化合物(CH3)2C(OH)C(CH3)3的名称为2,2,3-三甲基-3-丁醇
C. 2-丁烯分子中的四个碳原子在同一直线上
D. 乙酸甲酯分子核磁共振氢谱中只能出现一组峰
【答案】A
【解析】
- 26 -
【详解】A.甲苯有4种等效氢(),间二甲苯也有4种等效氢(),因此它们的一溴代物均有4种,A项正确;
B.醇的系统命名,选含羟基的最长碳链为主链,从距羟基较近的一端开始编号,,该化合物名称应为:2,3,3-三甲基-2-丁醇,B项错误;
C.2-丁烯的结构为或,分子中的四个碳原子不在一条直线上,C项错误;
D.乙酸甲酯分子中有2种等效氢(),在核磁共振氢谱中会出现2组峰,D项错误;
答案选A。
【点睛】用系统命名法命名的一般原则:
① 选择含官能团的最长碳链为主链;
② 编号时,先考虑使官能团所在碳的编号尽可能小,再考虑使其它支链的编号尽可能小;
③ 写名称时,先写支链名称,再写主链名称,阿拉伯数字与汉字之间以“-”相隔。
5.设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 1L0.1mol·L-1Fe2(SO4)3溶液中含有的阳离子数目小于0.2NA
B. 0.24g Mg在O2和CO2的混合气体中完全燃烧,转移电子数为0.02NA
C. 3g由CO2和SO2组成的混合气体中含有的质子数为1.5NA
D. 1molNa2O2与SO2完全反应,转移电子数为2NA
【答案】A
【解析】
【详解】A. 铁离子在溶液中水解导致阳离子个数增多,故溶液中阳离子个数多于0.2NA个,故A错误;
B. 0.24g Mg为0.01mol,Mg在O2和CO2的混合气体中完全燃烧生成MgO,失去0.02mol
- 26 -
电子,则转移电子数为0.02NA,故B正确;
C. CO2的摩尔质量为44g/mol,含22个质子;SO2的摩尔质量为64g/mol,含32个质子,即两者均是2g中含1mol质子,故3g混合物中含1.5mol质子即1.5NA个质子,故C正确;
D.过氧化钠与二氧化硫反应生成硫酸钠,1mol过氧化钠中的−1价的氧原子变为−2价,故1mol过氧化钠转移2mol电子即2NA个,故D正确;
答案选A。
6.泛酸和乳酸均易溶于水并能参与人体代谢,结构简式如下图所示。下列说法不正确的是
泛酸乳酸
A. 泛酸分子式为C9H17NO5
B. 泛酸在酸性条件下的水解产物之一与乳酸互为同系物
C. 泛酸易溶于水,与其分子内含有多个羟基易与水分子形成氢键有关
D. 乳酸在一定条件下反应,可形成六元环状化合物
【答案】B
【解析】
【详解】A. 根据泛酸的结构简式,可知分子式为C9H17NO5,故A正确;
B. 泛酸在酸性条件下的水解出,与乳酸中羟基个数不同,所以与乳酸不是同系物,故B错误;
C. 泛酸中的羟基与水分子形成氢键,所以泛酸易溶于水,故C正确;
D. 2分子乳酸在一定条件下反应酯化反应,形成六元环状化合物,故D正确;
选B。
【点睛】本题考查有机物的机构和性质,重点是掌握常见官能团的结构和性质,肽键在一定条件下水解,羟基、羧基一定条件下发生酯化反应,正确把握同系物的概念。
7.实验室为探究铁与浓硫酸足量的反应,并验证的性质,设计如图所示装置进行实验,下列说法不正确的是()
- 26 -
A. 装置B中酸性溶液逐渐褪色,体现了二氧化硫的还原性
B. 实验结束后可向装置A的溶液中滴加KSCN溶液以检验生成的
C. 装置D中品红溶液褪色可以验证的漂白性
D. 实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸
【答案】B
【解析】
【详解】A.通入酸性溶液中发生氧化还原反应生成硫酸锰、硫酸钾和硫酸,可使酸性高锰酸钾溶液褪色,体现的还原性,故A正确;
B.KSCN溶液用于检验三价铁离子,故B错误;
C.能使品红溶液变为无色是二氧化硫生成的亚硫酸结合有机色素形成无色物质,体现了二氧化硫的漂白性,用酒精灯加热,褪色的品红恢复红色,故C正确;
D.B中的溶液发生倒吸,是因为装置A中气体压强减小,实验时A中导管a插入浓硫酸中,A装置试管中气体压强减小时,空气从导管a进入A装置,a导管起平衡气压的作用,故D正确;
故选:B。
【点睛】本题考查学生对实验原理与装置的理解与评价,掌握二氧化硫氧化性、漂白性、还原性等是解题关键,题目难度中等。
8.工业上用发烟HClO4把潮湿的CrCl3氧化为棕色的烟[CrO2(ClO4)2]来除去Cr(Ⅲ),HClO4中部分氯元素转化为最低价态。下列说法不正确的是( )
A. HClO4属于强酸,反应还生成了另一种强酸
- 26 -
B. 该反应中,参加反应的氧化剂与氧化产物的物质的量之比为3∶8
C. CrO2(ClO4)2中Cr元素显+6价
D. 该反应离子方程式为19ClO4-+8Cr3++8OH-=8CrO2(ClO4)2+3Cl-+4H2O
【答案】D
【解析】
【分析】
根据题意,写出该反应的化学方程式:19HClO4+8CrCl3+4H2O = 8CrO2(ClO4)2+27HCl,据此解答。
【详解】A.HClO4属于强酸,反应生成的HCl也是强酸,A项正确;
B.该反应的氧化剂为HClO4,氧化产物为CrO2(ClO4)2,根据方程式,当有19molHClO4参加反应时,其中有3mol作氧化剂,生成的氧化产物[CrO2(ClO4)2]为8mol,因此参加反应的氧化剂与氧化产物的物质的量之比为3∶8,B项正确;
C.CrO2(ClO4)2中O元素显-2价,ClO4-显-1价,所以Cr元素显+6价,C项正确;
D.该反应在酸性条件下发生,离子方程式为19ClO4-+8Cr3++4H2O = 8CrO2(ClO4)2+8H++3Cl-,D项错误;
答案选D。
9.前四周期元素X、Y、Z、W、T的原子序数依次增大,Y、Z、W位于同一周期,X的最简单氢化物分子的空间结构为正四面体,Y在同周期中电负性最小,二元化合物E中元素Y和W的质量比为23:16;同周期元素简单离子中,元素Z形成的离子半径最小;T元素的价电子排布式为3d104s1。下列说法正确的是( )
A. 简单离子的半径Y>Z>W
B. 最高价氧化物对应水化物的酸性W>Z>X
C. W和T的单质混合加热可得化合物T2W
D. W的单质在足量的氧气中燃烧,所得产物溶于水可得强酸
【答案】C
【解析】
【分析】
X的最简单氢化物分子的空间构型为正四面体,该氢化物为甲烷,即X为C,Y、Z、W位于同一周期,原子序数依次增大,即Y、Z、W位于第三周期,Y的电负性最小,推出Y为Na,二元化合物E中元素Y和W的质量比为23:16,推出该二元化合物为Na2S,即W为S
- 26 -
,同周期元素简单离子中,元素Z形成的离子半径最小,即Z为Al,T元素的价电子3d104s1,推出T元素为Cu,据此分析;
【详解】X的最简单氢化物分子的空间构型为正四面体,该氢化物为甲烷,即X为C,Y、Z、W位于同一周期,原子序数依次增大,即Y、Z、W位于第三周期,Y的电负性最小,推出Y为Na,二元化合物E中元素Y和W的质量比为23:16,推出该二元化合物为Na2S,即W为S,同周期元素简单离子中,元素Z形成的离子半径最小,即Z为Al,T元素的价电子3d104s1,推出T元素为Cu,
A. Y、Z、W简单离子分别是Na+、Al3+、S2-,因此简单离子半径大小顺序是r(S2-)>r(Na+)>r(Al3+),故A错误;
B. 三种元素最高价氧化物对应水化物分别是H2CO3、Al(OH)3、H2SO4,硫酸酸性最强,氢氧化铝为两性,因此酸性强弱顺序是H2SO4>H2CO3>Al(OH)3,故B错误;
C. Cu与S在加热条件下发生反应,因为S的氧化性较弱,因此将Cu氧化成较高价态,得到产物是Cu2S,反应:2Cu+S Cu2S,故C正确;
D. S在足量的氧气中燃烧生成SO2,SO2溶于水后生成H2SO3,亚硫酸为中强酸,故D错误;
答案:C。
【点睛】易错点是选项D,学生认为S与足量的O2反应生成SO3,SO3溶于水后生成H2SO4,学生:C与O2反应,如果氧气不足,则生成CO,氧气过量,则生成CO2,S和C不太一样,S与氧气反应,无论氧气过量与否,生成的都是SO2,SO2转化成SO3,需要催化剂、高温条件。
10.下列实验中,能达到相应实验目的的是
A.制备并收集乙酸乙酯
B.证明氯化银溶解度大于硫化银
C.验证溴乙烷的消去产物是乙烯
D.推断S、C、Si的非金属性强弱
A. A B. B C. C D. D
- 26 -
【答案】D
【解析】
【详解】A、制取乙酸乙酯需要用浓硫酸做催化剂,故不选A;
B、1mL0.1mol/L的AgNO3溶液滴加几滴0.1mol/L的NaCl溶液生成白色沉淀AgCl,AgNO3有剩余,再滴加几滴0.1mol/L的Na2S,AgNO3与Na2S反应生成Ag2S沉淀,所以不能证明氯化银溶解度大于硫化银,故不选B;
C、乙烯、乙醇都能使酸性高锰酸钾溶液褪色,所以该装置不能验证溴乙烷消去产物是乙烯,故不选C;
D、碳酸钠与稀硫酸反应放出二氧化碳,证明非金属性S>C,二氧化碳与硅酸钠溶液反应生成硅酸沉淀,证明非金属性C>Si,故选D。
二、本题共5小题,每小题4分,共20分。每小题有1个或2个选项符合题意,全都选对得4分,选对但不全的得1分,有选错的得0分。
11.高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:其中除杂过程包括:①向浸出液中加入一定量的X,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤;③…下列说法正确的是( )
A. 试剂X可以是MnO、MnO2、MnCO3等物质
B. 浸出时加入植物粉的作用是作为还原剂
C. 除杂过程中调节浸出液的pH为3.5~5.5可完全除去Fe、Al、Mg等杂质
D. 为提高沉淀MnCO3步骤的速率可以持续升高温度
【答案】B
【解析】
【分析】
软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)中Mn元素显+4价,浸出并过滤后Mn元素以Mn2+的形式存在于滤液中,浓硫酸无还原性,据此可推知植物粉作还原剂;浸出后的滤液中,除了Mn2+还有Fe2+、Al3+、Mg2+,除杂时可调节pH
- 26 -
使其中一些离子转化为沉淀,为了不引入新的杂质,可加入Mn(Ⅱ)的氧化物或碳酸盐;除杂过程中调节浸出液的pH为3.5~5.5,不能将Fe2+、Al3+、Mg2+完全转化为沉淀,之后加入双氧水可将Fe2+氧化为更易沉淀的Fe3+,加入的软锰矿也会再消耗一些H+;NH4HCO3受热易分解,因此加入NH4HCO3沉淀Mn2+时,温度不宜过高。
【详解】A.试剂X用于调节pH,为了不引入新的杂质,可加入Mn(Ⅱ)的氧化物或碳酸盐,不宜加入MnO2,A项错误;
B.浸出时,MnO2转化为Mn2+,植物粉作还原剂,B项正确;
C.除杂过程中调节浸出液的pH为3.5~5.5不能完全除去Fe、Al、Mg等杂质,C项错误;
D.沉淀MnCO3步骤中,NH4HCO3受热易分解,不能持续升高温度,D项错误;
答案选B。
【点睛】控制实验条件时要充分考虑物质的特性,如:
① Fe3+在较低的pH环境下就可沉淀完全,要完全沉淀Fe元素,应将Fe2+转化为Fe3+;
② NH4HCO3受热易分解,要注意控制反应的温度。
12.Li—SOCl2电池是迄今具有最高能量比的电池。该电池的电极材料分别为锂和碳,电解液(熔点-110℃、沸点78.8℃)是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2。下列说法正确的是( )
A. 该电池不能在寒冷地区正常工作
B. SOCl2分子的空间构型是平面三角形
C. 该电池工作时,正极反应为:2SOCl2+4e-=4Cl-+S+SO2
D. 该电池组装时,必须在无水无氧条件下进行
【答案】CD
【解析】
【分析】
根据电池的总反应可知,失电子的是Li,在负极发生反应,得电子的是SOCl2,在正极发生反应;电解液的熔点为-110℃、沸点为78.8℃,电池可以在-110℃~78.8℃温度范围内正常工作。
【详解】A.该电池可以在-110℃~78.8℃环境下正常工作,A项错误;
B.SOCl2分子的中心原子为S,其价层电子对数=3+(6-1×2-2×1)=4,VSEPR模型为四面体形,中心原子上的孤电子对数=(6-1×2-2×1)=1,则SOCl2分子的立体构型为三角锥形,B项错误;
- 26 -
C.根据电池的总反应方程式,可知正极反应为:2SOCl2+4e-=4Cl-+S+SO2,C项正确;
D.Li是活泼金属,易与O2反应,也能与水反应,SOCl2遇水会发生反应:SOCl2+H2O=SO2+2HCl,因此该电池组装时,必须在无水无氧条件下进行,D项正确;
答案选CD。
【点睛】价层电子对互斥理论(VSEPR理论)是一种推测分子立体构型的理论,应用时有以下要点:
① 中心原子的价层电子对数=σ键电子对数+中心原子上的孤电子对数
② σ键电子对数=与中心原子结合的原子数
③ 中心原子上的孤电子对数=(a-xb)
其中a为中心原子的价电子数,x为与中心原子结合的原子数,b为与中心原子结合的原子最多能接受的电子数。
④ 中心原子的价层电子对数与VSEPR模型的关系:
中心原子的价层电子对数
2
3
4
VSEPR模型
直线形
平面三角形
四面体
推测分子的立体构型还需考虑孤电子对数。
综上,SOCl2分子的中心原子为S,σ键电子对数=3,S原子的价电子数a=6,S原子结合了1个O原子,则x1=1,b1=8-6=2,S原子还结合了2个Cl原子,则x2=2,b2=8-7=1,中心原子上的孤电子对数=(a-x1b1-x2b2)=(6-1×2-2×1)=1,因此中心原子的价层电子对数=3+1=4,SOCl2分子的VSEPR模型为四面体形,由于1对孤电子对占据了四面体的1个顶点,因此分子的立体构型为三角锥形。
13.向某容积为2L的恒容密闭容器中充入2molX(g)和1molY(g),发生反应2X(g)+Y(g)3Z(g)。反应过程中,持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
A. M点时,Y的转化率最大
- 26 -
B. 平衡后充入X,达到新平衡时X的体积分数减小
C. 升高温度,平衡常数减小
D. W、M两点Y的正反应速率相同
【答案】C
【解析】
【分析】
起始时向容器中充入2molX(g)和1molY(g),反应从左到右进行,结合图像,由起点至Q点,X的体积分数减小;Q点之后,随着温度升高,X的体积分数增大,意味着Q点时反应达到平衡状态,温度升高,平衡逆向移动,反应从右向左进行。
【详解】A.Q点之前,反应向右进行,Y的转化率不断增大;Q点→M点的过程中,平衡逆向移动,Y的转化率下降,因此Q点时Y的转化率最大,A项错误;
B.平衡后充入X,X的体积分数增大,平衡正向移动,根据勒夏特列原理,平衡移动只能减弱而不能抵消这个改变,达到新的平衡时,X的体积分数仍比原平衡大,B项错误;
C.根据以上分析,升高温度,平衡逆向移动,平衡常数减小,C项正确;
D.容器体积不变,W、M两点,X的体积分数相同,Y的体积分数及浓度也相同,但M点温度更高,Y的正反应速率更快,D项错误;
答案选C。
14.根据下列实验操作和现象所得出的结论正确的是( )
选项
实验操作和现象
结论
A
向鸡蛋清溶液中加入少量CuSO4溶液,出现浑浊
蛋白质可能发生了变性
B
将乙醇与浓硫酸混合加热,产生的气体通入酸性KMnO4溶液,溶液紫红色褪去
产生的气体中一定含有乙烯
C
室温下,用pH试纸测得:0.1 mol•L﹣1Na2SO3溶液的pH约为10;0.1 mol•L﹣1NaHSO3溶液的pH约为5
HSO3﹣结合H+的能力比SO32﹣的强
D
向NaCl和NaBr的混合溶液中滴入少量AgNO3溶液,产生淡黄色沉淀(AgBr)
Ksp(AgBr)<Ksp(AgCl)
- 26 -
A. A B. B C. C D. D
【答案】A
【解析】
【详解】A. 鸡蛋清主要成分为蛋白质,少量CuSO4可能会使其发生变性,故A项正确;
B. 乙醇和浓硫酸共热至170℃后发生消去反应生成乙烯,但乙醇易挥发,二者均可使高锰酸钾褪色,则该实验不能证明乙烯能使KMnO4溶液褪色,故B项错误;
C. 室温下,用pH试纸测得:0.1 mol·L-1Na2SO3溶液的pH约为10;0.1 mol·L-1NaHSO3溶液的pH约为5,说明SO32-的水解程度比HSO3-大,即SO32-结合H+的能力比HSO3-的强,故C项错误;
D. NaCl和NaBr的浓度大小未知,产生的淡黄色沉淀也可能是溴离子浓度较大所导致,因此该实验现象不能说明Ksp(AgBr)