- 365.21 KB
- 2021-04-17 发布
1
单元质检卷六 化学反应与能量
(时间:45 分钟 满分:100 分)
一、选择题(本题共 6 小题,每小题 6 分,共 36 分。每小题只有一个选项符合题目要求)
1.(2019 黑龙江哈尔滨第六中学高三期中)下列有关热化学方程式的叙述正确的是( )
A.已知甲烷的燃烧热为 890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.已知 C(石墨,s) C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.已知中和热为ΔH=-57.3 kJ·mol-1,则 1 mol 稀硫酸和足量稀 NaOH 溶液反应的反应热就是中和
热
D.已知 S(g)+O2(g) SO2(g) ΔH1;S(s)+O2(g) SO2(g) ΔH2,则ΔH1<ΔH2
2.
(2019 山东济宁高三期末)Li/Li2O 体系的能量循环图如图所示。下列说法正确的是( )
A.ΔH3<0
B.ΔH3+ΔH4+ΔH5=ΔH6
C.ΔH6>ΔH5
D.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0
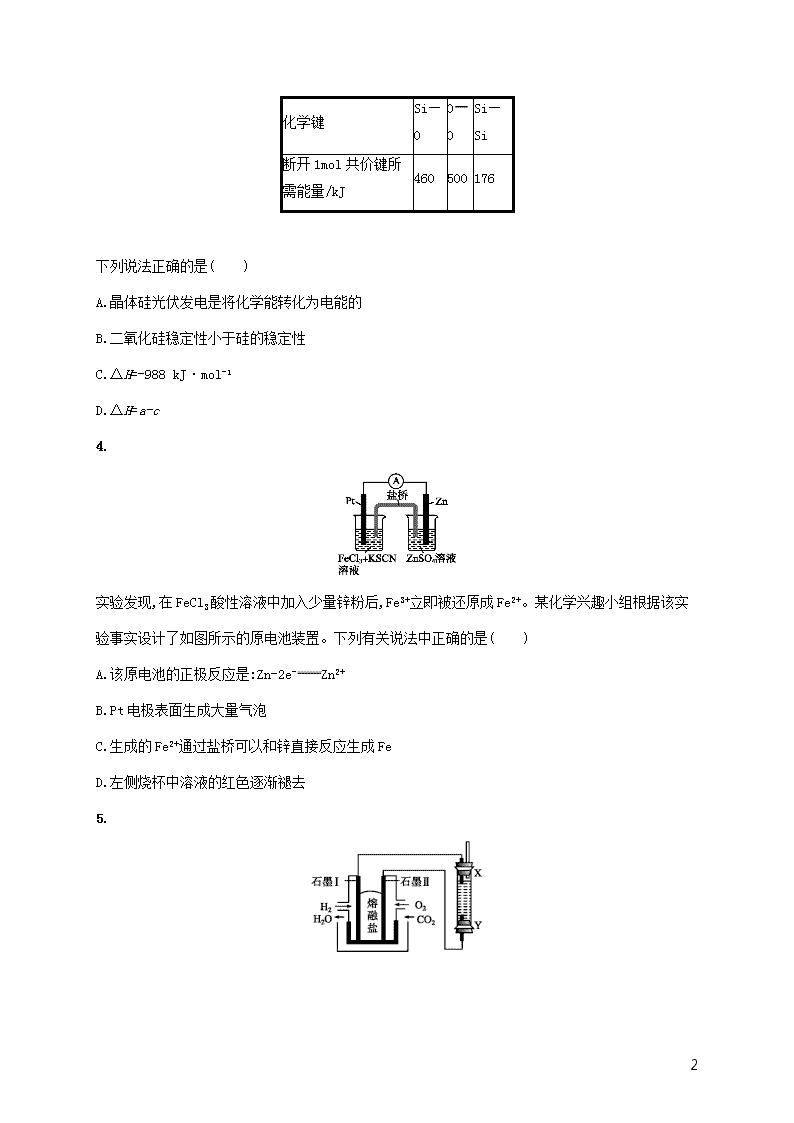
3.已知:①1 mol 晶体硅中含有 2 mol Si—Si 键。②Si(s)+O2(g) SiO2(s) ΔH,其反应过程与
能量变化如图所示。
③几种化学键断裂所需的能量如下,
2
化学键
Si—
O
O
O
Si—
Si
断开 1mol 共价键所
需能量/kJ
460 500 176
下列说法正确的是( )
A.晶体硅光伏发电是将化学能转化为电能的
B.二氧化硅稳定性小于硅的稳定性
C.ΔH=-988 kJ·mol-1
D.ΔH=a-c
4.
实验发现,在 FeCl3 酸性溶液中加入少量锌粉后,Fe3+立即被还原成 Fe2+。某化学兴趣小组根据该实验
事实设计了如图所示的原电池装置。下列有关说法中正确的是( )
A.该原电池的正极反应是:Zn-2e- Zn2+
B.Pt 电极表面生成大量气泡
C.生成的 Fe2+通过盐桥可以和锌直接反应生成 Fe
D.左侧烧杯中溶液的红色逐渐褪去
5.
3
(2019 甘肃武威第十八中学高三期末)以 H2、O2、熔融盐 Na2CO3 组成燃料电池,采用电解法制备
Fe(OH)2,装置如图所示,其中电解池两极材料分别为铁和石墨,通电一段时间后,右侧玻璃管中产生
大量的白色沉淀。则下列说法正确的是( )
A.石墨电极Ⅱ处的电极反应式为 O2+4e- 2O2-
B.X 是铁电极
C.电解池中有 1 mol Fe 溶解,石墨Ⅰ耗 H222.4 L
D.若将电池两极所通气体互换,X、Y 两极材料也要互换
6.
(2019 山东济宁高三期末)锂、铜、空气燃料电池是低成本高效电池。该电池通过一种复杂的铜
“腐蚀”现象产生电能,其中放电过程为 2Li+Cu2O+H2O 2Cu+2Li++2OH-。下列说法不正确的是
( )
A.放电时,Li+透过固体电解质向 Cu 极移动
B.通空气时,铜被腐蚀产生 Cu2O
C.放电时,正极的电极反应式为 Cu2O+2H++2e- 2Cu+H2O
D.整个反应过程中,氧化剂为 O2
二、选择题(本题共 3 小题,每小题 6 分,共 18 分。每小题有一个或两个选项符合题目要求)
7.(2019 浙江临海白云高级中学高三月考)肼(N2H4)在不同条件下分解的产物不同,200 ℃时在 Cu 表
面分解的机理如图 1。已知 200 ℃时:反应Ⅰ:3N2H4(g) N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1,
反应Ⅱ:N2H4(g)+H2(g) 2NH3(g) ΔH2=-41.8 kJ·mol-1,下列说法不正确的是( )
4
A.图Ⅰ所示过程①、②都是放热反应
B.反应Ⅱ的能量过程示意图如图 2 所示
C.断开 3 mol N2H4(g)中的化学键吸收的能量小于形成 1 mol N2(g)和 4 mol NH3(g)中的化学键释放
的能量
D.200 ℃时,肼分解生成氮气和氢气的热化学方程式为 N2H4(g) N2(g)+2H2(g) ΔH=+50.7
kJ·mol-1
8.用多孔石墨电极完成下列实验。下列解释或推理合理的是( )
实
验
续表
现
象
Ⅰ中,a、b 两极均有气
泡产生
Ⅱ,a 极上析出红
色固体
Ⅲ,a 极上析出灰白
色固体
A.Ⅰ中电解一段时间后,c(Na2SO4)一定不变
B.由Ⅱ中反应 H2+Cu2+ Cu↓+2H+可知,用玻璃导管将 H2 通入 CuSO4 溶液中,也会产生红色沉淀
C.Ⅲ中,只可能发生反应 2Ag++Cu Cu2++2Ag
D.Ⅰ中,a 极上既发生了化学变化,也发生了物理变化
9.(2019 天津理综,6)我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图
如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是( )
A.放电时,a 电极反应为 I2Br-+2e- 2I-+Br-
5
B.放电时,溶液中离子的数目增大
C.充电时,b 电极每增重 0.65 g, 溶液中有 0.02 mol I-被氧化
D.充电时,a 电极接外电源负极
三、非选择题(本题共 3 小题,共 46 分)
10.(16 分)课题式研究性学习是培养学生创造性思维的良好方法。某研究性学习小组利用下列装置
进行实验,D、F、X、Y 都是铂电极,C、E 是铁电极。将电源接通后,向乙中滴入酚酞溶液,在 F 极附
近显红色。试回答下列问题:
(1)电源 B 极的名称是 。
(2)甲装置中电解反应的总化学方程式为 。
(3)设电解质溶液过量,则同一时间内 C、D 电极上参加反应的单质或生成的单质的物质的量之比
是 。
(4)欲用丙装置将粗铜(含少量铁、锌等杂质)精炼,G 极材料应该是 (填“粗铜”或“精
铜”),电解质溶液中原电解质的物质的量浓度将 (填“变大”“变小”或“不变”)。
(5)设甲池中溶液的体积在电解前后都是 500 mL,当乙池所产生气体的体积为 4.48 L(标准状况)时,
甲池中所生成物质的物质的量浓度为 mol·L-1。
11.(15 分)能源的开发利用与人类社会的可持续发展息息相关。
(1)用于发射“天宫一号”的长征二号火箭的燃料是液态偏二甲肼(CH3)2N—NH2,氧化剂是液态四氧
化二氮。二者在反应过程中放出大量能量,同时生成无毒、无污染的气体。已知室温下,1 g 燃料完
全燃烧释放出的能量为 42.5 kJ,请写出该反应的热化学方程式 。
(2)依据原电池构成原理,下列化学反应在理论上可以设计成原电池的是 (填序号)。你选择
的理由是 。
A.C(s)+CO2(g) 2CO(g)
6
B.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l)
C.2CO(g)+O2(g) 2CO2(g)
D.2H2O(l) 2H2(g)+O2(g)
(3)若以熔融的 K2CO3 与 CO2 为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极
反应: 。
(4)
工业上常采用如图所示电解装置,利用铁的化合物将气态废弃物中的硫化氢转化为可利用的硫。通
电电解,然后通入 H2S 时发生反应的离子方程式为 2[Fe(CN)6]3-+2CO3
2-+H2S 2[Fe(CN)6]4-
+2HCO3
-+S↓。电解时,阳极的电极反应式为 ;电解过程中阴极区溶液的
pH (填“变大”“变小”或“不变”)。
12.(15 分)工业上通常采取 CO(g)和 H2(g)合成 CH3OH(g)。
(1)已知某温度和压强下,有下列反应:
①2CO(g)+O2(g) 2CO2(g) ΔH=-566.0 kJ·mol-1
②2H2(g)+O2(g) 2H2O(g) ΔH=-483.6 kJ·mol-1
③2CH3OH(g)+3O2(g) 2CO2(g)+4H2O(g) ΔH=-1 275.6 kJ·mol-1
则在相同温度和压强下,CO(g)与 H2(g)合成 CH3OH(g)的热化学方程式
为 。
若反应生成 6.4 g 甲醇,则转移电子的物质的量为 。
7
(2)可利用甲醇燃烧反应设计一个燃料电池。如图,用 Pt 作电极材料,用氢氧化钾溶液作电解质溶
液,在两个电极上分别充入甲醇和氧气。
①写出燃料电池负极的电极反应式 。
②若利用该燃料电池作为电源,在铁件表面镀铜,则铁件应是 极(填“A”或“B”);当铁
件的质量增重 6.4 g 时,燃料电池中消耗氧气的标准状况下体积为 L。
(3)电解法可消除甲醇对水质造成的污染,原理是通电将 Co2+氧化成 Co3+,然后将甲醇氧化成 CO2 和
H+(用石墨烯除去 Co2+)。现用如图所示装置模拟上述过程,则 Co2+在阳极的电极反应式
为 。除去甲醇的离子方程式
为 。
单元质检卷六 化学反应与能量
1.D 在 25℃,101kPa 时,1mol 纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃
烧热,CH4(g)+2O2(g) CO2(g)+2H2O(g)反应中生成的是气态水,所以 A 项错误;因为能量越高越不稳
定,由 C(石墨,s) C(金刚石,s) ΔH>0 可知,金刚石比石墨能量高,所以金刚石不如石墨稳定,故
B 项错误;中和热的本质是在稀溶液中,1mol 氢离子与 1mol 氢氧根反应生成 1mol 水放出的热
量;1mol 稀硫酸和足量稀 NaOH 溶液反应生成 2mol 水,所以该反应热不是中和热,故 C 项错误;同一
物质不同状态的能量不同,气态能量高于固态,则对于 S(g)+O2(g) SO2(g)
ΔH1,S(s)+O2(g) SO2(g) ΔH2,ΔH1<ΔH2。故 D 项正确。
2.C 由 O2 的气态分子变为气态原子,需要断裂分子中的化学键,因此要吸收能量,则ΔH3>0,A 项错
误;根据盖斯定律可知,物质含有的能量只与物质的始态与终态有关,与反应的途径无关,根据物质
转化关系图可知,ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=ΔH6,所以 B 项错误;根据物质转化关系图可
8
知,ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=ΔH6,ΔH1>0,ΔH2>0,ΔH3>0,ΔH4>0,所以ΔH6>ΔH5,C 项正确;根据选项
B 分析可知ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=ΔH6,所以ΔH1+ΔH2+ΔH3+ΔH4+ΔH5-ΔH6=0,D 项错误。
3.C 解析:晶体硅光伏发电是将太阳能转化为电能,选项 A 错误;根据化学键的键能判断,断裂 1mol
二氧化硅中的化学键需要的能量为 4×460kJ=1840kJ,断裂 1mol 晶体硅中的化学键需要的能量为
2×176kJ=352kJ,故二氧化硅稳定性大于硅的稳定性,选项 B 错误;根据题意 Si(s)+O2(g) SiO2(s)
ΔH=(+176×2+500-460×4)kJ·mol-1=-988kJ·mol-1,选项 C 正确;根据图中信息可知,ΔH=-
ckJ·mol-1,选项 D 错误。
4.D 该原电池的正极反应是 Fe3++e- Fe2+,负极反应为 Zn-2e- Zn2+,故 A 项错误;该原电池反应为
Zn+2FeCl3 2FeCl2+ZnCl2,该反应不生成气体,故 B 项错误;原电池中阳离子移向正极,则生成的 Fe2+
在左边的烧杯中,故 C 项错误;左边烧杯中的电极反应为 Fe3++e- Fe2+,则左烧杯中溶液的红色逐渐
褪去,故 D 项正确。
5.D 通入氧气的电极Ⅱ是正极,电极反应式为 O2+4e-+2CO2 2CO3
2-,故 A 项错误;X 是阴极、Y 是阳
极,阴极反应式为 2H2O+2e- H2↑+2OH-,故 X 是石墨电极,故 B 项错误;电解池中阳极电极反应式为
Fe-2e- Fe2+,若有 1molFe 溶解,依据电子转移守恒,在石墨Ⅰ上消耗 1molH2,在标准状况下的体积
是 22.4L,题中未注明标准状况,故 C 项错误;若将电池两极所通气体互换,X、Y 两极材料也互换,则
Y 极产物的氢气能起保护气作用,防止 X 极产生的氢氧化亚铁迅速氧化,实验方案更合理,故 D 项正
确。
6.C 放电时,阳离子向正极移动,则 Li+透过固体电解质向 Cu 极移动,故 A 项正确;放电过程为
2Li+Cu2O+H2O 2Cu+2Li++2OH-,由此可知通空气时,铜被腐蚀,表面产生 Cu2O,故 B 项正确;正极上氧
气得电子生成氢氧根离子,则正极的电极反应式为 O2+4e-+2H2O 4OH-,故 C 项错误;通空气时,铜被
腐蚀,表面产生 Cu2O,放电时 Cu2O 转化为 Cu,则整个反应过程中,铜相当于催化剂,得电子的物质是
氧气,所以氧气为氧化剂,故 D 项正确。
7.A 图 1 中过程①为放热反应,过程②为氨气分解生成氮气和氢气,即为吸热反应,A 项错误;反应
Ⅱ为放热反应,反应物的总能量大于生成物的总能量,能量过程示意图正确,B 项正确;反应 I 为放热
反应,则断开 3molN2H4(g)中的化学键吸收的能量小于形成 1molN2(g)和 4molNH3(g)中的化学键释放
9
的能量,C 项正确;200℃时,肼分解生成氮气和氢气的反应为Ⅰ-Ⅱ×2 可得到 N2H4(g) N2(g)+2H2(g)
ΔH=+50.7kJ·mol-1,D 项正确。
8.AD 若电解池中 Na2SO4 溶液是饱和溶液,电解 Na2SO4 溶液相当于电解水,电解一段时间后,Na2SO4 溶
液仍是饱和溶液,浓度不变,A 项正确;由Ⅱ中现象可知发生反应 H2+Cu2+ Cu↓+2H+,这个反应发生的
前提是电极从电解池刚取出,外界条件强加电子给铜,强行拿掉氢中的电子,因而反应才发生,但氢
气通入 CuSO4 溶液中不会发生反应,B 项错误;Ⅲ中,由于迅速从Ⅱ中取出,也可能发生反应
2Ag++H2 2H++2Ag↓,C 项错误;a 极上发生的电极反应是氢离子得到电子转化为氢气,是化学变化,
产生的氢气又被吸附在多孔石墨电极上是物理变化,D 项正确。
9.D 根据离子和电子的移动方向可知,a 电极是正极,b 电极是负极。放电时,负极电极反应为 Zn-
2e- Zn2+,正极电极反应为 I2Br-+2e- 2I-+Br-,显然 A、B 正确;充电时,b 电极电极反应为 Zn2++2e-
Zn,每增重 0.65g 转移 0.02mole-,根据以上分析,可知溶液中有 0.02molI-被氧化,C 正确;充电时,
阳极接电源正极,故 D 错误。
10.答案:(1)负极 (2)CuSO4+Fe Cu+FeSO4 (3)1∶1 (4)粗铜 变小 (5)0.4
解析:(1)根据题意知将电源接通后,向乙中滴入酚酞溶液,在 F 极附近显红色,说明溶液呈碱性,则 F
为电解池的阴极,则电源 B 极的名称是负极。
(2)甲装置是以铁为阳极、以铂为阴极电解硫酸铜溶液,电解反应的总化学方程式为
CuSO4+Fe Cu+FeSO4。
(3)根据(2)的反应方程式知同一时间内 C 极上参加反应的铁的物质的量与 D 电极上生成铜单
质的物质的量相同,则物质的量之比是 1∶1。
(4)欲用丙装置将粗铜(含少量铁、锌等杂质)精炼,粗铜作阳极,精铜作阴极,G 极材料应该是粗
铜,阳极上铜和铁、锌等金属失电子生成金属阳离子进入电解质溶液,阴极上铜离子得电子生成铜
单质,根据电子守恒知电解质溶液中原电解质的物质的量浓度将变小。
(5)乙池中 E 为阳极,电极反应为 Fe-2e- Fe2+,F 为阴极,电极反应为 2H++2e- H2↑,当乙池所
产生氢气的体积为 4.48L(标准状况)时,其物质的量为 0.2mol,所以乙池转移电子为 0.4mol,甲池中
阳极是铁失电子生成亚铁离子,则生成硫酸亚铁的浓度为0.2mol
0.5L =0.4mol·L-1。
10
11.答案:(1)C2H8N2(l)+2N2O4(l) 2CO2(g)+3N2(g)+4H2O(l)
ΔH=-2 550 kJ·mol-1
(2)C 该反应为氧化还原反应且为放热反应
(3)CO-2e-+CO3
2- 2CO2
(4)[Fe(CN)6]4--e- [Fe(CN)6]3- 变大
解析:(1)1g 燃料完全燃烧释放出的能量为 42.5kJ,则 1mol 偏二甲肼完全燃烧释放出的能量为
42.5kJ×60=2550kJ,该反应的热化学方程式为 C2H8N2(l)+2N2O4(l) 2CO2(g)+3N2(g)+4H2O(l)
ΔH=-2550kJ·mol-1。
(2)C(s)+H2O(g) CO(g)+H2(g)为氧化还原反应,但该反应为吸热反应,不能设计为原电池,故 A
项错误;NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l)不属于氧化还原反应,不能设计为原电池,故 B 项错
误;2CO(g)+O2(g) 2CO2(g)为放热反应,且为氧化还原反应,故可以设计成原电池,故 C 项正
确;2H2O(l) 2H2(g)+O2(g)为吸热反应,不能设计成原电池,故 D 项错误。
(3)若为一氧化碳燃料电池,在熔融的 K2CO3 与 CO2 为反应的环境中,传导离子为碳酸根离子,负
极是一氧化碳失电子生成二氧化碳,则电极反应为 CO-2e-+CO3
2- 2CO2。
(4)电解时,阳极的电极反应式为[Fe(CN)6]4--e- [Fe(CN)6]3-,电解时阴极反应式为 2HCO3
-+2e-
H2↑+2CO3
2-,由于 CO3
2-的水解程度大于 HCO3
-,所以溶液碱性增强,则 pH 变大。
12.答案:(1)CO(g)+2H2(g) CH3OH(g) ΔH=-128.8 kJ·mol-1 0.8 mol
(2)CH3OH-6e-+8OH- CO3
2-+6H2O B 1.12
(3)Co2+-e- Co3+ 6Co3++CH3OH+H2O CO2↑+6Co2++6H+
解析:(1)①2CO(g)+O2(g) 2CO2(g) ΔH=-566.0kJ·mol-1,②2H2(g)+O2(g) 2H2O(g) ΔH=-
483.6kJ·mol-1,③2CH3OH(g)+3O2(g) 2CO2(g)+4H2O(g) ΔH=-1275.6kJ·mol-1。根据盖斯定律,由
①×1
2+②-③×1
2可得,CO(g)+2H2(g) CH3OH(g) ΔH=-128.8kJ·mol-1。由反应式
CO(g)+2H2(g) CH3OH(g)可知,每生成 1mol 甲醇转移 4mol 电子,所以生成 6.4g 甲醇,转移电子的物
质的量为 6.4g
32g·mol-1×4=0.8mol。
11
(2)①用 Pt 作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气,甲
醇在负极失电子在碱溶液中生成 CO3
2-和 H2O,则负极的电极反应式为 CH3OH-6e-+8OH- CO3
2-+6H2O。②
利用该燃料电池作为电源,与右边烧杯相连,在铁件表面镀铜,则铁件作电解池的阴极,阴极与电源
负极连接,装置图中与甲醇相连的 B 电极是阴极;当铁件的质量增重 6.4g 时,根据反应 Cu2++2e- Cu
可知,电子转移 0.2mol,燃料电池中消耗氧气的电极反应为 O2+2H2O+4e- 4OH-,根据转移电子守恒计
算消耗氧气的物质的量为0.2mol
4 =0.05mol,标准状况下的体积为 0.05mol×22.4L·mol-1=1.12L。
(3)通电后,将 Co2+氧化成 Co3+,电解池中阳极失电子发生氧化反应,电极反应式为 Co2+-e- Co3+;
以 Co3+作氧化剂把水中的甲醇氧化成 CO2 而净化,Co3+被还原为 Co2+,由原子守恒与电荷守恒可以知道,
还原生成 H+,则除去甲醇的离子方程式为 6Co3++CH3OH+H2O CO2↑+6Co2++6H+。
相关文档
- 2019春八年级语文下册第二单元检测2021-04-17 10:35:2031页
- 五年级下册语文试题 第八单元检测2021-04-17 10:01:174页
- 2020-2021九年级物理全册单元检测2021-04-17 02:52:1630页
- (山西专版)八年级语文上册第四单元检2021-04-17 01:46:0637页
- 小学语文部编版一年级上册第三单元2021-04-16 23:58:345页
- 2020版高中历史 第4章 欧洲文艺复2021-04-16 22:42:366页
- (通用版)七年级语文上册第二单元检测2021-04-16 21:20:3248页
- 二年级上册数学单元测试-第三单元2021-04-16 20:49:1210页
- 人教部编版七年级下册道德与法治-2021-04-16 19:11:336页
- 七年级语文上册第四单元检测卷课件2021-04-16 18:14:0547页