- 2.72 MB
- 2021-04-17 发布
专题六 化学反应与能量
考点一 化学能与热能
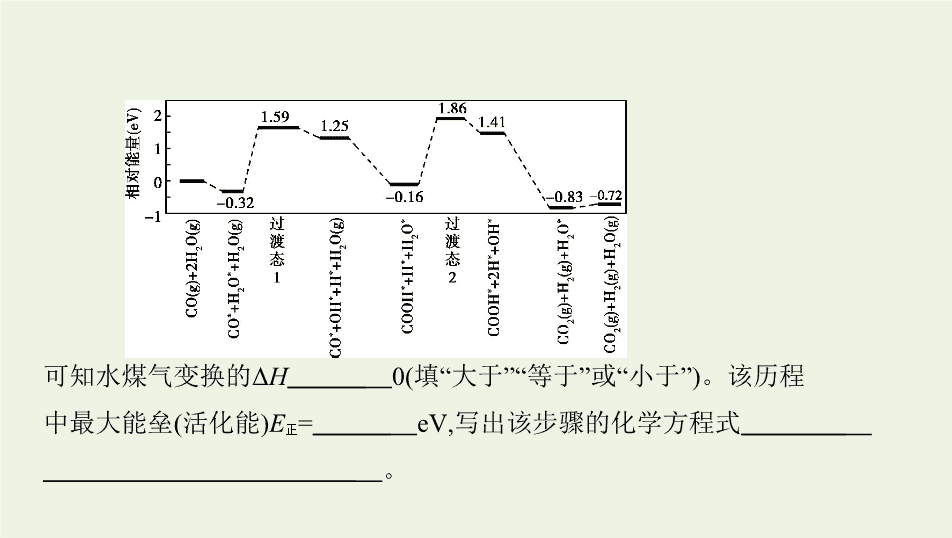
1.(2019课标Ⅰ,28节选)水煤气变换[CO(g)+H
2
O(g)
CO
2
(g)+H
2
(g)]是重要
的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下
列问题:
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变
换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
可知水煤气变换的Δ
H
0(填“大于”“等于”或“小于”)。该历程
中最大能垒(活化能)
E
正
=
eV,写出该步骤的化学方程式
。
答案
(3)小于 2.02 COOH
*
+H
*
+H
2
O
*
COOH
*
+2H
*
+OH
*
(或H
2
O
*
H
*
+OH
*
)
解析
观察计算机模拟结果,据Δ
H
=生成物总能量-反应物总能量,可知Δ
H
=
-0.72-0<0;该历程中最大能垒(活化能)
E
正
=1.86 eV-(-0.16 eV)=2.02 eV,该步骤
的化学方程式为COOH
*
+H
*
+H
2
O
*
COOH
*
+2H
*
+OH
*
或H
2
O
*
H
*
+OH
*
。
2.(2019课标Ⅲ,28节选)(2)Deacon直接氧化法可按下列催化过程进行:
CuCl
2
(s)
CuCl(s)+
Cl
2
(g) Δ
H
1
=83 kJ·mol
-1
CuCl(s)+
O
2
(g)
CuO(s)+
Cl
2
(g)
Δ
H
2
=-20 kJ·mol
-1
CuO(s)+2HCl(g)
CuCl
2
(s)+H
2
O(g)
Δ
H
3
=-121 kJ·mol
-1
则4HCl(g)+O
2
(g)
2Cl
2
(g)+2H
2
O(g)的Δ
H
=
kJ·mol
-1
。
答案
-116
解析
将题给反应过程依次记为①、②、③,则根据盖斯定律,由③
×
2+②
×
2
+①
×
2可得到4HCl(g)+O
2
(g)
2Cl
2
(g)+2H
2
O(g) Δ
H
=2Δ
H
3
+2Δ
H
2
+2Δ
H
1
=
-116 kJ·mol
-1
。
3.(2018课标Ⅲ,28节选)(2)SiHCl
3
在催化剂作用下发生反应:
2SiHCl
3
(g)
SiH
2
Cl
2
(g)+SiCl
4
(g) Δ
H
1
=48 kJ·mol
-1
3SiH
2
Cl
2
(g)
SiH
4
(g)+2SiHCl
3
(g) Δ
H
2
=-30 kJ·mol
-1
则反应4SiHCl
3
(g)
SiH
4
(g)+3SiCl
4
(g)的Δ
H
为
kJ·mol
-1
。
答案
(2)114
解析
(2)由盖斯定律可知Δ
H
=3Δ
H
1
+Δ
H
2
=3
×
48 kJ·mol
-1
-30 kJ·mol
-1
=114 kJ·mol
-1
。
4.(2017课标Ⅰ,28节选)下图是通过热化学循环在较低温度下由水或硫化氢
分解制备氢气的反应系统原理。
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为
、
,制得
等量H
2
所需能量较少的是
。
答案
H
2
O(l)
H
2
(g)+
O
2
(g) Δ
H
=286 kJ·mol
-1
H
2
S(g)
H
2
(g)+S(s)
Δ
H
=20 kJ·mol
-1
系统(Ⅱ)
解析
将系统(Ⅰ)、(Ⅱ)中的三个热化学方程式均直接相加即可得到答案。
5. (201
3
山东理综,
12
,
4
分)对于反应CO(g)+H
2
O(g)
CO
2
(g)+H
2
(g) Δ
H
<0,在其他条件不变的情况下
(
B
)
A.加入催化剂,改变了反应的途径,反应的Δ
H
也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
答案
B Δ
H
的大小取决于反应的始态和终态,与反应途径无关,A项错误;升
高温度,平衡逆向移动,反应放出的热量减少,C项错误;若反应在原电池中进
行,化学能会转化为电能,D项错误。
一、反应热及其表示方法
1.理解化学反应热效应的两种角度
(1)从微观的角度说,反应热是旧化学键断裂吸收的能量与新化学键形成放出
的能量的差值,如下图所示:
a
表示旧化学键断裂吸收的能量;
b
表示新化学键形成放出的能量;
c
表示反应热。
(2)从宏观的角度说,反应热是反应物自身的能量与生成物能量的差值,在上
图中:
a
表示正反应的活化能;
b
表示逆反应的活化能;
c
表示反应热。
2.计算反应热的三种方法
(1)Δ
H
=生成物的总能量-反应物的总能量
(2)Δ
H
=正反应的活化能-逆反应的活化能
(3)Δ
H
=反应物的总键能-生成物的总键能
3.反应热的表示方法——热化学方程式
热化学方程式的书写及正误判断的思维模式
(1)书写一般分三步。
(2)正误判断要做到“五审”。
特别提醒
对于具有同素异形体的物质,除了要注明聚集状态外,还要注明物
质的名称。
如:①S(单斜,s)+O
2
(g)
SO
2
(g) Δ
H
1
=-297.16 kJ·mol
-1
②S(正交,s)+O
2
(g)
SO
2
(g) Δ
H
2
=-296.83 kJ·mol
-1
二、盖斯定律及其应用
1.定律内容
一定条件下,一个反应不管是一步完成,还是分几步完成,其反应热相同,即化
学反应的反应热与反应途径无关,只与反应体系的始态和终态有关。
2.常用关系式
热化学方程式
焓变之间的关系
a
A
B Δ
H
1
A
B Δ
H
2
Δ
H
2
=
Δ
H
1
或Δ
H
1
=
a
Δ
H
2
a
A
B Δ
H
1
B
a
A Δ
H
2
Δ
H
1
=-Δ
H
2
Δ
H
=Δ
H
1
+Δ
H
2
考向一 化学反应中的能量变化与图像分析
1.(2019山东烟台期末)“钙基固硫”是将煤中的硫元素以CaSO
4
的形式固定
脱硫,而煤炭燃烧过程中产生的CO又会发生反应Ⅰ和反应Ⅱ,导致脱硫效率
降低。某温度下,反应Ⅰ的速率(
v
1
)大于反应Ⅱ的速率(
v
2
),则下列反应过程能
量变化示意图正确的是
( )
反应Ⅰ:CaSO
4
(s)+CO(g)
CaO(s)+SO
2
(g)+CO
2
(g) Δ
H
1
=+218.4 kJ·mol
-1
反应Ⅱ:CaSO
4
(s)+4CO(g)
CaS(s)+4CO
2
(g)
Δ
H
2
=-175.6 kJ·mol
-1
答案
A 反应Ⅰ为吸热反应,说明反应Ⅰ生成物的总能量比反应物的总能
量高,B、C项错误;反应Ⅰ的速率(
v
1
)大于反应Ⅱ的速率(
v
2
),则说明反应Ⅰ的
活化能较小,反应Ⅱ的活化能较大,D项错误、A项正确。
2.(2019山东德州期末)已知2SO
2
(g)+O
2
(g)
2SO
3
(g) Δ
H
=-198 kJ/mol,在
V
2
O
5
存在时反应过程中的能量变化如图所示。下列叙述正确的是
( )
A.Δ
H
=
E
4
-
E
3
+
E
2
-
E
1
B.加入V
2
O
5
后反应经过两步完成,其中第一步决定反应速率
C.加入V
2
O
5
,Δ
H
不变,但反应速率改变
D.向密闭容器中充入2 mol SO
2
和1 mol O
2
,发生上述反应达平衡时,反应放热
198 kJ
答案
C 根据图示可知:反应的焓变为吸收能量与放出能量的差值,Δ
H
=
E
1
-
E
2
+
E
3
-
E
4
,A项错误;多步反应的反应速率由慢反应决定,由题图可知,加入V
2
O
5
后第二步反应发生需要的能量高,反应速率慢,所以反应速率由第二步反应决
定,B项错误;催化剂不能改变反应物、生成物的总能量,所以Δ
H
不变,但催化
剂能改变反应途径,所以使用催化剂后反应速率改变,C项正确;该反应是可逆
反应,反应物不能完全转化为生成物,所以向密闭容器中充入2 mol SO
2
和1 mol
O
2
,发生题述反应达平衡时,反应放出的热量小于198 kJ,D项错误。
考向二 热化学方程式的书写与盖斯定律
3.(2019山东济南莱芜期末)向足量H
2
SO
4
溶液中加入100 mL 0.4 mol·L
-1
Ba(OH)
2
溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)
2
溶液中加入100 mL 0.4 mol·L
-1
HCl溶液时,放出的热量为2.2 kJ,则Na
2
SO
4
溶液与BaCl
2
溶液反应的热化学方程
式为
(
D
)
A.Ba
2+
(aq)+S
(aq)
BaSO
4
(s) Δ
H
=-2.92 kJ·mol
-1
B.Ba
2+
(aq)+S
(aq)
BaSO
4
(s) Δ
H
=-0.72 kJ·mol
-1
C.Ba
2+
(aq)+S
(aq)
BaSO
4
(s) Δ
H
=-73 kJ·mol
-1
D.Ba
2+
(aq)+S
(aq)
BaSO
4
(s) Δ
H
=-18 kJ·mol
-1
答案
D 题中两反应的热化学方程式分别为2H
+
(aq)+2OH
-
(aq)+Ba
2+
(aq)+
S
(aq)
BaSO
4
(s)+2H
2
O(l) Δ
H
=-128 kJ·mol
-1
①,H
+
(aq)+OH
-
(aq)
H
2
O(l) Δ
H
=-55 kJ·mol
-1
②,①-2
×
②即可得答案。
4.(2019山东临沂一模)Li/Li
2
O体系的能量循环图如图所示。下列说法正确的
是
( )
A.Δ
H
3
<0
B.Δ
H
3
+Δ
H
4
+Δ
H
5
=Δ
H
6
C.Δ
H
6
>Δ
H
5
D.Δ
H
l
+Δ
H
2
+Δ
H
3
+Δ
H
4
+Δ
H
5
+Δ
H
6
=0
答案
C 由O
2
的气态分子变为气态原子,需要断裂分子中的化学键,因此要
吸收能量,Δ
H
3
>0,A项错误;根据盖斯定律可知,化学反应的反应热只与物质的
始态与终态有关,与反应途径无关,根据能量循环图可知Δ
H
1
+Δ
H
2
+Δ
H
3
+Δ
H
4
+
Δ
H
5
=Δ
H
6
,B项错误;根据能量循环图可知Δ
H
1
+Δ
H
2
+Δ
H
3
+Δ
H
4
+Δ
H
5
=Δ
H
6
,Δ
H
1
>
0,Δ
H
2
>0,Δ
H
3
>0,Δ
H
4
>0,所以Δ
H
6
>Δ
H
5
,C项正确;根据选项B分析可知Δ
H
1
+Δ
H
2
+
Δ
H
3
+Δ
H
4
+Δ
H
5
-Δ
H
6
=0,D项错误。
5.(2019湖南衡阳第二次联考)汽车尾气排放的CO、NO
x
等气体是大气污染的
主要来源,NO
x
也是雾霾天气的主要成因之一。
科学家研究利用催化技术将尾气中有害的NO和CO转变成无毒的气体,其热
化学方程式为2CO(g)+2NO(g)
2CO
2
(g)+N
2
(g) Δ
H
1
=-746.5 kJ·mol
-1
。
已知:2C(s)+O
2
(g)
2CO(g) Δ
H
2
=-221.0 kJ·mol
-1
;
CO
2
(g)
C(s)+O
2
(g) Δ
H
3
=+393.5 kJ·mol
-1
。
(1)C(s)的燃烧热为
。
(2)NO(g)分解成两种气体单质的热化学方程式为
。
答案
(1)393.5 kJ·mol
-1
(2)2NO(g)
O
2
(g)+N
2
(g) Δ
H
=-180.5 kJ·mol
-1
解析
(1)根据CO
2
(g)
C(s)+O
2
(g) Δ
H
3
=+393.5 kJ·mol
-1
,可知C(s)+O
2
(g)
CO
2
(g) Δ
H
=-393.5 kJ·mol
-1
,所以C(s)的燃烧热为393.5 kJ·mol
-1
。
(2)将已知热化学方程式由上到下依次编号为Ⅰ、Ⅱ、Ⅲ,根据盖斯定律Ⅰ+
Ⅱ+Ⅲ
×
2得 2NO(g)
O
2
(g)+N
2
(g) Δ
H
=-180.5 kJ·mol
-1
。
考点二 原电池原理 金属的电化学腐蚀与防护
1.(2019课标Ⅰ,12,6分)利用生物燃料电池原理研究室温下氨的合成,电池工
作时MV
2+
/MV
+
在电极与酶之间传递电子,示意图如下所示。下列说法错误的
是
( )
A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
B.阴极区,在氢化酶作用下发生反应H
2
+2MV
2+
2H
+
+2MV
+
C.正极区,固氮酶为催化剂,N
2
发生还原反应生成NH
3
D.电池工作时质子通过交换膜由负极区向正极区移动
答案
B A项,现有工业合成氨的反应条件是高温、高压、催化剂,则题述
方法合成氨条件更为温和,同时可将化学能转化为电能,正确;B项,阴(正)极
区,在固氮酶催化作用下发生反应N
2
+6H
+
+6MV
+
2NH
3
+6MV
2+
,错误;C项,
由B项分析可知正极区N
2
被还原为NH
3
,正确;D项,原电池工作时,质子(H
+
)通
过交换膜由负极区向正极区移动,正确。
2.(2019课标Ⅲ,13,6分)为提升电池循环效率和稳定性,科学家近期利用三维
多孔海绵状Zn(3D-Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的
3D-Zn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+
H
2
O(l)
ZnO(s)+2Ni(OH)
2
(s)。
下列说法错误的是
(
D
)
A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B.充电时阳极反应为Ni(OH)
2
(s)+OH
-
(aq)-e
-
NiOOH(s)+H
2
O(l)
C.放电时负极反应为Zn(s)+2OH
-
(aq)-2e
-
ZnO(s)+H
2
O(l)
D.放电过程中OH
-
通过隔膜从负极区移向正极区
答案
D A项,依题干信息可知正确;B项,充电时阳极发生氧化反应,正确;C项,放电时Zn作负极失去电子,发生氧化反应,正确;D项,放电时,OH
-
由正极区向负极区迁移。
3.(2018课标Ⅲ,11,6分)一种可充电锂—空气电池如图所示。当电池放电时,O
2
与Li
+
在多孔碳材料电极处生成Li
2
O
2-
x
(
x
=0或1)。下列说法正确的是
( )
A.放电时,多孔碳材料电极为负极
B.放电时,外电路电子由多孔碳材料电极流向锂电极
C.充电时,电解质溶液中Li
+
向多孔碳材料区迁移
D.充电时,电池总反应为Li
2
O
2-
x
2Li+(1-
)O
2
↑
答案
D 本题考查原电池原理和电解原理的综合运用。A项,依据题意和
可充电电池装置图判断出,放电时锂电极作负极,多孔碳材料电极作正极,错
误;B项,在原电池中,外电路电子由负极流向正极,即放电时,外电路电子由锂
电极流向多孔碳材料电极,错误;C项,充电时,电解质溶液中的阳离子向阴极
区迁移,即Li
+
向锂电极区迁移,错误;D项,充电时,Li
+
在阴极区得到电子生成Li,
阳极区生成O
2
,即电池总反应为Li
2
O
2-
x
2Li+(1-
)O
2
↑,正确。
4. (201
2
山东理综,
13
,
4
分)下列与金属腐蚀有关的说法正确的是(
B
)
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO
2
干电池自放电腐蚀主要是由MnO
2
的氧化作用引起的
答案
B A项,因液面处氧气的浓度大且与海水接触,故在液面处铁棒腐蚀
最严重;C项,接通开关后形成原电池,Zn的腐蚀速率增大,H
+
在Pt电极上放电
产生H
2
;D项,干电池自放电腐蚀是NH
4
Cl水解产生的H
+
的氧化作用引起的。
1.原电池
(1)图解原电池工作原理
(2)单液电池和双液电池的区别与联系
装置1为单液电池,装置2为双液电池。
比较内容
单液原电池
双液原电池
相同点
正负极、电极反应、电池反应和电极现象
不同点
无盐桥
有盐桥
反应:两极反应在相同区域
反应:两极反应在不同区域
特别提醒
①无论装置1还是装置2,电子均不能通过电解质溶液。
②装置2能避免Zn与Cu
2+
直接发生反应,防止化学能转化为热能,故装置2比装
置1能量转化率高。
③装置2中盐桥的作用:a.将正、负极反应物隔开,避免直接接触,导致电流不
稳定;b.通过离子的定向移动,构成闭合回路;c.平衡电极区的电荷。
(3)原电池正极和负极的5种判定方法
(4)微粒流向
①电子流向:负极→正极(与电流的方向正好相反),电子沿导线传递但不能通
过电解质溶液。
②离子流向:阳离子移向正极,阴离子移向负极。
2.金属的电化学腐蚀与防护
(1)钢铁的吸氧腐蚀与析氢腐蚀
吸氧腐蚀
析氢腐蚀
条件
水膜呈弱酸性或中性
水膜酸性较强
负极反应
2Fe-4e
-
2Fe
2+
Fe-2e
-
Fe
2+
正极反应
O
2
+2H
2
O+4e
-
4OH
-
2H
+
+2e
-
H
2
↑
总反应
2Fe+O
2
+2H
2
O
2Fe(OH)
2
Fe+2H
+
Fe
2+
+H
2
↑
②覆盖保护层。
③使用电化学保护法
(2)金属的防护
①改变金属的内部结构,增强抗腐蚀能力。
考向一 常考常新的一次电池
1.(2019四川高中教考联盟二诊)一种测定O
2
含量的气体传感器如图所示。传
感器工作时,仅Ag
+
能在α-AgI晶体里迁移,O
2
透过聚四氟乙烯进入传感器,AgI
的物质的量增加。下列有关说法不正确的是
( )
A.正极反应为I
2
+2Ag
+
+2e
-
2AgI
B.负极反应为Ag+I
-
-e
-
AgI
C.电位计读数越大,O
2
含量越高
D.部分AlI
3
固体变为Al
2
O
3
固体
答案
B 仅Ag
+
能在α-AgI晶体里迁移,O
2
透过聚四氟乙烯进入传感器,AgI
的物质的量增加,则AlI
3
固体减少(发生了反应4AlI
3
+3O
2
6I
2
+2Al
2
O
3
),故负
极反应为Ag-e
-
Ag
+
,正极反应为I
2
+2Ag
+
+2e
-
2AgI,故B选项不正
确,A、D选项正确;O
2
浓度越大,生成的I
2
越多,穿过电位计的电子越多,故C选
项正确。
2.(2019山东济南一模)下图为利用电化学方法处理有机废水的原理示意图。
下列说法正确的是
(
D
)
A.a、b极不能使用同种电极材料
B.工作时,a极的电势低于b极的电势
C.工作一段时间之后,a极区溶液的pH增大
D.b极的电极反应式为:CH
3
COO
-
+4H
2
O-8e
-
2HC
+9H
+
答案
D 电极a、b上发生的反应不同,因而两极间形成电势差,故电极材料
可同可异,A项错误;工作时,电极b上CH
3
COO
-
→HC
,碳元素从平均0价升至
+4价,电极b是原电池的负极,则电极a是原电池的正极,a极的电势高于b极的
电势,B项错误;电极a(正极)的电极反应为
+Cl
-
,正极每得到2 mol 电子时,为使溶液呈电中性,必有
2 mol H
+
通过质子交换膜进入a极溶液,同时电极反应消耗1 mol H
+
,故工作一
段时间之后,a极区溶液中H
+
浓度增大,pH减小,C项错误。
方法归纳
信息型原电池的电极反应式的书写步骤
(1)找位置,写式子:负极上应符合“还原剂-
n
e
-
氧化产物”的形式;正极
上应符合“氧化剂+
n
e
-
还原产物”形式。
(2)查电荷,添离子:检查(1)中得到的式子电荷是否守恒,若不守恒,可添加必要
的离子,如H
+
或OH
-
。
(3)查原子,添物质:检查原子是否守恒,若不守恒且反应是在溶液中进行的话,
可添加水。
考向二 “久考不衰”的二次电池
3.(2019天津理综,6,6分)我国科学家研制了一种新型的高比能量锌-碘溴液流
电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容
量。下列叙述
不正确
的是
( )
A.放电时,a电极反应为I
2
Br
-
+2e
-
2I
-
+Br
-
B.放电时,溶液中离子的数目增大
C.充电时,b电极每增重0.65 g,溶液中有0.02 mol I
-
被氧化
D.充电时,a电极接外电源负极
答案
D 由工作原理示意图中Zn
2+
迁移的方向可判断放电时a为正极,b为负
极。放电时,a极得到电子,发生还原反应,使溶液中离子数目增大,A、B项正
确;充电时,a极接外接电源的正极,D项错误;充电时,b极为阴极,电极反应式为
Zn
2+
+2e
-
Zn,每增重0.65 g,转移0.02 mol电子,a极为阳极,电极反应式为2I
-
+Br
-
-2e
-
I
2
Br
-
,转移0.02 mol电子,有0.02 mol I
-
被氧化,C项正确。
4.(2019河北石家庄二模)如图是新型镁—锂双离子二次电池。下列关于该电
池的说法不正确的是
( )
A.放电时,Li
+
由左向右移动
B.放电时,正极的电极反应式为Li
1-
x
FePO
4
+
x
Li
+
+
x
e
-
LiFePO
4
C.充电时,外加电源的正极与Y相连
D.充电时,导线上每通过1 mol e
-
,左室溶液质量减轻12 g
答案
D 放电时,左边镁电极为负极,右边电极为正极,阳离子移向正极,所
以Li
+
由左向右移动,故A正确;放电时,右边为正极,得电子发生还原反应,电极
反应式为Li
1-
x
FePO
4
+
x
Li
+
+
x
e
-
LiFePO
4
,故B正确;充电时,外加电源的正极
与原电池正极相连,故C正确;充电时,左室得电子发生还原反应,电极反应式
为Mg
2+
+2e
-
Mg,导线上每通过1 mol e
-
,右侧将有1 mol Li
+
移向左室,所以
左室溶液质量减轻12 g-7 g=5 g,故D错误。
规律总结
二次电池充、放电的电极判断
二次电池充电时,“正接正、负接负”;放电时的正极为充电时的阳极;放电
时的负极为充电时的阴极。如下图所示:
考向三 金属的腐蚀与防护
5.(2019江苏单科,10,2分)将铁粉和活性炭的混合物用NaCl溶液湿润后,置于
如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的
是
( )
A.铁被氧化的电极反应式为Fe-3e
-
Fe
3+
B.铁腐蚀过程中化学能全部转化为电能
C.活性炭的存在会加速铁的腐蚀
D.以水代替NaCl溶液,铁不能发生吸氧腐蚀
答案
C 铁作负极,Fe-2e
-
Fe
2+
,A不正确;电化学腐蚀过程中化学能不可
能全部转化为电能,还有部分转化为热能,B不正确;活性炭的存在构成了原电
池,加快了负极铁的腐蚀,C正确;以水代替NaCl溶液,铁仍然能发生吸氧腐蚀,
只是吸氧腐蚀的速率会减慢,D不正确。
6.(2019上海单科,17,2分)关于下列装置,叙述错误的是
(
A
)
A.石墨电极反应O
2
+4H
+
+4e
-
2H
2
O
B.鼓入少量空气,会加快Fe的腐蚀
C.加入少量NaCl,会加快Fe的腐蚀
D.加入HCl,石墨电极反应式:2H
+
+2e
-
H
2
↑
答案
A A项,该原电池装置的电解质溶液是接近中性的自来水,石墨电极
反应式为O
2
+2H
2
O+4e
-
4OH
-
,故错误;B项,鼓入空气,水中O
2
浓度增大,O
2
得电子机会增大,会加快Fe的腐蚀,故正确;C项,加入少量NaCl,增加电解质溶
液的导电性,会加快Fe的腐蚀,故正确;D项,加入HCl后,电解质溶液中存在大
量H
+
,石墨电极反应式为2H
+
+2e
-
H
2
↑,故正确。
考点三 电解原理及其应用
1.(2019课标Ⅱ,27节选)(4)环戊二烯可用于制备二茂铁[Fe(C
5
H
5
)
2
,结构简式为
],后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图
所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰
性有机溶剂)。
该电解池的阳极为
,总反应为
。电解制备需要在无水条件下进行,原因为
。
答案
(4)Fe电极
水会阻碍中间物Na的
生成;水会电解生成OH
-
,进一步与Fe
2+
反应生成Fe(OH)
2
解析
根据反应历程可知,铁电极溶解生成了Fe
2+
,故应让Fe电极作电解池的
阳极;由反应历程可知,反应物为Fe与环戊二烯,生成物为二茂铁和H
2
,再根据
原子守恒写出总反应式;根据反应历程中有Na生成,水会与Na反应,从而中止
反应,且电解过程中水会在阴极生成OH
-
,进一步与Fe
2+
反应生成Fe(OH)
2
。
2.(2019课标Ⅲ,28节选)(4)在传统的电解氯化氢回收氯气技术的基础上,科学
家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和
化学过程,如下图所示:
负极区发生的反应有
(写反应方程式)。电路中转移1 mol电子,需消耗氧气
L(标准状况)。
答案
(4)Fe
3+
+e
-
Fe
2+
,4Fe
2+
+O
2
+4H
+
4Fe
3+
+2H
2
O 5.6
解析
负极区发生的是得电子的还原反应,故负极区的反应有Fe
3+
+e
-
Fe
2+
、4Fe
2+
+O
2
+4H
+
4Fe
3+
+2H
2
O;根据得失电子守恒得出关系式:
Fe
3+
~e
-
~Fe
2+
~
O
2
1 mol 0.25 mol
n
(O
2
)=0.25 mol,标准状况下体积为5.6 L。
3.(2018课标Ⅰ,13,6分)最近我国科学家设计了一种CO
2
+H
2
S协同转化装置,实
现对天然气中CO
2
和H
2
S的高效去除。示意图如下图所示,其中电极分别为
ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
①EDTA-Fe
2+
-e
-
EDTA-Fe
3+
②2EDTA-Fe
3+
+H
2
S
2H
+
+S+2EDTA-Fe
2+
该装置工作时,下列叙述错误的是
(
C
)
A.阴极的电极反应:CO
2
+2H
+
+2e
-
CO+H
2
O
B.协同转化总反应:CO
2
+H
2
S
CO+H
2
O+S
C.石墨烯上的电势比ZnO@石墨烯上的低
D.若采用Fe
3+
/Fe
2+
取代EDTA-Fe
3+
/EDTA-Fe
2+
,溶液需为酸性
答案
C 本题考查电解原理的应用。由石墨烯电极区反应①可知该极发
生氧化反应,为阳极,则ZnO@石墨烯为阴极。阴极的电极反应为:CO
2
+2H
+
+
2e
-
CO+H
2
O,A正确;装置工作时涉及三个反应,Fe
2+
与Fe
3+
的转化循环进行,
总反应为CO
2
与H
2
S之间的反应,根据得失电子守恒可知总反应为:CO
2
+H
2
S
CO+H
2
O+S,B正确;石墨烯与电源正极相连,ZnO@石墨烯与电源负极相
连,故石墨烯上的电势比ZnO@石墨烯上的高,C错误;Fe
2+
、Fe
3+
均在酸性环境
中稳定存在,D正确。
4. (201
1
山东理综,
15
,
4
分)以KCl和ZnCl
2
混合液为电镀液在铁制品上镀锌,下列说法正确的是(
C
)
A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程
B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系
C.电镀时保持电流恒定,升高温度不改变电解反应速率
D.镀锌层破损后即对铁制品失去保护作用
答案
C A项,该装置中没有自发的氧化还原反应发生,不能构成原电池;B
项,通过的电量与锌的析出量有确定的关系;C项,电流恒定,单位时间内提供
给阴极的电量就一定,析出的锌的量也一定;D项,镀锌层破损后形成的Zn-Fe
原电池起到牺牲阳极保护阴极的作用。
1.图解电解池工作原理(阳极为惰性电极)
2.正确判断电极产物
(1)阳极产物的判断首先看电极,如果是活性电极作阳极,则电极材料失电子,
电极溶解(注意:铁作阳极溶解生成Fe
2+
,而不是Fe
3+
);如果是惰性电极,则需看
溶液中阴离子的失电子能力,阴离子放电顺序为S
2-
>I
-
>Br
-
>Cl
-
>OH
-
>含氧酸根
离子>F
-
。
(2)阴极产物的判断直接根据阳离子的放电顺序进行判断:Ag
+
>Hg
2+
>Fe
3+
>
Cu
2+
>H
+
>Pb
2+
>Sn
2+
>Fe
2+
>Zn
2+
>Al
3+
>Mg
2+
>Na
+
>Ca
2+
>K
+
。
3.对比掌握电解规律(阳极为惰性电极)
电解类型
电解质实例
溶液复原物质
电解水
NaOH、H
2
SO
4
或Na
2
SO
4
水
电解电解质
HCl或CuCl
2
原电解质
放氢生碱型
NaCl
HCl
放氧生酸型
CuSO
4
或AgNO
3
CuO或Ag
2
O
特别提醒
电解后有关电解质溶液恢复原态的问题应该用质量守恒法分
析。一般是加入阳极产物和阴极产物形成的化合物,但也有特殊情况,如用惰
性电极电解CuSO
4
溶液,Cu
2+
完全放电之前,可加入CuO或CuCO
3
复原,而Cu
2+
完
全放电之后,应加入Cu(OH)
2
或Cu
2
(OH)
2
CO
3
复原。
考向一 电解原理及规律的应用
1.(2019山东德州模拟)高氯酸在化工生产中有广泛应用,工业上以NaClO
4
为
原料制备高氯酸的原理如图所示。下列说法正确的是
( )
A.上述装置中,f极为光伏电池的正极
B.阴极的电极反应为2H
2
O-4e
-
4H
+
+O
2
↑
C.d处得到较浓的NaOH溶液,c处得到HClO
4
D.若转移2 mol电子,理论上生成100.5 g HClO
4
答案
C 电解池中阳离子向阴极移动,即连接f一极的为阴极,f为电源的负
极,故A错误;阴极上阳离子得到电子发生还原反应,故B错误;阳极的电极反应
为2H
2
O-4e
-
4H
+
+O
2
↑,阴极的电极反应为4H
2
O+4e
-
4OH
-
+2H
2
↑,电池
放电过程是电解水的过程,即在阳极水失去电子,所以在阳极得到高氯酸的浓
溶液,在阴极得到浓的NaOH溶液,故C正确;根据阳极电极反应式可知,转移
2 mol电子时,生成2 mol HClO
4
,理论上生成201 g HClO
4
,故D错误。
2.(2019广东深圳4月第二次调研)电解法处理CO
2
和SO
2
混合污染气的原理如
图所示,电解质为熔融碳酸盐和硫酸盐,通电一段时间后,Ni电极表面形成掺
杂硫的碳积层。下列说法错误的是
( )
A.Ni电极表面发生了还原反应
B.阳极的电极反应为:2O
2-
-4e
-
O
2
↑
C.电解质中发生的离子反应有:2SO
2
+4O
2-
2S
D.该过程实现了电解质中碳酸盐和硫酸盐的自补充循环
答案
C 由题图可知,Ni电极表面发生了S
转化为S,C
转化为C的反应,
为还原反应,SnO
2
电极上发生了2O
2-
-4e
-
O
2
↑,为氧化反应,所以Ni电极为
阴极,SnO
2
电极为阳极,据此可知A、B正确;电解质中发生的离子反应有:2SO
2
+O
2
+2O
2-
2S
和CO
2
+O
2-
C
,故C错误;在S
和C
被还原的同时
又不断生成S
和C
,实现了电解质中碳酸盐和硫酸盐的自补充循环,故D
正确。
3.(2019北京理综,27节选)(2)可利用太阳能光伏电池电解水制高纯氢,工作示
意图如下。通过控制开关连接K
1
或K
2
,可交替得到H
2
和O
2
。
①制H
2
时,连接
。产生H
2
的电极反应式是
。
②改变开关连接方式,可得O
2
。
③结合①和②中电极3的电极反应式,说明电极3的作用:
。
答案
①K
1
2H
2
O+2e
-
H
2
↑+2OH
-
③制H
2
时,电极3发生反应:Ni(OH)
2
+OH
-
-e
-
NiOOH+H
2
O。制O
2
时,上述电
极反应逆向进行,使电极3得以循环使用
解析
①控制开关连接K
1
时,电极1作阴极,H
2
O在电极周围放电产生H
2
。
③开关连接K
1
时,电极3作阳极,Ni(OH)
2
被氧化为NiOOH;开关连接K
2
时,电极3
作阴极,NiOOH被还原为Ni(OH)
2
。
归纳总结
电解池电极反应式的书写
考向二 电化学多池串联装置
4.(2019江西临川一中、南昌二中3月联考)利用膜技术原理和电化学原理制
备少量硫酸和绿色硝化剂N
2
O
5
,装置如图所示,下列说法正确的是
( )
A.电极b反应式是O
2
+4e
-
+2H
2
O
4OH
-
B.电解后乙装置d电极附近溶液的pH不变
C.c电极上的电极反应式为N
2
O
4
-2e
-
+H
2
O
N
2
O
5
+2H
+
D.甲中每消耗1 mol SO
2
,乙装置中有1 mol H
+
通过隔膜
答案
B 甲装置为原电池,其中a电极为负极,b电极为正极,正极的电极反应
式为O
2
+4e
-
+4H
+
2H
2
O,A项错误;乙装置是电解池,均采用了惰性电极,d电
极为阴极,电极反应式为2H
+
+2e
-
H
2
↑,虽然消耗了H
+
,但同时有等量的H
+
从阳极区迁移过来,故溶液的pH不变,B项正确;c电极为阳极,发生氧化反应:
N
2
O
4
-2e
-
+2HNO
3
2N
2
O
5
+2H
+
,C项错误;甲装置中消耗1 mol SO
2
转移2 mol电
子,乙装置中有2 mol H
+
通过隔膜,D项错误。
5.(2019湖北恩施质检)现代社会环境问题越来越引起人们的关注,可通过膜
电池除去污水中的乙酸钠和对氯苯酚(
),同时利用此装置
产生的电能进行粗铜的精炼,装置如下图所示。下列说法正确的是
( )
A.X电极为粗铜,Y电极为纯铜
B.电解过程中,乙中电解质溶液(即CuSO
4
溶液)的浓度保持不变
C.A极的电极反应式为
+e
-
+Cl
-
D.当电路中有0.4 mol e
-
转移时,B极区产生的HC
的数目为0.1
N
A
(不考虑水
解等因素)
答案
D 粗铜精炼的过程中,粗铜作阳极,与电源的正极相连;纯铜作阴极,
与电源的负极相连,故X电极为纯铜,Y电极为粗铜,A项错误。粗铜精炼的过
程中,在阳极粗铜中的Zn、Fe、Cu依次放电,阴极始终是Cu
2+
放电,故电解前
后乙中
CuSO
4
溶液的浓度会降低,B项错误。A极的电极反应式应为
+H
+
+2e
-
+Cl
-
,C项错误。B极的电极
反应式为CH
3
COO
-
-8e
-
+4H
2
O
2HC
+9H
+
,故当电路中有0.4 mol e
-
转移
时,B极区产生的HC
的数目为0.1
N
A
,D项正确。
归纳总结
电化学计算的常用方法
考向三 电化学中的“膜”化学
6.(2019山东青岛调研)再生铅行业是我国在重视环境保护和充分利用有色金
属再生资源的情况下逐步发展起来的新兴产业。从废旧铅蓄电池中回收铅
的工艺为:
废铅
PbO
Na
2
PbCl
4
Pb
电解原理如图所示。下列说法正确的是
( )
A.阴极区电极反应式为2H
+
+2e
-
H
2
↑
B.电解过程中阳极附近pH明显增大
C.Na
2
PbCl
4
浓度下降后,在阴极区加入PbO,可实现电解质溶液的再生使用
D.电路中流经4 mol电子,阴极可得207 g铅
答案
C 阳极反应为2H
2
O-4e
-
O
2
↑+4H
+
,同时阳极区的H
+
移向阴极,阳
极区硫酸浓度增大,pH降低,B项错误;阴极发生的反应为PbC
+2e
-
Pb+
4Cl
-
,同时H
+
通过质子交换膜,阴极区形成HCl/NaCl溶液,电解后向其中加入
PbO,可以生成PbC
,A项错误、C项正确;电路中通过4 mol电子时,阴极可得
414 g铅,D项错误。
7.(2019江西上饶六校第一次联考)生产硝酸钙的工业废水中常含有NH
4
NO
3
,
可用电解法净化,其工作原理如图所示。下列有关说法正确的是
( )
A.a极为电源负极,b极为电源正极
B.装置工作时电子由b极流出,经导线、电解槽流入a极
C.Ⅰ室能得到副产品浓硝酸,Ⅲ室能得到副产品浓氨水
D.阴极的电极反应式为2N
+12H
+
+10e
-
N
2
↑+6H
2
O
答案
C a为电源正极,b为电源负极,故A错误;电解槽中没有电子通过,故B
错误;Ⅰ室为阳极室,电极反应式为2H
2
O-4e
-
O
2
↑+4H
+
,得到较浓的硝酸,
Ⅲ室为阴极室,电极反应式为2H
2
O+2e
-
H
2
↑+2OH
-
,N
与OH
-
反应生成
NH
3
·H
2
O,得到较浓的氨水,故C正确,D错误。
拓展延伸
隔膜的类型及作用
(1)隔膜种类:有三类,①阳离子交换膜,简称阳膜,允许阳离子通过,但不允许阴
离子通过;②阴离子交换膜,简称阴膜,允许阴离子通过,但不允许阳离子通过;
③质子交换膜,只允许H
+
通过,不允许其他任何离子通过。
(2)隔膜的作用:能将两极区隔离,阻止两极区产生的物质接触,防止副反应的
发生,能选择性地通过离子,起到平衡电荷、形成闭合回路的作用。
(3)有“膜”条件下离子的定向移动:仍是由“同性电荷相排斥、异性电荷相
吸引”的规律决定的,只是阳离子交换膜会阻断阴离子的定向移动,阴离子交
换膜会阻断阳离子的定向移动。
素养引领·情境命题
1.相同条件下,CO与O
2
、I
2
与O
2
反应过程的能量变化如下图所示:
对于反应:5CO(g)+I
2
O
5
(s)
5CO
2
(g)+I
2
(s),下列说法正确的是
( )
A.该反应的Δ
H
=(5
E
1
-5
E
2
) kJ·mol
-1
B.增大压强时,CO的平衡转化率增大
C.升高温度时,CO的平衡转化率减小
D.平衡后,分离出部分I
2
可使CO的平衡转化率增大
答案
C 根据图示写出热化学方程式:
①CO(g)+1/2O
2
(g)
CO
2
(g) Δ
H
=-
E
1
kJ·mol
-1
②I
2
(s)+5/2O
2
(g)
I
2
O
5
(s) Δ
H
=-
E
2
kJ·mol
-1
根据盖斯定律,①
×
5-②可得题给反应的热化学方程式,故焓变为(
E
2
-5
E
1
) kJ·
mol
-1
,A项错误;该反应是反应前后气体的分子数不变的反应,平衡不受压强影
响,B项错误;从图像可知,该反应为放热反应,升高温度平衡逆向移动,CO的平
衡转化率减小,C项正确;因I
2
是固体,分离出碘,对化学平衡无影响,D项错误。
2.新型锌碘液流电池具有能量密度高、循环寿命长等优势,其工作原理如图
所示。
下列说法错误的是
( )
A.放电时电流从石墨电极流向锌电极
B.充电时阳极反应式为3I
-
-2e
-
C.若将阳离子交换膜换成阴离子交换膜,放电时正负极也随之改变
D.放电时左侧电解质储罐中的离子总浓度增大
答案
C 放电时,Zn是负极,石墨是正极,电流由正极经过导线流向负极,即
电流从石墨电极流向锌电极,A项正确;充电时,阳极发生失去电子的氧化反
应,与原电池的正极反应式相反,即充电时阳极反应式为3I
-
-2e
-
,B项正
确;放电时,Zn是比较活泼金属,作负极,石墨作正极,无论离子交换膜是阳离子
交换膜,还是阴离子交换膜,放电时正、负极反应均不会改变,C项错误;放电
时,左侧即正极反应式为
+2e
-
3I
-
,所以储罐中的离子总浓度增大,D项正确。
3.双极膜电渗析一步法盐制酸碱的技术进入了工业化阶段,某科研小组研究
采用BMED膜堆(如图所示)模拟以精制浓海水为原料直接制备酸和碱。
BMED膜堆包括阳离子交换膜、阴离子交换膜和双极膜(a、d)。已知:在直
流电源的作用下,双极膜内中间界面层发生水的解离,生成H
+
和OH
-
。下列说
法正确的是
( )
A.电极Y连接电源的正极,发生还原反应
B.Ⅰ口排出的是混合碱,Ⅱ口排出的是淡水
C.电解质溶液采用Na
2
SO
4
溶液可避免有害气体的产生
D.a左侧膜为阳离子交换膜,c为阴离子交换膜
答案
C 氢氧根离子向左侧移动,说明电极Y为阴极,所以电极Y连接电源
的负极,发生还原反应,A项错误。浓海水中的氯离子向左侧移动,钠离子向右
侧移动;双极膜中,氢离子向右侧迁移、氢氧根离子向左侧迁移,因此Ⅱ口排
出的是淡水,Ⅰ口排出的是盐酸,Ⅲ口排出的是碱液,B项错误。由于氯离子放
电会产生有毒的气体氯气,加入Na
2
SO
4
溶液,目的是增加溶液的导电性;氯离
子移向Ⅰ室,氢离子通过a移向Ⅰ室,在Ⅰ室得到HCl,可避免有害气体的产生,
C项正确。钠离子移向Ⅲ室,c为阳离子交换膜,氢氧根离子向左侧移动,所以a
左侧膜为阴离子交换膜,D项错误。
相关文档
- 2019届二轮复习化学反应与能量热化2021-04-17 11:24:365页
- 2021版高考化学一轮复习核心素养测2021-04-17 10:27:3811页
- 高考化学易错考考点模拟训练卷化学2021-04-17 09:40:506页
- 2020届高考化学一轮复习化学反应与2021-04-17 03:06:318页
- 高中化学 第一章、第二章 化学反应2021-04-16 22:54:259页
- 人教版化学必修二2-3-1课件第二章 2021-04-16 20:43:4160页
- 2020_2021学年高中化学第一章化学2021-04-16 19:10:119页
- 2020版高中化学 专题2 化学反应与2021-04-16 17:54:532页
- 2020版高考化学大二轮优选习题 专2021-04-16 17:44:189页
- 2020届二轮复习专题五 化学反应与2021-04-16 17:03:2011页