- 863.40 KB
- 2021-04-17 发布
溶解度曲线应用集训
专题
八
大题
题
空逐空突破
(
十三
)
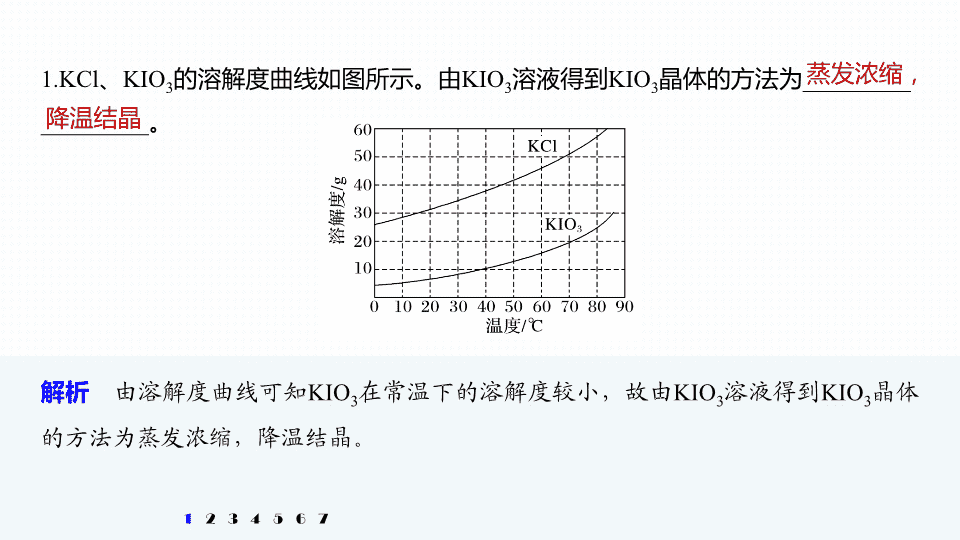
1.KCl
、
KIO
3
的溶解度曲线如图所示。由
KIO
3
溶液得到
KIO
3
晶体的方法为
_________
_________
。
1
2
3
4
5
6
7
解析
由溶解度曲线可知
KIO
3
在常温下的溶解度较小,故由
KIO
3
溶液得到
KIO
3
晶体的方法为蒸发浓缩,降温结晶。
蒸发浓缩,
降温结晶
硫酸
锰在不同温度下的溶解度和该温度范围内析出晶体的组成如图所示。
从过滤所得的滤液中获得较高纯度
MnSO
4
·H
2
O
的操作是:控制温度在
80
~
90
℃
之间蒸发结晶,
_________
,使固体
MnSO
4
·H
2
O
与溶液分离,
_____________________________
、真空干燥。
1
2
3
4
5
6
7
解析
据溶解度曲线图,要从过滤所得
MnSO
4
溶液中获得较高纯度的
MnSO
4
·H
2
O
晶体,应在
80
~
90
℃
之间进行蒸发结晶、趁热过滤,再用
80
~
90
℃
的蒸馏水洗涤
MnSO
4
·H
2
O
晶体
2
~
3
次,最后真空干燥。
趁热过滤
用
80
~
90
℃
的蒸馏水洗涤
2
~
3
次
2.
硫酸锰在不同温度下结晶可分别得到
MnSO
4
·7H
2
O
、
MnSO
4
·5H
2
O
和
MnSO
4
·H
2
O
。
3.
以废旧铅蓄电池的含铅废料
(
主要含
Pb
、
PbO
、
PbO
2
、
PbSO
4
)
和稀
H
2
SO
4
为原料制备高纯
PbO
,实现铅的再生利用。其主要流程如
左图
:
1
2
3
4
5
6
7
PbO
溶解在
NaOH
溶液中,存在平衡:
PbO(s)
+
NaOH(aq)
NaHPbO
2
(aq)
,其溶解度曲线如
右
图所示。结合图示溶解度曲线,简述由粗品
PbO
得到高纯
PbO
的操作
____
________________________________________________________________________________________________
。
35%NaOH
溶液中,加热至
110
℃
,充分溶解后,趁热过滤,冷却结晶,过滤、洗涤并干燥得到高纯
PbO
固体
在
解析
根据图像可知
35% NaOH
溶液的溶解度受温度影响较大,超过
110
℃
随温度升高而降低,因此由粗品
PbO
得到高纯
PbO
的操作为将粗
PbO
溶解在一定量
35%NaOH
溶液中,加热至
110
℃
,充分溶解后,趁热过滤,冷却结晶,过滤、洗涤并干燥得到高纯
PbO
固体。
1
2
3
4
5
6
7
4.
由工业级碳酸锂
(
含有少量碳酸镁等杂质
)
制备高纯碳酸锂。实验过程如
左图
:
1
2
3
4
5
6
7
已知在不同温度下蒸发分解碳酸锂的产率与溶解度关系如
右
图:
90
℃
以下,随温度升高,碳酸锂产率升高的原因可能是
________________________
___________________________________________
。
碳酸氢锂随温度的升高分
解产率增大,碳酸锂的溶解度随温度升高而减小
1
2
3
4
5
6
7
解析
由蒸发分解碳酸锂的产率与溶解度关系可知随温度升高碳酸锂的溶解度下降,而温度升高碳酸氢锂也易分解生成碳酸锂,两个因素共同促进了随温度升高,碳酸锂产率的升高。
已知:
①
卤块的主要成分为
MgCl
2
·6H
2
O
,含有
MgSO
4
、
FeCl
2
等杂质。
②
几种化合物的溶解度
(
S
)
随温度
(
T
)
的变化曲线如
右
图。
(1)
加入
BaCl
2
的目的是除
_____
,如何判断该离子已除尽:
_________________________
________________________________
。
5.Mg(ClO
3
)
2
常用作催熟剂、除草剂等,
左
图为制备少量
Mg(ClO
3
)
2
·6H
2
O
的方法:
1
2
3
4
5
6
7
静置,取上层清液加入
BaCl
2
,
解析
加入
BaCl
2
的目的是除去
,钡离子与硫酸根离子结合生成硫酸钡沉淀,过滤除去;
检验
是否除尽的方法是静置,取上层清液加入
BaCl
2
,若无白色沉淀,则
已沉淀完全。
1
2
3
4
5
6
7
(2)
加入
NaClO
3
饱和溶液会发生反应:
MgCl
2
+
2NaClO
3
==
=Mg(ClO
3
)
2
+
2NaCl
↓
,请利用该反应,结合溶解度图,制取
Mg(ClO
3
)
2
·6H
2
O
的实验步骤依次为:
①
取样,加入
NaClO
3
饱和溶液充分反应;
②
蒸发浓缩;
③
_________
;
④
冷却结晶;
⑤
过滤、洗涤,获得
Mg(ClO
3
)
2
·6H
2
O
晶体。
1
2
3
4
5
6
7
趁热过滤
解析
Mg(ClO
3
)
2
的溶解度受温度变化影响大,温度高时溶解度较大,温度低时溶解度较小,所以需要趁热过滤除去氯化钠。
6.
工业上制取氯酸钾的主要步骤为:
Ⅰ
.
将
Cl
2
通入石灰浆,在
75
℃
左右充分反应,然后过滤;
Ⅱ
.
向滤液中加入稍过量的
KCl
固体,进行适当操作可析出
KClO
3
固体。
右
图是有关物质的溶解度曲线。
步骤
Ⅱ
中,若溶液中
KClO
3
的含量为
147 g·L
-
1
,则
KClO
3
的物质的量浓度为
___________
。从该溶液中
1
2
3
4
5
6
7
尽
可能多地析出
KClO
3
固体的方法是
____________________
。
1.2 mol·L
-
1
蒸发浓缩、冷却结晶
解析
若溶液中
KClO
3
的含量为
147 g·L
-
1
,则
1 L
溶液中含有
KClO
3
的物质的量是
147 g÷122.5 g·mol
-
1
=
1.2 mol
,因此物质的量浓度为
1.2 mol·L
-
1
。由于氯酸钾的溶解度随温度的升高而增大,所以从该溶液中尽可能多地析出
KClO
3
固体的操作应该是蒸发浓缩、冷却结晶。
1
2
3
4
5
6
7
7.
以高氯冶炼烟灰
(
主要成分为铜锌的氯化物、氧化物、硫酸盐,少量铁元素和砷元素
)
为原料,可回收制备
Cu
和
ZnSO
4
·H
2
O
,其主要实验流程如
左图
:
1
2
3
4
5
6
7
ZnSO
4
的溶解度曲线如
右
图所示。
“
电解
”
后,从溶液中回收
ZnSO
4
·H
2
O
的实验操作为
_____________________________________
___________________
。
在
330 K
以上
(330
~
380 K)
蒸发结晶,趁热
过滤,热水洗涤干燥
解析
根据
ZnSO
4
的溶解度曲线,
“
电解
”
后,从溶液中回收
ZnSO
4
·H
2
O
的实验操作为:在
330 K
以上
(330
~
380 K)
蒸发结晶,趁热过滤,热水洗涤干燥。
1
2
3
4
5
6
7